Максимальное число электронов на квантовых уровнях и подуровнях
| Энергетический уровень | Энергетический подуровень | Возможные значения магнитного квантового числа ml | Число АО | Максимальное число электронов | ||
| в подуровне | в уровне | на подуровне | на уровне | |||
| K (n=1) | s (l=0) | 0 | 1 | 1 | 2 | 2 |
| L (n=2) | s (l=0) p (l=1) | 0 –1, 0, 1 | 1 3 | 4 | 2 6 | 8 |
| M (n=3) | s (l=0) p (l=1) d (l=2) | 0 –1, 0, 1 –2, –1, 0, 1, 2 | 1 3 5 | 9 | 2 6 10 | 18 |
| N (n=4) | s (l=0) p (l=1) d (l=2) f (l=3) | 0 –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 | 1 3 5 7 | 16 | 2 6 10 14 | 32 |
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно которому электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) – в порядке возрастания n.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией. При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, а подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Например, электронная конфигурация атома серы имеет вид:
|
|
|
16S 1s22s22p63s23p4, а ванадия 23V 1s22s22p63s23p63d34s2.
Химические свойства атомов определяются в основном строением наружных энергетических уровней, которые называются валентными. Полностью завершенные энергетические уровни в химическом взаимодействии не участвуют, поэтому часто для краткости записи электронной конфигурации атома их обозначают символом предшествующего благородного газа. Так, для серы [Ne]3s23p4; для ванадия [Ar]3d34s2. Одновременно сокращенная запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента.
В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы. Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются sэлементами. У s-элементов валентными являются s-электроны внешнего энергетического уровня. У р-элементов последним заполняется рподуровень внешнего уровня. У них валентные электроны расположены на p- и s-подуровнях внешнего уровня. У d-элементов в последнюю очередь заполняется d-подуровень предвнешнего уровня и валентными являются sэлектроны внешнего и d-электроны предвнешнего энергетического уровней. У f-элементов последним заполняется f-подуровень третьего снаружи энергетического уровня.
|
|
|
Электронная конфигурация атома может быть изображена также в виде схем размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с противоположно направленными спинами  . Порядок размещения электронов в пределах одного подуровня определяется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
. Порядок размещения электронов в пределах одного подуровня определяется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
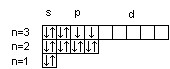
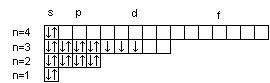 16S
16S
23V
Суммарный спин р-электронов третьего энергетического уровня атома серы равен ms = ½ – ½ + ½ + ½ = 1; d-электронов атома ванадия – ms = ½ + ½ + ½ = 3/2.
Часто изображают графически не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны, например 16S…3s2 3p4 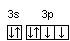 ; 23V…3d34s2
; 23V…3d34s2 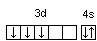
|
|
|
При графическом изображении электронной конфигурации атома в возбужденном состоянии наряду с заполненными изображают вакантные валентные орбитали. Например, в атоме фосфора на третьем энергетическом уровне имеется одна s-АО, три р-АО и пять d-АО. И электронная конфигурация атома фосфора в основном состоянии имеет вид:
15Р… 3s2 3p3 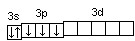
Валентность фосфора, определяемая числом неспаренных электронов, равна 3. При переходе атома в возбужденное состояние происходит распаривание электронов состояния 3s и один из электронов с s-подуровня может перейти на d-подуровень:
Р*… 3s23p3 3d1 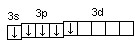
При этом валентность фосфора меняется с трех (РСl3) в основном состоянии до пяти (РCl5) в возбужденном состоянии.
Примеры решения задач
Пример 3.1. Запишите электронную конфигурацию атома титана. Сколько свободных d-орбиталей содержится на предвнешнем энергетическом уровне Тi?
Решение.Порядковый номер титана (Ti) в периодической системе 22. Следовательно, положительный заряд ядра равен +22 и столько же электронов в атоме титана. Поскольку титан находится в 4-м периоде, электроны располагаются на 4-х энергетических уровнях следующим образом: 22Ti 2е, 8е, 10е, 2е. Запись электронной конфигурации атома титана по уровням и подуровням имеет вид: 1s22s22p63s23p63d24s2.
|
|
|
В соответствии с правилом Хунда электроны на d-подуровне у атома
титана располагаются следующим образом: 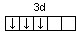 .
.
Очевидно, что на предвнешнем энергетическом уровне атома титана содержится три свободные d-орбитали.
Пример 3.2. Возможно ли наличие в атоме двух электронов с одинаковыми значениями трех квантовых чисел: l,ml, ms? Приведите примеры. Решение. Да, возможно, это не противоречит принципу Паули. Два электрона, характеризующиеся одинаковыми значениями трех квантовых чисел l,ml, ms, должны отличаться главным квантовым числом n. Например, в атоме фтора, электронная конфигурация которого 1s22s22p5, для электронов 1s1 и 2s1 квантовые числа будут иметь следующие значения:
Для 1s1n = 1, l = 0, ml= 0, ms= ½.
Для 2s1n = 2, l = 0, ml= 0, ms= ½.
Пример 3.3. Какие орбитали атома заполняются электронами раньше 5d или 6s; 4f или 6p?
Решение. Последовательность заполнения орбиталей осуществляется в соответствии с правилом Клечковского и определяется суммой (n+l). Для подуровня 5d сумма (n+l) равна (5+2) = 7, для подуровня 6s (6+0) = 6. В первую очередь заполняются орбитали с меньшей энергией, следовательно вначале заполняется 6s, потом 5d. Для подуровней 4f и 6р сумма (n+l) одинакова (4+3) = 7 и (6+1) = 7. При одинаковом значении суммы (n+l) раньше заполняется подуровень с меньшим n, следовательно 4f.
Пример 3.4. Запишите электронную конфигурацию ионов Fe3+ и S2–. Решение.Электронная конфигурация атома железа 26Fe 1s22s22p63s23p63d64s2. Если атом железа отдаст три электрона, он превратится в ион: Fe0 – 3e → Fe3+. В первую очередь атом отдает электроны с более высокого энергетического уровня и подуровня. Электронная конфигурация ионов Fe3+ имеет вид 1s22s22p63s23p63d54s0. Электронная конфигурация атома серы 16S 1s22s22p63s2 3p4. Приняв два электрона S0 + 2e → S2–, атом серы превращается в ион S2–, электронная конфигурация которого 1s22s22p63s23p6.
Пример 3.5. Охарактеризуйте квантовыми числами электроны состояния 3р3.
Решение. Изобразим графически распределение электронов состояния 3р3: 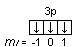 . Каждый электрон в атоме характеризуется набором
. Каждый электрон в атоме характеризуется набором
четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой. Для указанных электронов главное квантовое число n равно 3. Электроны находятся на р-подуровне, следовательно, для всех трех электронов l=1. Три электрона находятся на разных орбиталях, которые ориентированы по трем разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=1, ml принимает значение –1, 0, 1 (значение mlуказано под каждой орбиталью). Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3р3 характеризуются следующими квантовыми числами:
n = 3, l = 1, ml= –1, ms= ½ (или –½) n = 3, l = 1, ml= 0, ms= ½ (или –½) n = 3, l = 1, ml= 1, ms= ½ (или –½)
Дата добавления: 2018-06-27; просмотров: 2781; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
