Первый способ получения металлического цинка
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Тверской государственный университет»
Химико-технологический факультет
Специальность «Фундаментальная и прикладная химия»
Кафедра неорганической и аналитической химии
Цинк
Курсовая работа по дисциплине
Неорганическая химия
Автор:
Шамахов Вячеслав Игоревич
1 курс, 16 группа
Научный руководитель:
к.х.н.
Феофанова Мариана Александровна
Тверь 2018
Оглавление
ВВЕДЕНИЕ 3
1. ИСТОРИЯ ОТКРЫТИЯ 5
2. СТРОЕНИЕ АТОМА 6
3. ПОЛУЧЕНИЕ ЦИНКА
3.1 Промышленный способ 8
3.2 Лабораторный способ
4. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛА 10
5. ХИМИЧЕСКИЕ СВОЙСТВА 12
5.1 Простое вещество 12
5.2 Амфотерность 12
5.3 Соли цинка 13
5.4 Комплексные соединения 15
5.5 Нерастворимые вещества 16
6. БИОЛОГИЧЕСКАЯ РОЛЬ ЦИНКА 18
6.1 Положительное влияние 18
6.2 Токсичность 18
7. ПРИМЕНЕНИЕ 20
ЗАКЛЮЧЕНИЕ 21
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ 22
ВВЕДЕНИЕ
Мы с Вами живем в двадцать первом веке, в эпоху, когда уже сейчас то, что раньше казалось фантастикой, становится обыденным. Продолжают развиваться машиностроение, военная промышленность и другие. Не отстает и химическая промышленность.
|
|
|
Когда люди впервые получили огонь, они получили доступ к первым химическим реакциям. Эти превращения могли быть результатом горения или вызываться выделяемым при горении теплом. К примеру, птицу можно было сварить, и она изменяла цвет, вкус, становилась мягче. Глину можно было обжечь, и она становилась прочнее. Если человек разжигал костер в песке, он мог в золе найти стеклянные шарики. Затем уже в Древнем Египте знания в области химии помогали обрабатывать драгоценные камни и бальзамировать тела усопших.С началом нашей эры в средние века алхимики занимались поиском философского камня, искали способ превратить любой металл в золото, пытались создать эликсир, свойства которого могли бы дать и бессмертие создателю.
Совершенно иное понимание задач химии наметилось в работах двух врачей-современников – Георга Бауэра (1494-1555) и Теофраста Бомбаста фон Гогенгейма (1493-1541), которые поняли, что задачей химии является не поиск методов синтеза золота, а изготовление лекарственных средств[1, С.15 ].
Потребность в химической промышленности возросла в период индустриализации и промышленных революций после средневековья. Химию рассматривали не только как науку для изготовления лекарств, но как знания для изготовления каких-либо других вещей и объектов. Примерами могут послужить создание металлургических предприятий по изготовлению различных сплавов, производство красящих материалов для текстиля, получение красок для живописи и т.д.
|
|
|
Целью этой работы является ознакомление со свойствами, применением и нахождением цинка в нашем окружении.
Задачи работы:
· Изучение физических и химических свойств объекта исследования
· Ознакомление со способом получения
· Ознакомление с областью применения.
ИСТОРИЯ ОТКРЫТИЯ
 Цинк известен людям с древних времен в виде сплава с медью, называемым латунью. Содержание цинка в сплаве могло быть от 5% до 45%. Из латуни делали украшения, статуи, фигуры и другие изделия.
Цинк известен людям с древних времен в виде сплава с медью, называемым латунью. Содержание цинка в сплаве могло быть от 5% до 45%. Из латуни делали украшения, статуи, фигуры и другие изделия.
 Более вероятно, что цинк получил свое название от немецкого Zinke, означающее «зуб, зубцы», потому что кристаллический цинк имеет острые грани, похожи на иглах [2, C. 509].
Более вероятно, что цинк получил свое название от немецкого Zinke, означающее «зуб, зубцы», потому что кристаллический цинк имеет острые грани, похожи на иглах [2, C. 509].
Первый способ получения металлического цинка
Получение металлического цинка было предложено английским ученым Уильямом Чемпионом в 1738 году дистилляционным (пирометаллургическим) способом в ретортах[1][3, C. 204], который заключается в том, что цинковый концентрат подвергают обжигу (для получения оксида цинка), а затем восстанавливают коксом:
|
|
|
ZnO + C = Zn(пар)↑ +CO
после чего газообразный цинк конденсируется в на поверхности, откуда жидкий металл по мере наполнения вычерпывают. Однако этот способ дает не более 20% цинка в застывшей смеси металлов.
СТРОЕНИЕ АТОМА

 В периодической таблице Д. И. Менделеева цинк расположен в четвертого группе, в пятом ряду, IIB подгруппы. Его атом имеет 4s2 3d10конфигурацию внешнего электронного уровня. Последние десять электронов выполняют функцию экранирования, поэтому для цинка и его аналогов характерна степень окисления +2. Поскольку цинк является d-элементом, он, как и другие, может образовывать различные комплексные соединения. Магнитные и оптические свойства цинка как комплексообразователя можно определить, используя следующую диаграмму распределения электронов по d-έ и d-γ подуровням.
В периодической таблице Д. И. Менделеева цинк расположен в четвертого группе, в пятом ряду, IIB подгруппы. Его атом имеет 4s2 3d10конфигурацию внешнего электронного уровня. Последние десять электронов выполняют функцию экранирования, поэтому для цинка и его аналогов характерна степень окисления +2. Поскольку цинк является d-элементом, он, как и другие, может образовывать различные комплексные соединения. Магнитные и оптические свойства цинка как комплексообразователя можно определить, используя следующую диаграмму распределения электронов по d-έ и d-γ подуровням.
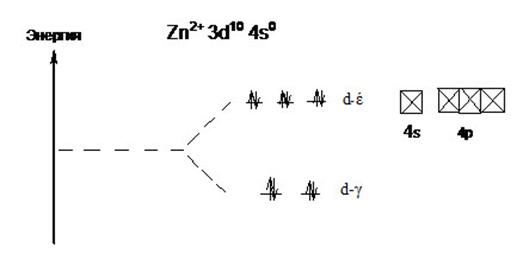
Рис. 2.2. расщепление d-подуровня Zn в тетраэдрическом поле лигандов.
Рассмотрев её, можно увидеть что, соединения цинка бесцветны, по причине того, что на всех d-подуровнях нет неспаренных электронов. По той же причине он обладает диамагнитными свойствами[2]. Координационное число цинка равняется 4, и поэтому подуровень d-γрасположен ниже, чем d-έ, следовательно, комплексные соединения цинка имеют форму тетраэдра. В комплексном ионе лиганды присоединяются к металлу на свободные 4s и 4p орбитали, образуя sp3 гибридизацию.
|
|
|
ПОЛУЧЕНИЕ ЦИНКА
Промышленный способ
Цинк, полученный пирометаллургическим способом[4], который был описан мною выше, подвергается рафинированию. Суть этого процесса заключается в том, чтобы уменьшить растворимость примесей путем охлаждения смеси до 430-450оС. После отстаивания чернового цинка в течении 24-36 часов, жидкий металл разделяется на три слоя: нижний содержит преимущественно свинец, второй кристаллы Fe и Zn, а третий очищенный цинк с примесями свинца и железа в количестве до 1%.
Существует и другой способ получения серебристого металла, путем гидрометаллургии, говоря более простым языком, путем электролиза. Данный метод имеет ряд преимуществ:
· извлечение большего количества цинка и сопутствующих элементов;
· большая комплексность использования сырья;
· высокое качество цинка;
· высокая механизация трудоемких процессов.
Суть этого способа заключается в следующем: цинк, обожженный до оксида, обрабатывают серной кислотой, для получения раствора сульфата цинка, данному процессу соответствует реакция:
ZnO + H2SO4 → ZnSO4 + H2O.
Однако следует заметить, что помимо необходимого цинка, по такой же схеме реагирует часть примесей. Раствор сульфата цинка очищают от ненужных веществ, после чего его отправляют на электролиз:
2ZnSO4 + 2H2O  2Zn↓ + H2SO4 + O2↑
2Zn↓ + H2SO4 + O2↑
K (-) Zn2+ + 2e-→ Zn0↓
A (+) 2H2O - 4e-→ 4H+ + O2↑.
Чистота цинка, выпадающего в осадок, напрямую зависит от чистоты раствора его сульфата. Полученный металл переплавляют в слитки. В Российской Федерации требования к цинку установлены в ГОСТ 3640-94 «Цинк, технические условия». Все отечественные марки цинка предусматривают чистоту металла не менее 97,5% [5, C.3].
Лабораторный способ
В лаборатории цинк так же можно получить методом электролиза. К примеру, можно взять сульфат цинка и пропустить ток через него:
2ZnSO4 + 2H2O  2Zn↓ + H2SO4 + O2↑
2Zn↓ + H2SO4 + O2↑
K (-) Zn2+ + 2e-→ Zn0↓
A (+) 2H2O - 4e-→ 4H+ + O2↑.
Так же цинк можно вытеснить из раствора его солей более активным металлом, к примеру, магнием. Мы самостоятельно провели этот эксперимент и убедились в осаждении цинка, когда масса магниевой стружки после реакции стала больше, чем до нее:
m0(Mg)=0,05г m(Mg+Zn)=0,07г.
К тому же на дно пробирки выпало несколько частиц металлического цинка, который потом растворился в растворе аммиака. Протекали следующие реакции:
ZnCl2 + Mg→Zn↓ + MgCl2
Zn + 4NH3∙H2O→ [Zn(NH3)4](OH)2 + H2↑ + 2H2O.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛА
Природный цинк состоит из пяти изотопов: Zn64, Zn66, Zn67, Zn68, Zn70, следовательно, учитывая их процент распространения в природе, средняя масса атома цинка составляет 65,39  .
.
В чистом виде, цинк – пластичный, ковкий, серебристо-белый металл, который покрывается оксидной пленкой, на свежем срезе имеет характерный металлический блеск. Примеси значительно повышают хрупкость металла, поэтому его легко сломать, этот процесс сопровождается треском от деформации кристаллической решётки твердого вещества.
Основные физические свойства металла приведены в таблице:
Таблица 1
Физические свойства некоторых металлов
| Металл | Плотность, г/см3 | Температура плавления, 0С | Твердость по Бринеллю | Временное сопротивление, кг/мм2 | Относительное удлинение, % | Отн. Сужение поперечного сечения, % |
| Алюминий | 2,7 | 658 | 20-37 | 8-11 | 40 | 85 |
Продолжение
| Вольфрам | 19,3 | 3370 | 160 | 110 | - | - |
| Железо | 7,87 | 1530 | 50 | 25-33 | 21-55 | 68-55 |
| Кобальт | 8,9 | 1490 | 125 | 70 | 3 | - |
| Магний | 1,74 | 651 | 25 | 17-20 | 15 | 20 |
| Марганец | 7,44 | 1242 | 20 | Хрупкий | Хрупкий | Хрупкий |
| Медь | 8,84 | 1083 | 35 | 22 | 60 | 75 |
| Никель | 8,9 | 1452 | 60 | 40-50 | 40 | 70 |
| Олово | 7,3 | 232 | 5-10 | 2-4 | 40 | 74 |
| Свинец | 11,34 | 327 | 4-6 | 1,8 | 50 | 100 |
| Хром | 7,14 | 1550 | 108 | Хрупкий | Хрупкий | Хрупкий |
| Цинк | 7,14 | 419 | 30-42 | 11,3-15 | 5-20 | - |
Цинк имеет относительно небольшую температуру плавления, поэтому его можно расплавить в домашних условия используя бытовой газ. Данный металл не может похвастаться высокой прочностью, но ее значение больше, чем у свинца или олова, это означает, что изогнуть металл руками будет немного труднее. Относительное удлинение тоже не самое большое и зависит от чистоты металла, поэтому по этому параметру металл можно отнести как близкому к хрупкости.
Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решетке с параметрами. Атомный радиус 1,37Å ; ионный Zn2+ - 0,83Å. Плотность твердого цинка 7,133 г/см3 (при 20 °С), жидкого 6,66 г/см3 (419,5 °С); tпл 419,5°С; tкип 906°С. Температурный коэффициент линейного расширения 39,7•10-3 (20-250 °С), коэффициент теплопроводности 110,950 вт/(м •К) 0,265 кал/см•сек•°С (20 °С), удельное электросопротивление 5,9•10-6 ом•см (20 °С), удельная теплоемкость Цинка 25,433 кдж/(кг•К.) [6,07 кал/(г•°С)]. Предел прочности при растяжении 200-250 Мн/м2 (2000-2500 кгс/см2. Цинк диамагнитен, его удельная магнитная восприимчивость -0,175•10-6.
ХИМИЧЕСКИЕ СВОЙСТВА
Простое вещество
Цинк может реагировать с неметаллами. Как уже говорилось выше, металл на воздухе покрывается оксидной пленкой:
Zn + O2→ 2ZnO.
Так же он может реагировать с галогенамии другими неметаллами при нагревании:
Zn + Hal2→ ZnHal2 (Hal2= Cl2, Br2, F2, I2)
Zn+ S  ZnS.
ZnS.
Амфотерность цинка
Цинк является амфотерным элементом, поэтому он может реагировать как с кислотами, с основаниями и с оксидами (кислотными и основными)Хорошо растворяется в азотной, серной и других кислотах при различных концентрациях:
3Zn + 8HNO3конц→3Zn(NO3)2 + 2N2O↑ + 4H2O
4Zn + 10HNO3р-р→ 4Zn(NO3)2 + NH4NO3 + 3H2O
4Zn + 5H2SO4конц→ 4ZnSO4 + H2S↑ + 4H2O
Zn + HCl → ZnCl2 + H2↑.
Чистый металл, его оксид и гидроксид способны реагировать с щелочами в растворах и в расплавах,с образованием цинкатов и тетрагидроксоцинкатов:
Zn + 2KOH  K2ZnO2 + H2↑
K2ZnO2 + H2↑
Zn +2NaOH + 2H2O→ Na2[Zn(OH)4] + H2↑.
Понимая, что цинк обладает амфотерными свойствами, является серебристым на внешний вид металлом, покрытый на воздухе оксидной пленкой и имеет характерный блеск на свежем срезе, его запросто можно спутать с алюминием, чьи характеристики похожи. Однако объект нашего исследования имеет способность растворяться в водном растворе аммиака с выделением газообразного водорода, чего не скажешь о втором металле:
Zn + 4NH3∙H2O → [Zn(NH3)4](OH)2 + H2↑ +2 H2O
Al + NH3∙H2O↛.
Соли цинка
Соли цинка, как и других металлов, тоже химически активны, т.е. могут вступать в реакции с другими веществами. К примеру, растворимые соединения могут реагировать с основаниями с образованием осадков:
Zn2+ + 2OH-→ Zn(OH)2↓.
Так же растворимые соли цинка способны подвергаться гидролизу: по катиону, в случае если соль от сильной кислоты, или по катиону и аниону, в случае если соль образована слабой кислотой. Например, наиболее стойкими к гидролизу солями являются сульфаты и нитраты цинка:
Zn(NO3)2 + 2HOH = Zn(OH)2↓ + 2HNO3.
Глядя в таблицу, находим константу диссоциации гидроксида цинка и находим конствнту гидролиза для нашей соли(гидролиз протекает по катиону, так как гидроксид цинка – слабое основание):
Таблица 2
Константы диссоциаций некоторых кислот и оснований [6, C. 579-587]
| H2SO4 | K1=1,2 ∙ 10-2 K2=1,6 ∙ 10-2 | NH4OH | K=1,8 ∙ 10-5 |
| HCN | K=7,9 ∙10-10 | Zn(OH)2 | K=4,0 ∙ 10-5 |
| HNO2 | K=4∙ 10-4 | Cu(OH)2 | K=3,4 ∙ 10-7 |
| CH3COOH | K=1,8 ∙ 10-5 | H2S | K1=6 ∙ 10-8, K2=1 ∙10-14 |
Kг=  =
=  = 2,5 ∙ 10-10.
= 2,5 ∙ 10-10.
Примером соли, гидролиз которой протекает по катиону и по аниону может быть ацетат цинка:
Zn(CH3COO)2 + 2H20 = Zn(OH)2↓ + 2CH3COOH
Рассчитываем константу гидролиза для этой соли:
Kг=  =
=  = 1,388∙10-5.
= 1,388∙10-5.
Сравним две константы, чтобы выяснить, какая соль больше подвергается гидролизу:
1,388∙ 10-5> 2,5 ∙ 10-10.
Константа гидролиза второй соли больше, чем константа для первой, а следовательно, ацетат цинка лучше подвергается гидролизу.
Так же соли цинка способны принимать участие в двойном гидролизе, это реакция обмена двух солей с последующим гидролизом одной из них. Можно разобрать следующий пример: двойной гидролиз сульфата цинка и нитрита натрия:
ZnSO4 + NaNO2 + HOH = Zn(OH)2↓ + Na2SO4 + HNO2.
Реакция протекает в две стадии: первая – реакция обмена между сульфатом цинка и нитритом натрия:
ZnSO4 + 2NaNO2 → Zn(NO2)2 + Na2SO4
Вторая стадия – гидролиз нитрита цинка:
Zn(NO2)2 + 2HOH = Zn(OH)2 + 2HNO2
Константа гидролиза будет равна 6,25 ∙ 10-7
Kг=  =
= 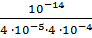 = 6,25 ∙ 10-7.
= 6,25 ∙ 10-7.
Комплексные соединения
Комплексные соединения способны участвовать в реакциях обмена с другими веществами используя внешнюю сферу:
Ba(NO3)2 + [Zn(NH3)4]SO4→ BaSO4↓ + [Zn(NH3)4](NO3)2.
Так же они могут менять свои лиганды в ходе реакций. Эта способность работает в том случае, если при взаимодействии образуется более стойкий комплексный ион. На первый взгляд, комплексные ионы никак не могут реагировать с другими веществами, используя внутреннюю сферу, казалось бы, что произойдет? Ведь лиганды заключены внутри молекулы и у них нет доступа к внешней среде. Но не все так просто, поэтому рассмотрим пример: взаимодействие тетраамминцинка катиона с цианид-ионом (к примеру, можно взять раствор сульфат тетраамминцинка и цианида калия)
[Zn(NH3)4]2+ + 4CN-→ [Zn(CN)4]2- + 4NH3↑.
Чтобы узнать, идет ли реакция, нужно сравнить константы нестойкости комплексных ионов тетраамминцинка катиона и тетрацианоцинкат аниона. Для первого иона будет значение 3,4∙10-10, для второго это 1,3∙10-17. Константа нестойкости второго иона меньше, чем константа первого, значит, он более устойчив, и данная реакция будет протекать с выделением газообразного аммиака.
Таблица 3
Константы нестойкости комплексных ионов [7, C . 334]
| NH3 | [Zn(NH3)4]2+ | 3,4 ∙ 10-10 |
| [Hg(NH3)4]2+ | 5,2 ∙ 10-20 | |
| [Cu(NH3)4]2+ | 2,1 ∙ 10-13 | |
| [Ag(NH3)2]2+ | 1 ∙ 10-7 | |
| CN- | [Ni(CN)4]2- | 5 ∙ 10-16 |
| [Fe(CN)6]3- | 1 ∙ 10-44 | |
| [Zn(CN)4]2- | 1,3 ∙ 10-17 | |
| [Au(CN)4]1- | 1 ∙ 10-56 |
Нерастворимые соединения
К нерастворимым соединениям относятся гидроксид, карбонат, сульфид, фосфат и другие соединения цинка. Мы предлагаем вам найти, сколько литров воды понадобится для растворения 1 грамма сульфида цинка, что и предлагаем вам сделать вместе с нами.
Необходимо знать значение ПР для Zn(OH)2 , поэтому заглянем в таблицу:
Таблица 4
| Вещество | ПР | Вещество | ПР | Вещество | ПР |
| Zn(OH)2 | 1,2∙10-17 | Ag2SO4 | 1,4∙10-5 | HgS | 4,0∙10-53 |
| ZnS | 1,1∙10-21 | AgCl | 1,8∙10-16 | Pb(OH)2 | 1,2∙10-15 |
| ZnCO3 | 1,4∙10-11 | Sn(OH)2 | 1,4∙10-28 | PbCO3 | 7,4∙10-14 |
| Cr(OH)3 | 6,3∙10-31 | SnS | 1,0∙10-25 | PbSO4 | 1,6∙10-8 |
| AgBr | 5,0∙10-13 | NiS | 3,2∙10-19 | PbS | 8,0∙10-28 |
| AgI | 8,3∙10-17 | Hg2Cl2 | 1,3∙10-18 | PbCl2 | 1,6∙10-5 |
| Ag2CO3 | 8,1∙10-12 | Hg(OH)2 | 3,0∙10-26 | CdS | 8,0∙10-27 |
ПР некоторых веществ [8, C. 383]
И так, мы имеем:
· m(ZnS)=1г
· ПР = 1.1∙10-21.
Переходим к решению: сначала записываем уравнение диссоциации
ZnS = Zn2+ + S2-.
Обозначим концетрацию ZnS за Х, тогда:
[ZnS] = [Zn2+] = [S2-] = X.
ПР равно произведению концетраций ионов, находим Х:
ПР = [Zn2+] ∙ [S2-] = Х2 = 1.1*10-21
Х = 3,32 ∙ 10-11.
Мы нашли концентрацию, теперь, исходя из ее формулы, находим объем воды, необходимый для растворения 1 грамма соли, выражаем его и находим:
CM =  →V =
→V = 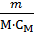 =
=  = 3, 31 ∙ 108.
= 3, 31 ∙ 108.
В литрах объем воды составляет 3,31 ∙ 108, а в метрах кубических 3,31 ∙ 105.
Вот такое немаленькое количество воды необходимо для растворения всего 1 грамма сульфида цинка!
БИОЛОГИЧЕСКАЯ РОЛЬ ЦИНКА
Положительное влияние
Цинк — необходимый микроэлемент для нормального роста клеток, их развития и дифференциации. Он участвует в синтезе ДНК, транскрипции РНК, делении клеток и их активации. Цинк важный структурный компонент многих белков и ферментов, включая транскрипционные факторы. Рекомендуемое потребление цинка составляет 8 мг/день для женщин и 11 мг/день для мужчин старше 19 лет. Всасывание цинка зависит от его концентрации в тонком кишечнике, главным образом, в тощей кишке. При циррозе печени всасывание нарушено и одновременно повышена экскреция цинка. Из общего количества металла в организме приблизительно 10 % метаболически активно. Печень является основным органом, участвующим в метаболизме цинка. Среди основных гормонов, регулирующих его обмен — инсулин, глюкагон и глюкокортикоиды. В зависимости от особенностей физиологической ситуации гормоны осуществляют регуляцию метаболизма цинка в клетках печени, в ряде случаев приводящую к развитию последующей его недостатков плазме крови [9, C.15].
Так же количество цинка в теле влияет на уровень тестостерона в организме, главного мужского гормона.
Токсичность
Цинк, как и ртуть, свинец, мышьяк, кадмий и селен, относится к первому(наивысшему разряду токсичности)[10, C.294].
Исследования показали, что при однократном подкожном введении наночастиц цинка проявляется специфичность их действия на организм. В интервале доз 0,05–100 мг/кг наночастицы цинка оказывают биотическое действие, т.е. стимулируют обменные процессы. В интервале доз от 100 до 450 мг/кг лежит зона «безопасности», т.е. биотические свойства наночастиц уже не проявляются, а токсическое действие еще не наступает. С дозы 450 мг/ кг начинается зона фармакотоксического действия. Сравнение токсичности наночастиц цинка и цинка сульфата свидетельствует о низкой токсичности наночастиц цинка по сравнению с его сульфатом. Так, по значению ЛД50[3] наночастицы цинка в 28 раз менее токсичны, чем сульфат цинка. При отравлении сульфатом цинка появляются такие симптомы, как малокровие, задержка роста и бесплодие.
Применение цинка
Цинк выступает в роли отрицательного электрода в гальваническом элементе и в химических источниках энергии, это могут быть батарейки или аккумуляторы, например это может быть марганцево-цинковый элемент, являющимся одним из первых химических источников энергии. Так же его применяют при оцинковывании стали с целью ее защиты от коррозии. Одним из способов цинкования изделий является использование гальванического элемента с цинкосодержащим электролитом.
Так же объект нашего исследования необходим в ювелирном деле, его добавляют в сплавы на основе золота, что делает материал более ковким и он проще поддается обработке, но везде есть порог: при концентрации цинка около 30%, изделие становится хрупким.
Оксид цинка могут применять как один из компонентов для веществ антисептического действия, который содержится в заживляющих мазях. Сульфат гептагидрата цинка в количестве 2мг содержится в витаминно-минеральном комплексе «комплевит». Богаты цинком морепродукты, тыквенные семечки, говядина и некоторые другие продукты.
Интересный факт: сульфид цинка возгорается под действием радиации, это свойство помогает обнаружить вредное излучение.
ЗАКЛЮЧЕНИЕ
Из всего выше сказанного, можно сказать, что цинк -это универсальный металл, который незаменим как в различных процессах организма, так и при производстве различных изделий и продукций.
Пусть даже цинк и изучается в школьной программе, о нем мало что сказано, мы подтянули свои знания относительно этого металла и узнали что-то новое и задачи, поставленные в начале работы, были выполнены.
Химия - одна из самых интереснейших наук, изучение которой точно никак не испортит вашу жизнь, а сделает ее интереснее и веселее.
Дата добавления: 2018-06-27; просмотров: 2243; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
