Основные элементы содержания, проверяемые заданиями с развернутым ответом
При отборе содержания для заданий с развернутым ответом учитывается в первую очередь, какие элементы содержания и умения являются наиболее важными и отвечающими требованиям образовательного стандарта профильного уровня к подготовке выпускников средней (полной) школы. К таким элементам содержания, в частности, были отнесены: реакции окислительно-восстановительные, реакции ионного обмена, состав и строение веществ, взаимное влияние атомов в молекулах, механизмы протекания реакций, генетическая связь между классами неорганических и органических соединений, вычисления по химическим формулам и уравнениям реакций.
При выполнении заданий экзаменуемый должен продемонстрировать понимание сущности единства мира веществ, механизмов протекания реакций, владение умением составлять уравнения реакций и объяснять механизмы их протекания, применять знания о свойствах веществ различных классов, особенностях строения веществ и др. Большая роль отведена расчетным задачам по химии. Это объясняется тем, что при их решении необходимо опираться на знания химических свойств соединений, использовать умение составлять уравнения химических реакций, т.е. использовать во взаимосвязи теоретическую базу и определенные операционно-логические и вычислительные навыки.
В экзаменационной работе используются задания, связанные с выполнением всех видов химических расчетов, которые представлены в учебных программах не только для средней (полной), но и для основной школы (см. приложение 1).
|
|
|
Подход к отбору содержания заданий с развернутым ответом, положительно зарекомендовавший себя в процессе проведения ЕГЭ, сохранен применительно
к экзаменационной модели 2018 г.
Методика оценивания заданий с развернутым ответом (основные подходы к определению критериев и шкалы оценивания выполнения заданий)
Основу методики оценивания заданий с развернутым ответом составляет ряд общих положений. Наиболее важными в их числе являются следующие:
• Проверка и оценивание заданий с развернутым ответом осуществляется только путём независимой экспертизы на основе метода поэлементного анализа ответов экзаменуемых.
• Применение метода поэлементного анализа делает необходимым обеспечение четкого соответствия формулировки условия задания проверяемым элементам содержания. Перечень элементов содержания, проверяемых любым заданием, согласуется с требованиями стандарта к уровню подготовки выпускников средней школы.
• Критерием оценивания выполнения задания методом поэлементного анализа является установление наличия в ответах экзаменуемых элементов ответа, обозначенных в критериях оценивания задания. Должна быть принята и оценена любая модель ответа, предложенная экзаменуемым, если она не искажает сути химической составляющей условия задания.
|
|
|
Шкала оценивания выполнения задания устанавливается в зависимости от числа элементов ответа, указанных в критериях оценивания ответа, и с учетом таких факторов, как:
• уровень сложности проверяемого содержания;
• определенная последовательность действий, которые следует осуществить при выполнении задания;
• однозначность трактовки условия задания и возможных вариантов формулировок ответа;
• соответствие условия задания предлагаемым критериям оценивания по отдельным элементам содержания.
При разработке критериев оценивания учитываются особенности элементов содержания всех пяти заданий с развернутым ответом, включаемых в экзаменационную работу. Принимается во внимание и тот факт, что записи ответов экзаменуемых могут быть как очень общими, обтекаемыми и не конкретными, так и излишне краткими
и недостаточно аргументированными. Пристальное внимание уделяется выделению элементов ответа, оцениваемым в один балл. При этом учитывается неизбежность постепенного повышения трудности получения каждого последующего балла
за правильно сформулированный элемент ответа.
|
|
|
При составлении шкалы оценивания расчетных задач (34 и 35) учитывается возможность различных путей их решения, а, следовательно, присутствие в ответе экзаменуемого основных этапов и результатов выполнения заданий, указанных
в критериях оценивания. Проиллюстрируем методику оценивания заданий с развернутым ответом на конкретных примерах.
Задание 30
Для выполнения заданий 30 и 31 экзаменуемым предлагается общий список из пяти веществ, причём при выполнении заданий учащиеся могут применить и растворы этих веществ.
Задания 30 ориентированы на проверку умений составлять уравнения окислительно-восстановительных реакций. При выполнении задания экзаменуемому необходимо осуществить ряд последовательных действий: проанализировать состав веществ из списка, выбрать вещества, которые будут проявлять свойства окислителя и восстановителя в реакции, определить продукты реакции (по характеру изменения степеней окисления элементов); составить электронный баланс реакции и на его основе расставить коэффициенты в уравнении реакции. С учётом такой последовательности действий были определены следующие элементы ответа:
|
|
|
· выбраны вещества, которые являются окислителем и восстановителем, и записано молекулярное уравнение окислительно-восстановительной реакции;
· составлен электронный баланс реакции, указаны окислитель и восстановитель.
Пример задания:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
| 30 |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | ||
Вариант ответа:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Сульфит натрия (или сера в степени окисления +4) является восстановителем. Перманганат калия (или марганец в степени окисления +7) – окислителем. | |||
| Ответ правильный и полный, содержит следующие элементы: · выбраны вещества, и записано уравнение окислительно-восстановительной реакции; · составлен электронный баланс, указаны окислитель и восстановитель | 2 | ||
| Правильно записан один элемент ответа | 1 | ||
| Все элементы ответа записаны неверно | 0 | ||
| Максимальный балл | 2 |
При оценивании ответа экзаменуемого необходимо учитывать, что из списка веществ могут выбраны не только те вещества, которые представлены в «варианте ответа». А также и то, что единых требований к оформлению ответа на это задание не предъявляется. Вследствие этого в качестве верного ответа принимается составление как электронного, так и электронно-ионного баланса реакции, а также указание окислителя и восстановителя может быть сделано любыми однозначно понятными способами. Однако, если в ответе содержатся взаимоисключающие по смыслу суждения, то такие элементы ответа не могут считаться верными.
Задание 31
Задания 31 ориентированы на проверку умений составлять уравнения реакций ионного обмена. Реакции ионного обмена протекают между электролитами в направлении связывания ионов. Чтобы выполнить это задание экзаменуемым необходимо выбрать из предложенного списка вещества, между которыми протекает реакция ионного обмена, а также показать понимание механизма реакции составив полное и сокращённое ионное уравнения.
Пример задания:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
| 31 |
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа: KHCO3 + KOH = K2CO3 + H2O 2K+ + HCO3- + OH- = 2K+ + CO32- + H2O HCO3- + OH- = CO32- + H2O | |
| Ответ правильный и полный, содержит следующие элементы: · выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; · записаны полное и сокращенное ионное уравнения реакций | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
Как и при проверке выполнения задания 30 необходимо учитывать тот факт, что экзаменуемые могут выбрать из списка и другие вещества, между которыми возможна реакция ионного обмена. При оценивании записи ионных уравнений реакций необходимо учитывать правильность указания зарядов ионов и сокращение коэффициентов, если это необходимо.
Задание 32
В условии задания 32 проверяющего знание генетической взаимосвязи различных классов неорганических веществ, предложено описание конкретного химического эксперимента, ход которого экзаменуемые должны будут проиллюстрировать посредством уравнений соответствующих химических реакций. Шкала оценивания задания равна 4 баллам: каждое верно записанное уравнение реакции оценивается в 1 балл.
Пример задания:
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели
с концентрированным раствором гидроксида калия.
Напишите уравнения четырёх описанных реакций.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа: Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям: 1) 2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз) 2) Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O 3) SO2 + 2H2S = 3S + 2H2O 4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O (возможно образование K2S2O3) | |
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все уравнения реакций записаны неверно | 0 |
| Максимальный балл | 4 |
Уравнение реакции считается записанным верно, если правильно записаны все формулы веществ – участников реакции, присутствуют все коэффициенты, продукты реакции соответствуют условиям проведения реакции.
Задание 33
Задания 33 проверяют усвоение знаний о взаимосвязи органических веществ и предусматривают наличие пяти элементов ответа - пяти уравнений реакций, соответствующих схеме («цепочке») превращений органических веществ. В приведённой схеме указываются также и условия осуществления этих превращений, что оказывает влияние на состав образующихся продуктов. При записи уравнений реакций, экзаменуемые должны использовать структурные формулы органических веществ разного вида (развёрнутой, сокращённой, скелетной), которые однозначно отражают порядок связи атомов и взаимное расположение заместителей и функциональных групп
в молекуле органического вещества.
Наличие каждого проверяемого элемента ответа оценивается в 1 балл. Максимальное количество баллов за выполнение таких заданий – 5.
Пример задания:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:


При написании уравнений реакций используйте структурные формулы органических веществ.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа
Написаны пять уравнений реакций, соответствующих схеме превращений:

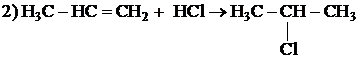



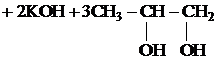
| |
| Правильно записаны пять уравнений реакций | 5 |
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 5 |
Отметим, что к уравнениям реакций предъявляются все те же требования, что и при выполнении задания 32. В случае, если в ответе экзаменуемого есть несоответствие условий проведения реакции и состава образующихся продуктов, то такой элемент ответа считается невыполненным (наличие взаимоисключающих суждений).
Задание 34
Задания 33 – это расчетные задачи. Их выполнение требует знания химических свойств веществ и предполагает осуществление некоторой совокупности действий, обеспечивающих получение правильного ответа. В числе таких действий назовем следующие:
– составление уравнений химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
– выполнение расчетов, необходимых для нахождения ответов на поставленные
в условии задачи вопросы;
– формулирование логически обоснованного ответа на все поставленные в условии задания вопросы (например, определить физическую величину – массу, объём, массовую долю вещества).
Однако следует иметь в виду, что не все названные действия обязательно должны присутствовать при решении любой расчетной задачи, а в отдельных случаях некоторые из них могут использоваться неоднократно.
Максимальная оценка за выполнение задания составляет 4 балла. При проверке следует в первую очередь обращать внимание на логическую обоснованность выполненных действий, поскольку некоторые задачи могут быть решены несколькими способами. Вместе с тем в целях объективной оценки предложенного способа решения задачи необходимо проверять правильность промежуточных результатов, которые использовались для получения ответа.
Пример задания:
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа: Записаны уравнения реакций: CaCO3 = CaO + CO2 CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O CaO + 2HCl = CaCl2 + H2O Рассчитано количество вещества соединений в твёрдом остатке: n(CO2) = V / Vm = 4,48 / 22,4 = 0,2 моль n(CaO) = n(CO2) = 0,2 моль m(CaO) = n ∙ M = 0,2 ∙ 56 = 11,2 г m(CaCO3 остаток) = 41,2 – 11,2 = 30 г n(CaCO3 остаток) = m / M = 30 / 100 = 0,3 моль Вычислена масса соли в полученном растворе: n(CaCl2) = n(CaO) + n(CaCO3) = 0,5 моль m(CaCl2) = n ∙ M = 0,5 ∙ 111 = 55,5 г n(CO2) = n(CaCO3 остаток) = 0,3 моль m(CO2) = n ∙ M = 0,3 ∙ 44 = 13,2 г Вычислена массовая доля хлорида кальция в растворе: m (р-ра) = 41,2 + 465,5 – 13,2= 493,5 г ω(CaCl2) = m(CaCl2) / m (р-ра) = 55,5 / 493,5 = 0,112, или 11,2% | |
| Ответ правильный и полный, содержит следующие элементы: · правильно записаны уравнения реакций, соответствующих условию задания; · правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; · продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты; · в соответствии с условием задания определена искомая физическая величина | 4 |
| Правильно записаны три элемента ответа | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
При проверке ответа экзаменуемого необходимо учитывать тот факт, что в случае, когда в ответе содержится ошибка в вычислениях, которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
Задание 35
Задания 35 предусматривают определение молекулярной и структурной формулы органического вещества. Выполнение этого задания включает следующие последовательные действия: определение молекулярной формулы вещества на основании вычислений с использованием физических величин, заданных в условии задачи; установление структуры вещества по указанным свойствам или способам получения этого вещества; составление уравнения реакции, указанного в условии задания. С учетом этих действий шкала оценивания выполнения задания составляет максимально 3 балла.
Пример задания:
Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа:
Проведены вычисления и найдена молекулярная формула вещества А. Общая формула вещества А – CxHyOzNm.
w(C) = 100 – 9,40 – 27,35 – 11,97 = 51,28%
x : y : z : m = 51,28 / 12 : 9,4 / 1 : 27,35 / 16 : 11,97 / 14 = 5 : 11 : 2 : 1.
Молекулярная формула вещества А – C5H11O2N
Составлена структурная формула вещества А:
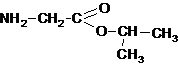 Написано уравнение реакции получения вещества А:
Написано уравнение реакции получения вещества А:

| |
| Ответ правильный и полный, содержит следующие элементы: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Обратим внимание на то что, что в ответах не всегда присутствует, как отдельный элемент ответа, запись структурной формулы вещества. Но в уравнении реакции, о которой говорится в условии задания, структурная формула присутствует. В этом случае рекомендуется выставлять балл за определение структурной формулы вещества.
Предлагаемая система оценивания заданий с развернутыми ответами прошла соответствующую проверку в практике проведения ЕГЭ по химии в предыдущие годы, обсуждение в процессе подготовки экспертов и была ими в целом одобрена.
Предметом обсуждения с экспертами являлись следующие вопросы:
• полнота описаний наиболее важных характеристик заданий;
• способы оценки качества учебных достижений;
• примеры критериев оценки заданий различных типов;
• требования к степени полноты ответов учащихся;
• различные подходы к трактовке научных фактов и понятий, отраженных в заданиях;
• допустимые границы лояльности при выставлении баллов за отдельные элементы содержания;
• подходы к оцениванию предложенных учащимися нестандартных способов решения расчетных задач;
• характеристика ситуаций, требующих назначения третьего эксперта.
Приложение 1
Обобщённый план варианта КИМ ЕГЭ 2018 года
по ХИМИИ
Уровни сложности заданий: Б – базовый; П – повышенный; В – высокий.
| Порядковый номер задания в работе | Проверяемые элементы содержания | Коды прове-ряемых элементов содержа-ния по кодифи-катору | Коды требо-ваний | Уро-вень слож-ности зада- ния | Макс. балл за вы-полнение зада-ния | При-мерное время выпол-нения задания (мин.) |
| Часть 1 | ||||||
| 1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома.Основное и возбуждённое состо-яние атомов. | 1.1.1 | 1.2.1 2.3.1 | Б | 1 | 2–3 |
| 2 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | 1.2.1 1.2.2 1.2.3 1.2.4 | 1.2.3 2.4.1 2.3.1 | Б | 1 | 2–3 |
| 3 | Электроотрицательность. Степень окисления и валентность химических элементов | 1.3.2 | 1.1.1 2.2.1 | Б | 1 | 2–3 |
| 4 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения | 1.3.1 1.3.3 | 2.2.2 2.4.2 2.4.3 | Б | 1 | 2–3 |
| 5 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиаль-ная и международная) | 2.1 | 1.3.1 2.2.6 | Б | 1 | 2–3 |
| 6 | Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных | 2.2 2.3 2.4 | 2.3.2 2.3.3 | Б | 1 | 2–3 |
| 7 | Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена | 2.5 2.6 2.7 1.4.5 1.4.6 | 2.3.3 1.1.1 1.1.2 1.2.1 2.4.4 | Б | 2 | 2–3 |
| 8 | Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.2 2.3 2.4 2.5 2.6 2.7 | 2.3.3 | П | 2 | 5–7 |
| 9 | Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.2 2.3 2.4 2.5 2.6 2.7 | 2.3.3 2.4.3 2.4.4 | П | 2 | 5–7 |
| 10 | Взаимосвязь неорганических веществ | 2.8 | 2.3.3 2.4.3 | Б | 2 | 2–3 |
| 11 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) | 3.3 | 2.2.6 | Б | 1 | 2 |
| 12 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | 3.1 3.2 | 1.2.1 2.2.2 2.2.3 2.2.7 | Б | 1 | 2 |
| 13 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории) | 3.4 4.1.7 | 2.3.4 1.3.4 2.5.1 | Б | 1 | 2 |
| 14 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории). | 3.5 3.6 4.1.8 | 2.3.4 1.3.4 2.5.1 | Б | 1 | 2 |
| 15 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки | 3.7 3.8 | 2.3.4 | Б | 1 | 2 |
| 16 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | 3.4 1.4.10 4.1.7. | 2.3.4 2.4.4 | П | 2 | 5–7 |
| 17 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений | 3.5 3.6 4.1.8 | 2.3.4 | П | 2 | 5–7 |
| 18 | Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений | 3.9 | 2.3.4 2.4.3 | Б | 2 | 2–3 |
| 19 | Классификация химических реакций в неорганической и органической химии | 1.4.1 | 2.2.8 | Б | 1 | 2 |
| 20 | Скорость реакции, её зависимость от различных факторов | 1.4.3 | 2.4.5 | Б | 1 | 2 |
| 21 | Реакции окислительно-восстановительные. | 1.4.8 | 2.2.1 2.2.5 | Б | 1 | 5–7 |
| 22 | Электролиз расплавов и растворов (солей, щелочей, кислот) | 1.4.9 | 1.1.3 2.2.5 | П | 2 | 5–7 |
| 23 | Гидролиз солей.Среда водных растворов: кислая, нейтральная, щелочная | 1.4.7 | 2.2.4 | П | 2 | 5–7 |
| 24 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов | 1.4.4 | 2.4.5 | П | 2 | 5–7 |
| 25 | Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений | 4.1.4 4.1.5 | 2.5.1 | П | 2 | 5–7 |
| 26 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений.Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | 4.1.1 4.1.2 4.2.1 4.2.2 4.2.3 4.2.4 | 1.3.2 1.3.3 1.3.4 2.2.4 | Б | 1 | 5–7 |
| 27 | Расчёты с использованием понятия «массовая доля вещества в растворе» | 4.3.1 | 2.5.2 | Б | 1 | 2 |
| 28 | Расчёты объёмных отношений газов при химических реакциях. Расчёты по термохимическим уравнениям | 4.3.2 4.3.4 | 2.5.2 | Б | 1 | 2 |
| 29 | Расчёты массы вещества или объ-ема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ | 4.3.3 | 2.5.2 | Б | 1 | 2 |
| Часть 2 | ||||||
| 30 | Реакции окислительно-восстанови-тельные | 1.4.8 | 2.2.5 2.4.4 | В | 2 | 10–15 |
| 31 | Реакции ионного обмена. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | 1.4.5 1.4.6 | 2.2.4 2.4.4 | В | 2 | 10–15 |
| 32 | Реакции, подтверждающие взаимосвязь различных классов неорганических веществ | 2.8 | 2.3.3 2.4.3 2.4.4 | В | 4 | 10–15 |
| 33 | Реакции, подтверждающие взаимосвязь органических соединений | 3.9 | 2.3.4 2.4.3 | В | 5 | 10–15 |
| 34 | Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты с использованием понятия «массовая доля вещества в растворе». Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси | 4.3.5 4.3.6 4.3.8 4.3.9 | 2.5.2 | В | 4 | 10–15 |
| 35 | Установление молекулярной и структурной формулы вещества | 4.3.7 | 2.5.2 | В | 3 | 10–15 |
| Всего заданий – 35; из них по уровню сложности: Б – 21 П – 8; В – 6. Максимальный первичный балл за работу – 60. Общее время выполнения работы – 210 мин. | ||||||
Извлечения из Методических рекомендаций Рособрнадзора по формированию
и организации работы предметных комиссий субъекта Российской Федерации при проведении государственной итоговой аттестации по образовательным программам среднего общего образования
Во время работы экспертам запрещается:
· самостоятельно изменять рабочие места;
· копировать и выносить из помещений, где осуществляется проверка, экзаменационные работы, критерии оценивания, протоколы проверки экзаменационных работ, а также разглашать посторонним лицам информацию, содержащуюся в указанных материалах;
· иметь при себе и (или) пользоваться средствами связи, фото
и видеоаппаратурой, портативными персональными компьютерами (ноутбуками, КПК
и другими), кроме специально оборудованного в помещениях ПК рабочего места
с выходом в информационно-телекоммуникационную сеть «Интернет» для обеспечения возможности уточнения экспертами изложенных в экзаменационных работах участников ГИА фактов (например, сверка с источниками, проверка приведенных участниками ГИА фамилий, названий, фактов и т.п.);
· без уважительной причины покидать аудиторию;
· переговариваться, если речь не идет о консультации у председателя ПК или у эксперта, назначенного по решению председателя ПК консультантом;
Если у эксперта возникают вопросы или проблемы, он должен обратиться к председателю ПК или лицу, назначенному председателем ПК консультантом.
Приложение 2.
Указания по оцениваю развернутых ответов участников ЕГЭ
для эксперта, проверяющего развёрнутые ответы на задания
с порядковыми номерами 30–35 по ХИМИИ
(документ, предоставляемый эксперту при проведении оценивания экзаменационных работ)
При проверке заданий с развёрнутым ответом эксперт руководствуется стандартизированными материалами, в которых представлены: критерии и шкалы оценивания выполнения заданий, а также варианты развёрнутых ответов на каждое из заданий части 2 экзаменационной работы.
Проверка и оценивание выполнения заданий с развернутым ответом осуществляется на основе поэлементного анализа ответов экзаменуемых. Метод поэлементного анализа предполагает установление наличия в ответах экзаменуемых каждого из элементов ответа, обозначенного в критериях оценивания.
Ответ экзаменуемого по своему содержанию и последовательности изложения и может отличаться от предложенного в критериях варианта ответа. При этом оценивание выполнения задания осуществляется также в соответствии с общими критериями оценивания.
Результаты оценивания переносятся в Протокол проверки развернутых ответов, при этом баллы по каждому заданию переносятся в колонку, название которой соответствует номеру задания (см. Рисунок 1):
- баллы за задание 30 выставляются в графу протокола 30;
- баллы за задание 31 выставляются в графу протокола 31;
- баллы за задание 32 выставляются в графу протокола 32;
- баллы за задание 33 выставляются в графу протокола 33;
- баллы за задание 34 выставляются в графу протокола 34;
- баллы за задание 35 выставляются в графу протокола 35.
Внимание!При выставлении баллов за выполнение задания в «Протокол проверки ответов на задания бланка № 2» следует иметь в виду, что если ответ отсутствует (нет никаких записей, свидетельствующих о том, что экзаменуемый приступал к выполнению задания) (или указан только номер самого задания), то в протокол проставляется «Х», а не «0».
Рисунок 1. Протокол проверки развернутых ответов. Образец

Ниже приведены рекомендации по оцениванию отдельных элементов ответа и решению возможных проблем при оценивании.
| № задания | Критерии оценивания, в которых обозначены элементы ответа | Рекомендации по оцениванию отдельных элементов ответа и решению возможных проблемных ситуаций |
| 30 | Ответ правильный и полный: • выбраны вещества, и записано уравнение окислительно-восстановительной реакции; • составлен электронный баланс, указан окислитель и восстановитель | Основные элементы ответа 1. Ставится 1 балл если выбраны вещества из списка, и составлено молекулярное уравнение окислительно-восстановительной реакции между ними: · из приведённого в условии списка веществ выбраны те вещества, между которыми протекает окислительно-восстановительная реакция; · правильно составлены формулы продуктов этой окислительно-восстановительной реакции; · расставлены все коэффициенты в уравнении (при этом допустимо использование кратных коэффициентов, в том числе и дробных). Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: − в качестве исходных веществ (окислителя и восстановителя) могут быть использованы только вещества из предложенного списка (вода используется в качестве среды протекания реакций); − реакции разложения сложных веществ не могут быть приняты в качестве верного ответа, так как по условию задания требуется выбрать «вещества, между которыми….») 2. Ставится 1 балл за составление электронного баланса при условии, если: · правильно указаны степени окисления элемента-окислителя и элемента-восстановителя, участвующих в процессах окисления и восстановления; · электронный баланс можно считать составленным верно в случае, если любым способом будет показано, что число отданных восстановителем электронов, равно числу электронов, принимаемых окислителем: это могут быть коэффициенты в уравнении реакции; могут быть указаны множители за вертикальной чертой; может присутствовать словесная запись о числе отданных и присоединённых электронов; может быть использован метод полуреакций (электронно-ионный баланс); · указан окислитель и восстановитель. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. − степень окисления 0 может не указываться экзаменуемым; − если степень окисления не указана, то считать её равной 0; − считать верными записи, подобные следующим «Cl-1», «Cl-» , «2Cr3+», «Cr+6», которые экзаменуемый использовал при указании степени окисления; − считать неверными записи, подобные следующим «N23–», «Cr26+» (или «N2–3» «Cr2+6»); − наличие в ответе экзаменуемого взаимоисключающих суждений или обозначений следует рассматривать как факт несформированности умения применять данные знания (например, знаки «+» и «–» в записи электронного баланса не соответствуют природе окислителя или восстановителя). Экзаменуемый может: − в качестве окислителя и восстановителя указать элементы в соответствующей строчке электронного баланса, или отдельно выписать формулы /названия веществ. − обозначить окислитель и восстановитель даже одной буквой («В» и «О»). При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использоватьсвой алгоритмвыполнения задания (отличный от предложенного «варианта ответа»). В случае если выбраны вещества из списка, между которыми невозможно протекание окислительно-восстановительной реакции, то за молекулярное уравнение ставится 0 баллов и электронный баланс не оценивается – 0 баллов. В случае если выбраны вещества, между которыми возможна окислительно-восстановительная реакция, но допущена(-ы) ошибка(-и) в определении состава продуктов реакции (к примеру, не учтён характер среды раствора), то за первый элемент ответа (уравнение реакции) ставится 0 баллов, а электронный баланс оценивается применительно к составленному экзаменуемым уравнению реакции. Если в ответе к данному заданию будут приведены уравнения нескольких реакций, то проверяется только первое из них. |
| 31 | Ответ правильный и полный, содержит следующие элементы: • выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; • записаны полное и сокращенное ионное уравнения реакций | Основные элементы ответа 1. Ставится 1 балл если выбраны вещества из списка, и составлено молекулярное уравнение реакции ионного обмена между ними: · из приведённого в условии списка веществ выбраны те вещества, которые могут участвовать в реакции ионного обмена; · расставлены все коэффициенты в молекулярном уравнении реакции. 2. Ставится 1 балл если записаны полное и сокращённое ионное уравнения: − правильно указаны заряды ионов в каждом из ионных уравнений реакций (например, «Na+», или «SO42-»); − в ионном уравнении реакции формулы слабых электролитов, практически нерастворимых веществ и газов записаны в молекулярном виде; − в сокращённом ионном уравнении коэффициенты должны быть минимальными целыми числами. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: − при составлении как молекулярного, так и ионного уравнения реакции экзаменуемый может не использовать обозначения осадка «↓» или газа «↑». При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использовать свой алгоритм выполнения задания (отличный от предложенного «варианта ответа»). Если в ответе к данному заданию будут приведены уравнения нескольких реакций, то проверяется только первое из них. |
| 32 | Ответ правильный и полный: содержит правильно записанные уравнения четырёх химических реакций, о которых шла речь в условии задания. | Ставится 1 балл за каждый из четырёх элементов ответа, если: · правильно записаны формулы всех веществ, участвующих в реакции; · указаны все коэффициенты (при этом допустимо использование дробных и удвоенных коэффициентов). · в уравнениях реакций записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами реакций, протекающих при заданных условиях. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. При составлении уравнения реакции экзаменуемый может: − не указывать условия ее проведения (прокаливание, катализатор), так как они указаны в условии задания. В случае если в ответе все же указаны условия проведения конкретной реакции, но они не соответствуют её протеканию с образованием записанных продуктов, то данный элемент ответа следует считать ошибочным по причине наличия взаимоисключающих суждений. − при составлении уравнения реакции экзаменуемый может не использовать обозначения осадка «↓» или газа «↑». |
| 33 | Ответ правильный и полный: содержит правильно записанные уравнения пяти химических реакций, которые соответствуют схеме превращений, приведённой в условии задания. | Ставится 1 балл за каждый из пяти элементов ответа, если: · правильно записаны формулы всех веществ, участвующих в реакции, при этом использованы структурные формулы разного вида (развёрнутая, сокращённая, скелетная), которые однозначно отражают порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества. · указаны все коэффициенты (при этом допустимо использование дробных и удвоенных коэффициентов). · в уравнениях реакций записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами реакций, протекающих при заданных условиях. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. При составлении уравнения химической реакции экзаменуемый может: − использовать молекулярные формулы простейших представителей гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O, C6H12O6 (в реакции брожения или полного окисления); − не использовать обозначения осадка «↓» или газа «↑»; − не указывать условия её проведения (прокаливание, катализатор), так как в условии задания это не предусмотрено. В случае если в ответе все же указаны условия проведения конкретной реакции, но они не соответствуют её протеканию с образованием записанных продуктов, то данный элемент ответа следует считать ошибочным по причине наличия взаимоисключающих суждений. |
| 34 | Ответ правильный и полный: • в ответе правильно записаны все уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых использованы необходимые физические величины, заданные в условии задания; • продемонстрирована и логически обоснована последовательность использования во взаимосвязи физических величин, на основании которых проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина. | 1.Ставится 1 балл за наличие в ответе правильно записанных уравнений всех реакций, соответствующих условию задания. · - правильно записаны формулы всех веществ, участвующих в реакции; · - указаны все коэффициенты (при этом допустимо использование дробных и удвоенных коэффициентов). Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: − если допущена ошибка хотя бы в одном из уравнений реакций, даже при условии, что она не влияет на ход дальнейших вычислений, то за этот элемент ответа выставляется 0 баллов. 2. Ставится 1 балл за наличие в ответе правильно произведённых вычислений, в которых используются необходимые физические величины, из числа указанных в условии задания. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. К примеру, в соответствии с условием задания должно быть определено вещество, взятое в избытке. Если в ответе экзаменуемого отсутствует указание на избыток этого вещества, но ход дальнейших вычислений правильный, то в этом случае элемент ответа считается верным. 3. Ставится 1 балл, если в ответе экзаменуемого продемонстрирована и логически обоснована последовательность использования во взаимосвязи физических величин, на основании которых проводятся расчёты. Иными словами, отражены все необходимые этапы расчётов с указанием пропорциональной зависимостимежду количеством (массой, объёмом) реагирующих веществ. Вычисление молярной массы веществ можно не приводить. 4.Ставится 1 балл, если в ответе экзаменуемого в соответствии с условием задания определена искомая физическая величина: − выбран верный способ для нахождения искомой физической величины; − правильно определены «промежуточные» физические величины, необходимые для её нахождения. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. В случае наличия в ответе экзаменуемого ошибок в вычислениях (не более трёх), которые привели к неверному ответу, оценка за выполнение задания снижается только на 1 балл. В случае если в ответе экзаменуемого не указаны единицы измерения искомых физических величин (более четырёх), то оценка за выполнение задания снижается на 1 балл. При оценивании выполнения задания принимается во внимание тот факт, что экзаменуемый может использоватьсвой алгоритмрешения задачи (отличный от предложенного «варианта ответа»). |
| 35 | Ответ правильный и полный: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурных формул органических веществ записано уравнение реакции, на которую даётся указание в условии задания. | Основные элементы ответа 1. Ставится 1 балл за определение молекулярной формулы вещества на основании приведённых необходимых правильных вычислений. Ответ должен содержать расчёты, подтверждающие соответствие приведённой молекулярной формулы условиям задачи. 2. Ставится 1 балл при наличии записи структурной формулы вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества в соответствии с условием задания. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. При условии, если структурная формула органического вещества не записана как отдельный элемент ответа, а присутствует лишь в уравнении реакции (в последнем элементе ответа) и составлена правильно, то этот элемент ответа считается выполненным и выставляется 1 балл за «структурную формулу». 3. Ставится 1 балл при наличии записи уравнения реакции, на которую даётся указание в условии задания: · правильно записаны формулы всех веществ, участвующих в реакции, при этом использованы структурные формулы разного вида (развёрнутая, сокращённая, скелетная), которые однозначно отражают порядок связи и взаимное расположение заместителей и функциональных групп в молекуле органического вещества. · указаны все коэффициенты (при этом допустимо использование дробных и удвоенных коэффициентов). · в уравнении реакции записаны формулы тех веществ, которые соответствуют условию задания, или являются продуктами реакций, протекающих при заданных условиях. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. Допустимо использование молекулярных формул для простейших представителей гомологических рядов: CH4, C2H2, C6H6, C2H5OH, CH2O и т.д., а также C6H12O6 (в реакции брожения или полного окисления). В случае если в условии задания идёт речь о веществах природного происхождения, то таковыми являются биологически важные вещества, такие как жиры, аминокислоты (независимо от положения аминогруппы), пептиды, белки, углеводы (моно-, ди-, олиго- и полисахариды). |
Дата добавления: 2018-06-01; просмотров: 723; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
