Естественное и искусственное старение дуралюмина.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ВОЗДУШНОГО ТРАНСПОРТА
ИРКУТСКИЙ ФИЛИАЛ
ФЕДЕРАЛЬНОГО ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО
ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ ВЫСШЕГО ОБРАЗОВАНИЯ
«МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ГРАЖДАНСКОЙ АВИАЦИИ» (МГТУ ГА)
ФАКУЛЬТЕТ эксплуатации летательных аппаратов
КАФЕДРА летательных аппаратов и двигателей
Направление подготовки 25.03.01 Техническая эксплуатация
летательных аппаратов и двигателей
КОНТРОЛЬНАЯ РАБОТА
По дисциплине
“Материаловедение и технология материалов”
Раздел: «Материаловедение»
Вариант 22
Выполнил: студент ________ К. В. Баганов
(подпись)
Шифр M-1603322
“__” “_____” 2018.г
Проверил : к.т.н., профессор кафедры ЛА и Д с оценкой
«__________»
__________ Н.А.Сажин
(подпись)
Иркутск 2018
Содержание
Сущность металлической, ионной, ковалентной связей атомов в твердых телах..........................................................................................................................3
Диаграмма состояния Fe-C. Построить кривую охлаждения для сплава с 0,8% C................................................................................................................................6
Естественное и искусственное старение дуралюмина.……………………......11
Цементация и азотирование сталей.…………………………………………………………..12
Ферриты. Особенности их структуры и область применения………………..14
Список литературы...............................................................................................
Сущность металлической, ионной, ковалентной связей атомов в твердых телах.
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в пространстве между катионами и удерживают их вместе. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии. Она называется металлической.

Схема связей в металлах.
Металлическая связь – химическая связь, обусловленная наличием большого количества не связанных с ядрами подвижных электронов.
| Ковалентная связь | Металлическая связь | Ионная связь | |
| Образование связи за счет общих электронов | Образование связей одновременно между большим числом частиц | ||
| Пара электронов, образующая связь, принадлежит двум связываемым атомам | Электроны, образующие связь, в равной мере принадлежат всем атомам | Взаимное притяжение между катионами металлов и электронным газом | Взаимное притяжение между катионами и анионами |
| Взаимное смещение атомов (при ударе) приводит к разрыву связи | Взаимное смещение катионов (при ударе) не приводит к разрыву связи | Взаимное смещение катионов и анионов (при ударе) приводит к разрыву связи | |
Единая система электронов в металлических веществах называется электронным газом. Металл можно представить в виде остова из положительных ионов, погруженного в электронный газ, который компенсирует силы взаимного отталкивания положительных ионов. В свою очередь, электронный газ может свободно двигаться через решетку, состоящую из ионов металла. В кристаллах металлов атомы ионизированы не полностью, и часть валентных электронов остается связанной. В результате возможно появление частично ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи. Важнейшим признаком металлов считают высокую электропроводность, которая уменьшается с ростом температуры. Электроны в металле беспорядочно движутся, переходя от одного атома к другому. А положительно заряженные ионы лишь слегка колеблются около своего положения в кристаллической решетке. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Наличие свободных электронов обусловливают высокую теплопроводность металлов и характерный металлический блеск. Их высокая пластичность и ковкость связаны с возможностью взаимного смещения катионов в металлической кристаллической решетке без разрыва химической связи.
Физические свойства металлов, такие как высокую тепло- и электропроводность, пластичность и ковкость, характерный металлический блеск, можно объяснить исходя из представлений об электронном газе. Однако, количественные расчеты с использованием такой модели строения металлических кристаллов не всегда приводят к результатам, совпадающим с экспериментальными данными. Поэтому для более строгого описания состояния электронов в металле используют квантово-химические методы.
Химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллической решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетических уровней, называемых зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллической решетке аналогично делокализованным p-орбиталям сопряженных соединений.
При сближении двух атомов, например Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетического уровня валентного электрона на два. Когда N атомов Li образуют кристаллическую решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетический уровень валентного электрона расщепляется на N уровней, расстояния между которыми из-за большой величины N настолько малы, что их совокупность может считаться практически непрерывной зоной энергетических уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, например, в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле.
Металлическая связь характерна не только для металлов и их сплавов, но и для металлических соединений, она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
Диаграмма состояния Fe-C. Построить кривую охлаждения для сплава с 0,8% C.
В диаграмме состояния даны две линии равновесия системы. Сплошной линией показана диаграмма состояния для практического равновесия системы железо-цементит, или метастабильная диаграмма.
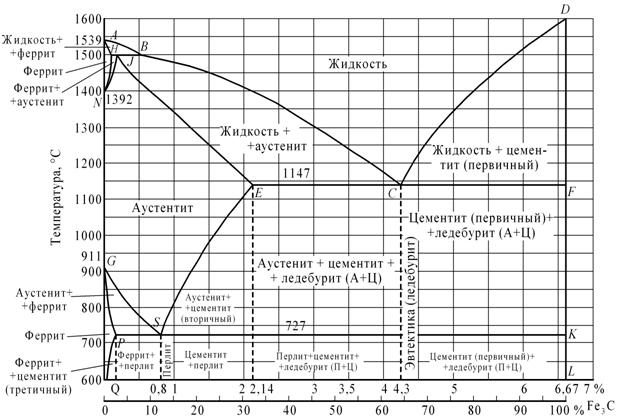
Диаграмма состояния железо-цементит
Ввиду того, что возможен процесс рапада  и система
и система  не является теоретически полностью равновесной, ее и называют метастабильной. Пунктирной линией нанесена диаграмма состояния для равновесия системы железо-графит, или стабильная диаграмма.
не является теоретически полностью равновесной, ее и называют метастабильной. Пунктирной линией нанесена диаграмма состояния для равновесия системы железо-графит, или стабильная диаграмма.
Считается, что углерод может выделяться в виде цементита и графита в зависимости от скорости охлаждения и химического состава.
По оси абсцисс диаграммы отложено содержание от 0 до 6,67% C, по оси ординат – температура от 0 до 1600 градусов.
Диаграмма состояния системы железо-цементит имеет большое практическое значение: ею пользуются для назначения режимов термической обработки сталей и чугуна, и определения температурных пределов обработки давлением.
Линию ACD диаграммы называют линией ликвидуса; выше этой линии сплавы находятся в жидком состоянии. Когда температура сплава соответствует линии АС, начинается процесс кристаллизации из жидкого сплава аустенита, а на линии CD – цементита.
Так как цементит выделяется непосредственно из жидкого сплава в процессе первичной кристаллизации, то его называют первичным цементитом.
При понижении температуры сплава ниже линии ACD кристаллизация его продолжается с постепенным увеличением количества твердых кристаллов за счет уменьшения жидкого сплава.
Линию AECF называют линией солидуса, так как она соответствует моменту полного затвердевания сплава. В точке С при 4,3% углерода и 1147 градусах сплав переходит в твердое кристаллическое состояние; эта точка называется эвтектической точкой, а сплав этого состава – этектическим.
Структура эвтектического сплава при метастабильном затвердевании – ледебурит.
Аустенит, входящий в эвтектику, имеет наибольшее содержание углерода, равное 2,0%.
Сплавы, содержащие более 2,0% углерода, называются чугунами, а содержащие менее 2,0% углерода – сталями.
Чугун, содержащий ровно 4,3% углерода, называют эвтектическим, менее 4,3% углерода – доэвтектическим, а содержащий более 4,3% углерода – заэвтектическим.
В зоне II диаграммы сплав состоит из кристаллов аустенита и жидкого сплава; обе фазы переменного состава в зависимости от температуры.
Содержание углерода в кристаллах аустенита определяется линией АЕ, а в жидкой части сплава – линией АС. В зоне III диаграммы сплав состоит из цементита и жидкого сплава.
Содержание углерода в жидком сплаве определяется линией CD.
При температурах, соответствующих линии GSE, начинается процесс вторичной кристаллизации (за счет аустенита), то есть процесс кристаллизации из твердого раствора.
В зоне IV стали имеют структуру аустенита. При этом ветвь GS называется линией  ; она показывает температуры начала выделения феррита из аустенита, а ветвь SE, называемая линией
; она показывает температуры начала выделения феррита из аустенита, а ветвь SE, называемая линией  , показывает выделение вторичного цементита из аустенита. В зоне VIII стали имеют две структурные составляющие – феррит и аустенит. В зоне V находятся в равновесии две структурные составляющие – цементит и аустенит. В этом случае цементит выделяется из аустенита вследствие уменьшения растворимости углерода в аустените при понижении температуры. Этот цементит называется вторичным. Содержание углерода в аустените определяется линией SE.
, показывает выделение вторичного цементита из аустенита. В зоне VIII стали имеют две структурные составляющие – феррит и аустенит. В зоне V находятся в равновесии две структурные составляющие – цементит и аустенит. В этом случае цементит выделяется из аустенита вследствие уменьшения растворимости углерода в аустените при понижении температуры. Этот цементит называется вторичным. Содержание углерода в аустените определяется линией SE.
При температурах, соответствующих линии PSK, завершаются процессы вторичной кристаллизации. Эта линия является эвтектоидной линией или линией 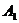 .
.
При этих температурах твердый раствор с содержанием 0,80% С распадается на механическую смесь феррита и цементита, называемую перлитом. Точка S называется эвтектоидной. Сталь, содержащая 0,80% С, называется эвтектоидной, менее 0,80% С – доэвтектоидной, более 0,80% С – заэвтектоидной.
В структуре доэвтектоидных сталей, кроме перлита, присутствует избыточный феррит.
Чем меньше в стали содержится углерода, тем больше будет содержаться в структуре феррита.
Доэвтектоидные стали на практике делят на три класса: мягкие стали (содержащие до 0,4% С), средней твердости (0,4-0,6% С) и твердые стали (более 0,6% С). В доэвтектоидных сталях с увеличением содержания углерода увеличиваются твердость и прочность, а пластические свойства ухудшаются. Заэвтектоидные стали применяют главным образом как стали инструментальные, доэвтектоидные стали применяют как поделочные.
Рассмотрим структурные превращения в чугуне при его охлаждении (нагревании) ниже линии твердого состояния. В зоне VI диаграммы (доэвтектические чугуны) в равновесии находятся три структурные составляющие.
Кроме аустенита и ледебурита (продуктов первичной кристаллизации), в структуре имеется еще и вторичный цементит. По мере понижения температуры в этой зоне содержание углерода в аустените понижается за счет образования вторичного цементита. По мере охлаждения содержание углерода в структурно свободном аустените и в аустените, входящем в ледебурит, определяется линией SE.
При температуре, соответствующей линии PSK, чугун, содержащий от 2,0 до 4,3% С, будет состоять из трех структурных составляющих – цементита, ледебурита и перлита (при содержании 0,80% С).
В зоне VII диаграммы в равновесии находятся ледебурит и цементит (первичный).
При температуре, соответствующей линии PSK, аустенит распадается, образуя перлит. Таким образом, в зоне XI будут в равновесии структуры перлита, ледебурита и вторичного цементита.
В зоне XII будут находиться в равновесии кристаллы ледебурита и цементита.
Чугун, в зависимости от химического состава, и скорости охлаждения может кристаллизоваться как по метастабильной, так и по стабильной системе.
В результате кристаллизации чугун может иметь структуру белого чугуна (перлит + цементит + ледебурит), половинчатого чугуна (перлит + ледебурит + цементит + графит), а так же структуру серого чугуна, перлитного (перлит + графит), ферритно-перлитного (перлит + феррит + графит), ферритного (феррит + графит).

Кривая охлаждения с содержанием углерода 0,8%
Сплав с содержанием 0,8% С называется эвтектоидной сталью.
Кристаллизация с конечным образованием аустенита происходит в интервале температур точек 1-2. В ней при температуре линии PSK происходит эвтектоидное превращение, в результате которого из аустенита выделяются феррит с содержанием 0,02% С и цементит. Такую смесь двух фаз называют перлитом. Эвтектоидное превращение идет при постоянных температуре и составе фаз, так как в процессе одновременно участвуют три фазы, и число степеней свободы равно нулю.
Применение правила фаз Гиббса:
Правило фаз С = К + Р + Ф
С – число степеней свободы;
Ф – число фаз;
К – число компонентов;
Р – число внешних факторов равновесия (для металлических систем Р = 1)
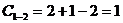 , следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 1-2.
, следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 1-2.
После этого начинается ускоренное падение температуры аустенита до точки 3.
 , следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 2-3.
, следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 2-3.
При этом температура останавливается и оставшийся аустенит переходит в перлит.
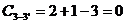 , следовательно процесс протекает при постоянной температуре, и на кривой охлаждения это выражено линией 3-3'.
, следовательно процесс протекает при постоянной температуре, и на кривой охлаждения это выражено линией 3-3'.
В дальнейшем температура перлитной структуры снова понижается, а структурных изменений не происходит и такую сталь называют эвтектоидной.
 , следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 3'-4.
, следовательно процесс протекает при изменяющейся температуре и на кривой охлаждения получаем наклонный участок 3'-4.
Естественное и искусственное старение дуралюмина.
Дюралюминии — сплавы алюминия с медью, которые содержат постоянные примеси кремния и железа и могут быть легированы магнием и марганцем. Количество меди в них находится в пределах 2,2-7 %. Медь растворяется в алюминии в количестве 0,5% при комнатной температуре и 5,7% при эвтектической температуре, равной 548 градусов.
Процесс изменения структуры закаленного сплава при комнатной температуре называется процессом естественного старения. Структура закаленного дюралюминия имеет малую стабильность и даже при комнатной температуре в ней самопроизвольно происходят изменения. Эти изменения сводятся к тому, что атомы избыточной меди группируются в растворе, располагаясь в порядке, близком к характерному для кристаллов химического соединения CuAl. Химическое соединение еще не образуется и тем более не отделяется от твердого раствора, но за счет неравномерности распределения атомов в кристаллической решетке твердого раствора в ней возникают искажения, которые приводят к значительному повышению твердости и прочности с одновременным снижением пластичности сплава. Естественное старение особенно интенсивно происходит в течение первых нескольких часов, полностью же завершается, придавая сплаву максимальную для него прочность, через 4-6 суток.
Если же сплав подогреть до 100-150 градусов по Цельсию, то произойдет искусственное старение. В этом случае процесс совершается быстро, но упрочнение происходит меньшее. Объясняется это тем, что при более высокой температуре диффузионные перемещения атомов меди осуществляются более легко, поэтому происходит завершенное образование фазы CuAl и выделение ее из твердого раствора. Упрочняющее же действие полученной фазы оказывается меньшим, чем действие искаженности решетки твердого раствора, возникающей при естественном старении.
Сравнение результатов старения дюралюминия при различной температуре показывает, что максимальное упрочнение обеспечивается при естественном старении в течении четырех дней.
Дата добавления: 2018-06-01; просмотров: 2748; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
