Иммунокомплексные реакции (Реакции III типа)
Аллергические реакции III типа опосредованы иммунными комплексами.
Иммунные комплексы образуются у всех индивидов при каждом иммунном ответе. Но лишь некоторые иммунные ответы и только у лиц, обладающих предрасположенностью к иммунокомплексным реакциям приводят к аллергическим заболеваниям III типа. Решающими являются особенности судьбы иммунных комплексов в организме.
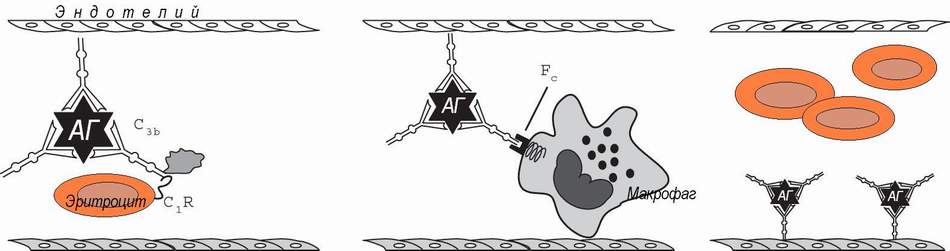
Иммунокомплексные реакции развиваются, если нарушен или относительно недостаточен нормальный клиренс иммунных комплексов и последние, вместо инактивации, фиксируются на сосудистой стенке или в тканях, активируя эффекторные механизмы воспаления, тромбоза и фибринообразования (А.Я..Кульберг; 1985, 1986). Формированию иммунокомплексных реакций благоприятствуют хронические инфекции с персистированием в организме чужеродных антигенов (например, малярия и легочные микозы) и хронические аутоиммунные заболевания (например, системная красная волчанка - СКВ).

 По современным представлениям, иммунокомплексным реакциям способствуют наследственные и приобретенные дефекты в системе клиренса иммунных комплексов.
По современным представлениям, иммунокомплексным реакциям способствуют наследственные и приобретенные дефекты в системе клиренса иммунных комплексов.
У приматов в этой системе ключевую роль играют эритроциты, комплемент и макрофаги.
В норме иммунные комплексы фиксируются эритроцитами, через С3в фрагмент комплемента и CR1 рецептор эритроцитов, что предохраняет их от контакта с сосудистой стенкой, так как основная часть красных кровяных клеток следует в осевом кровотоке.
|
|
|
В синусоидах селезенки и печени, при турбулентном кровотоке, нагруженные иммунными комплексами эритроциты захватываются макрофагами, при участии Fc-рецепторов. Некоторая часть свободных иммунных комплексов , отщепленных от носителей в результате действия фактора I комплемента, захватывается макрофагами непосредственно (Ф.Хэй, 1994).
По данным А.Я.Кульберга (1986), если иммуноглобулины принадлежат к классу IgA, они активируют комплемент альтернативным путём, что приводит к появлению в составе иммунных комплексов C3b - фрагментов комплемента. При классическом пути активации, если в состав комплекса входят IgG, они связывают C1q - фрагменты комплемента. C1q - фрагменты фиксируются нековалентно, а значит - обратимо, к Сg2-домену Fc-фрагмента IgG между аминокислотными остатками N 282 и N 292. После связывания антигена угловое расстояние в молекуле IgG между Fab-фрагментами возрастает. Fc-фрагмент выходит из плоскости, в которой расположены Fab-фрагменты. Это облегчает связывание C1q.
C1q по размеру в 2,5 раза больше IgG, поэтому его связывание приводит к экранированию части Fc-фрагмента, в связи с чем присоединение комплемент-активирующими антителами С1q мешает их захвату макрофагами (“интерференция эффекторных функций иммуноглобулинов” - по Кульбергу). В ходе дальнейшей активации комплемента,С3b-фрагмент, присоединяясь к комплексу ковалентно, в области Fd -участка Fab-фрагментов, вызывает стерические изменения комплекса, благоприятствующие отщеплению С1q и элиминации комплекса макрофагом. По Х.Такахаши (1980), присоединение С3b повышает растворимость иммунных комплексов, что может быть результатом отщепления C3b и С4b
|
|
|
В соответствии с этим, в норме в IgG-cодержащих комплексах присутствуют C3b и С4b и отстуствует С1q. Иммунные комплексы с IgM cодержат как C3b и С4b , так и С1q.
Из сказанного ясно, что приобретенные и наследственные дефекты и нехватка С3 и других фрагментов комплемента, Fc-рецептора макрофагов, СR1 - рецептора эритроцитов и самого Fc-фрагмента антител (включая его углеводный компонент) будут предрасполагать их носителей к иммунокомплексным болезням.
Это подтверждается наблюдениями о наличии повышенной частоты иммунокомплексных процессов у лиц с наследственным дефицитом С3 и с гипокомплементемией в результате эндотоксинового шока, ожоговой болезни и других процессов с избыточной активацией комплемента по альтернативному пути. Обнаружены генетические дефекты Fc-peцепторов и Fc-фрагментов у больных СКВ и их ближайших родственников (Т.Фрэнк и соавт. 1983). Описаны аутоантитела к конвертазе альтернативного пути комплемента - C3bBb-фрагменту, вызывающие дефицит C3b и мембранозно-пролиферативный иммунокомплексный гломерулонефрит II типа - “болезнь плотных отложений” (С.Р.Нусинов и соавт., 1985). Эти аутоантитела даже называют “нефритогенным фактором”.
|
|
|
 ...
...  ...
...  ...
...
При подобных условиях время циркуляции иммунных комплексов в крови сокращено, так как они активно оседают на эндотелии и в тканях.
Итак, неустранение иммунных комплексов может отражать превышение скорости их продукции над доступными индивиду темпами их клиренса. Это происходит:
· из-за нарушения экспрессии или функционального дефекта рецепторов комплемента и/или Fc-рецепторов на клетках крови, адсорбирующих или фагоцитирующих иммунные комплексы
· из-за нарушения механизмов активации C3b-фрагмента комплемента, его дефицита или инактивации. Этот механизм особенно актуален при процессах, сопровождаемых истощающей активацией альтернативного пути комплемента. Так, при ожоговой болезни эндотоксиновом шоке, аллергоидных реакциях - возможен дефицит из-за его потребления. Распространены и наследственные дефициты факторов комплемента, участвующих в опсонизации иммунных комплексов (см. выше раздел “Медиаторы воспаления”).
|
|
|
· из-за образования комплексов, содержащих антиизотипические аутоантитела (ревматоидных факторов), из-за формирования антиидиотипических аутоантител, а также аутоантител к факторам комплемента (иммуноконглюттининов) или в присутствии кокковых белков, связывающих aнтитела через Fc-фрагменты (стафилококковый протеин А, cтрептококковый протеин М). В последнем случае играет роль гомология этих белков и Fc-фрагментов и антиидиотипическое копирование (П.Кристенсен, А.Шрёдер, 1990)
В этой связи необходимо подчеркнуть важность правильной трактовки результатов определения концентрации циркулирующих иммунных комплексов (ЦИК) в крови. Вопреки распространённой упрощённой интерпретации, высокий уровень ЦИК совсем не означает высокого риска иммунокомплексного заболевания. Гораздо важнее, что при интенсивном развитии иммунокомплексной аллергии этот уровень снижается в динамике, так как комплексы откладываются на сосудистых стенках. Определение иммунных комплексов в сыворотке по их взаимодействию с несущими Fc-рецептор клетками Раджи - это не единственный метод лабораторной диагностики иммунокомплексных реакций. С этой целью применяют также иммуноморфологический анализ ( светомикроскопическую визуализацию комплексов и компонентов комплемента в тканях с помощью иммунофлюоресценции по Кумбсу, а также электронномикроскопическое обнаружение депозитов иммунных комплексов). Косвенную роль играет и определение сывороточного уровня и степени утилизации факторов комплемента, как мера его активации (Р.Паттерсон, 1972).
Немалое значение для определения потенциальной патогенности иммунного комплекса имеют и его размеры, и другие физико-химические свойства.
 Хотя, принципиально все классы антител способны к образованию иммунных комплексов, наиболее часто поражения содержат депозиты IgG, IgM и IgA. Так как последние не связывают комплемент классическим путём и не фиксируются к эритроцитам, они часто обусловливают значительные депозиты в легких, мозге и почках. Депозиты с участием иммуноглобулинов А ответственны за развитие ряда тяжёлых гломерулопатий. При болезни Бергера депозиты, содержащие IgA, откладываются в мезангии клубочков и вызывают пролиферацию его клеток и гломерулосклероз. Сходные процессы отмечаются при пурпуре Шёнляйн-Геноха. Отложения IgA находят в клубочках и при подостром злокачественном гломерулонефрите с полулуниями, и при очаговом гломерулонефрите. Во всех случаях это сопровождается клиническими проявлениями нефротического синдрома. Интересно, что в IgA-зависимые иммунокомплексные гломерулопатии могут обостряться на фоне острых респираторных вирусных инфекций, вероятно, за счёт гиперпродукции IgA. IgE могут активировать комплемент лишь в очень больших дозах и по альтернативному пути, однако, если в состав иммунных комплексов входят IgE, то облегчается их прочная фиксация на базофилах и мастоцитах, с последующей дегрануляцией этих клеток.
Хотя, принципиально все классы антител способны к образованию иммунных комплексов, наиболее часто поражения содержат депозиты IgG, IgM и IgA. Так как последние не связывают комплемент классическим путём и не фиксируются к эритроцитам, они часто обусловливают значительные депозиты в легких, мозге и почках. Депозиты с участием иммуноглобулинов А ответственны за развитие ряда тяжёлых гломерулопатий. При болезни Бергера депозиты, содержащие IgA, откладываются в мезангии клубочков и вызывают пролиферацию его клеток и гломерулосклероз. Сходные процессы отмечаются при пурпуре Шёнляйн-Геноха. Отложения IgA находят в клубочках и при подостром злокачественном гломерулонефрите с полулуниями, и при очаговом гломерулонефрите. Во всех случаях это сопровождается клиническими проявлениями нефротического синдрома. Интересно, что в IgA-зависимые иммунокомплексные гломерулопатии могут обостряться на фоне острых респираторных вирусных инфекций, вероятно, за счёт гиперпродукции IgA. IgE могут активировать комплемент лишь в очень больших дозах и по альтернативному пути, однако, если в состав иммунных комплексов входят IgE, то облегчается их прочная фиксация на базофилах и мастоцитах, с последующей дегрануляцией этих клеток.
В тоже время, в отличие от анафилактических реакций, для иммунокомплексных реакций необходима значительно более высокая концентрация антител, способность которых специфически связываться с тканями не имеет решающего значения.
В общем, комплексы крупного размера легче и быстрее устраняются из циркуляции эритроцит-макрофагальным механизмом, хотя до исследования этого вопроса иммунологи, с позиций “здравого смысла”, ожидали обратного.
Такие иммунные комплексы, образовавшиеся в зоне эквивалентности, или при избытке антител, не вызывают патологических симптомов, напротив, иммунные комплексы, образовавшиеся при незначительном (но не сильном) избытке антигена, имеют малые и средние размеры, растворимы и могут обладать выраженным цитотоксическим действием. Ф.Хэй (1994) считает, что к отложению иммунных комплексов ведут, прежде всего, иммунные ответы с продукцией аномальных низкоаффинных антител. Именно такие иммуноглобулины возникают при многих аутоиммунных болезнях. Есть свидетельства облегченного образования иммунных комплексов при избытке синтеза антиидиотипических аутоантител у лиц с недостаточной идиотипспецифической супрессией.
Патологические симптомы, вызываемые цитотоксическими иммунными комплексами, обусловлены повреждающим действием клеток и медиаторов воспаления. Активация комплемента в местах отложения иммунных комплексов приводит к повышению проницаемости кровеносных сосудов.
При иммунокомплексных реакциях активация комплемента иммунными комплексами ведет к продукции анафилотоксинов С5а и С3а, а привлеченные хемоаттрактивным действием иммунных комплексов макрофаги выделяют фактор некроза опухолей - ФНО, который настолько важен в механизмах реакций 3 типа, что антитела к нему значительно ослабляют их проявления. Считается , что он опосредует аттракцию нейтрофилов, а привлечение полиморфноядерных лейкоцитов еще более способствует развитию воспаления: не в состоянии фагоцитировать фиксированные в тканях комплексы, нейтрофилы дают экзоцитоз и выделяются протеолитические ферменты (катепсины, коллагеназа, эластаза), что вызывает дальнейшее разрушение собственных тканей.
Важную самостоятельную роль при иммунокомплексных реакциях играют тромбоциты, активируемые иммунными комплексами и запускающие такие неотъемлемые элементы гиперчувствительности 3-го типа, как тромбоз, фибринообразование и, через тромбоцитарные факторы роста, процессы клеточной пролиферации, фиброплазии и ангиогенеза, которые часто наблюдаются в исходе иммунокомплексных поражений, в частности, гломерулопатий.
Список заболеваний, в патогенезе которых участвует иммунокомплексный механизм аллергии очень обширен.
Растворимые иммунные комплексы могут возникать либо в кровотоке (антиген и антитела одновременно находятся в плазме крови) - в этом случае возникает обусловленный иммунными комплексами васкулит; либо в ткани, когда антиген введен туда, а антитела находятся в кровотоке. Происходит их встречная взаимная диффузия и соединение. В этом случае возникает реакция типа феномена Артюса. При отдельных болезнях наблюдаются оба варианта иммунокомплексной аллергии по отдельности, вместе и в комбинации с другими, например, цитотоксическими или ГЗТ-механизмами.

|

|
|

|

|
Аллергические васкулиты
При аллергическом васкулите образование иммунных комплексов происходит при небольшом избытке антигена, непосредственно в просвете сосуда. Местом их нахождения может стать любой кровеносный сосуд. Но фиксации иммунных комплексов способствует высокое кровяное давление и турбулентный кровоток, поэтому типичными зонами их отложения, при разной природе антител, служат одни и те же сосудистые области:
· клубочки почек
· ресничные тела глаз
· ворсинчатое сосудистое сплетение IV мозгового желудочка
· бифуркации и искривления артерий
· околосуставные и кожные сосудистые сети
· клапаны сердца
 Комплексы легче фиксируются в тканях, содержащих антигены, против которых направлена значительная часть входящих в них антител - например, при грибковых альвеолитах - в легких, при гепатите - в печени, при аутоиммунитете против антигенов гломерулярной базальной мембраны - в клубочках почек. Фиксация иммунных комплексов на клетках крови может обусловить их ускоренную элиминацию фагоцитами селезёнки и вызвать тромбоцитопению, лейкопению и даже гемолитическую анемию со спленомегалией.
Комплексы легче фиксируются в тканях, содержащих антигены, против которых направлена значительная часть входящих в них антител - например, при грибковых альвеолитах - в легких, при гепатите - в печени, при аутоиммунитете против антигенов гломерулярной базальной мембраны - в клубочках почек. Фиксация иммунных комплексов на клетках крови может обусловить их ускоренную элиминацию фагоцитами селезёнки и вызвать тромбоцитопению, лейкопению и даже гемолитическую анемию со спленомегалией.
 Иммунокомплексный механизм васкулита участвует в патогенезе всех диффузных и некоторых очаговых форм гломерулонефрита (кроме гломерулопатии с минимальными изменениями), хотя и комбинируется в этих случаях с другими иммунопатологическими реакциями.
Иммунокомплексный механизм васкулита участвует в патогенезе всех диффузных и некоторых очаговых форм гломерулонефрита (кроме гломерулопатии с минимальными изменениями), хотя и комбинируется в этих случаях с другими иммунопатологическими реакциями.
 Он вносит вклад в механизмы ревматоидного артрита, многих проявлений системной красной волчанки, узелкового периартериита, дерматомиозита, склеродермии, синдрома Шёгрена, смешанных заболеваний соединительной ткани с неорганоспецифическими аутоантителами, узелкового периартериита, аллергических кожных васкулитов, в том числе, болезни Шёнляйн-Геноха (в комбинации с цитотоксической реакцией), болезни Такаясу, криоглобулинемии. Иммунные комплексы - важные участники развития инфекций, протекающих с бактериемией и вирусемией, либо осложняемых персистирующим аутоиммунным ответом: септического эндокардита, проказы, сифилиса, острых и хронических протозоонозов и тропических лихорадок, острого шистоматоза, хронического гепатита, микоплазмоза и многих инфекционных вазопатий. Инфекционный и иммунокомплексный факторы являются решающими при остром диффузном пролиферативном постстрептококковом гломерулонефрите и ревматизме.
Он вносит вклад в механизмы ревматоидного артрита, многих проявлений системной красной волчанки, узелкового периартериита, дерматомиозита, склеродермии, синдрома Шёгрена, смешанных заболеваний соединительной ткани с неорганоспецифическими аутоантителами, узелкового периартериита, аллергических кожных васкулитов, в том числе, болезни Шёнляйн-Геноха (в комбинации с цитотоксической реакцией), болезни Такаясу, криоглобулинемии. Иммунные комплексы - важные участники развития инфекций, протекающих с бактериемией и вирусемией, либо осложняемых персистирующим аутоиммунным ответом: септического эндокардита, проказы, сифилиса, острых и хронических протозоонозов и тропических лихорадок, острого шистоматоза, хронического гепатита, микоплазмоза и многих инфекционных вазопатий. Инфекционный и иммунокомплексный факторы являются решающими при остром диффузном пролиферативном постстрептококковом гломерулонефрите и ревматизме.
 Иммунные комплексы и перекрёстный аутоиммунный ответ на собственные антигены нервной ткани, спровоцированный инфекцией, описаны при синдроме Гильена-Барр, а также других демиелинизирующих полинейропатиях, подостром склерозирующем панэнцефалите и боковом амиотрофическом склерозе.
Иммунные комплексы и перекрёстный аутоиммунный ответ на собственные антигены нервной ткани, спровоцированный инфекцией, описаны при синдроме Гильена-Барр, а также других демиелинизирующих полинейропатиях, подостром склерозирующем панэнцефалите и боковом амиотрофическом склерозе.
 Иммунокомплексный процесс наблюдается при болезнях кожи (герпетиформный дерматит, пемфигус и пемфигоид), глазных болезнях (увеиты, иридоциклиты, ретиниты, конъюнктивиты), заболеваниях ЖКТ (язвенный колит, болезнь Крона, целиакия), эндокринопатиях (тироидит Хашимото, инсулинзависимый сахарный диабет). При всех этих нарушениях он не служит “основным мотором” процесса, а выполняет сопутствующую роль или активен на отдельных этапах болезни, при возникновении осложнений и у предрасположенных к задержке клиренса иммунных комплексов лиц. Иммунокомплексный механизм усматривается и в развитии синдрома Рейтера (уретрит, сакроилеит, конъюнктивит), а также при анкилозирующем спондилите.
Иммунокомплексный процесс наблюдается при болезнях кожи (герпетиформный дерматит, пемфигус и пемфигоид), глазных болезнях (увеиты, иридоциклиты, ретиниты, конъюнктивиты), заболеваниях ЖКТ (язвенный колит, болезнь Крона, целиакия), эндокринопатиях (тироидит Хашимото, инсулинзависимый сахарный диабет). При всех этих нарушениях он не служит “основным мотором” процесса, а выполняет сопутствующую роль или активен на отдельных этапах болезни, при возникновении осложнений и у предрасположенных к задержке клиренса иммунных комплексов лиц. Иммунокомплексный механизм усматривается и в развитии синдрома Рейтера (уретрит, сакроилеит, конъюнктивит), а также при анкилозирующем спондилите.
Считается, в частности, что иммунные комплексы с участием гликированных белков плазмы крови и сосудистой стенки, а иногда - и ксеногенного инсулина, служат важным фактором, способствующим развитию системной микроангиопатии у больных инсулинзависимым сахарным диабетом I типа, со временем приводящей к гломерулосклерозу, ретинопатии, полинейропатии и нарушению диэнцефальных функций.
 Вторичный иммунокомплексный процесс сопутствует лимфолейкозам и другим гемобластозам (лимфомы, лимфогранулёматоз), а также раку лёгких и меланомам кожи.
Вторичный иммунокомплексный процесс сопутствует лимфолейкозам и другим гемобластозам (лимфомы, лимфогранулёматоз), а также раку лёгких и меланомам кожи.
Именно васкулитный тип иммунопатологических нарушений ответственен за раннюю фазу сывороточной болезни и отравление пеницилламином, при которых его симптомы проявляются в классическом виде.
В качестве типового случая системного некротизирующего васкулита, обусловленного иммунными комплексами, можно рассматривать сывороточную болезнь. Она развивается через 8 - 10 дней после однократного введения большого количества ксеногенной сыворотки. Сывороточная болезнь проявляется: повышением температуры, увеличением селезенки и лимфоузлов, протеинурией, лейкоцитозом, артральгиями, кожной сыпью, иногда, геморрагического характера, снижением содержания факторов комплемента в крови.
Симптоматика болезни возникает с появлением в кровотоке антител. Симптомы сохраняются до тех пор, пока в кровотоке находится свободный антиген (область избытка антигена, растворимые иммунные комплексы).
После элиминации антигена симптомы исчезают. Перенесенная сывороточная болезнь оставляет после себя повышенную чувствительность к белкам чужеродной природы: повторная инъекция может вызвать анафилактический шок.
Поздние механизмы сывороточной болезни включают и иные гиперэргические реакции, в частности, ГЗТ.
Системная красная волчанка (СКВ или SLE) - во многом, обусловленное иммунными комплексами, аутоиммунное заболевание кожи и соединительной ткани внутренних органов. Если процесс ограничивается соединительной тканью кожи - говорят о дискоидной красной волчанке. Клиника красной волчанки зависит от того, какая система поражена. На первый план выступают патологические изменения кожи, суставов, почек, крови и мозга. Кроме того, возможно увеличение селезенки, лимфоузлов, а также - симптомы со стороны ЖКТ.
Иммунологический критерий заболевания - высокие титры антиядерных антител, точнее IgG к нативной двухцепочечной ДНК, которые обнаруживаются почти всегда (А.М.Поверенный, 1986). Можно обнаружить антитела к другим ядерным и органоспецифическим антигенам . Среди них - рибонуклеопротеид Смита или SM-антиген - у 30% пациентов, кардиолипин - примерно, у 50% больных (с выраженными тромбогеморрагическими симптомами) и другие. При СКВ, спровоцированной лекарствами, такими как гидралазин и новокаинамид, у 70% поражённых отмечаются и аутоантитела против нативных конформаций гистонового комплекса (А.Клеймэн и соавт., 1983). У 25% больных с поражением ЦНС наблюдаются антинейрональные аутоантитела.
Считается, что при красной волчанке, возможно, при участии поликлональных В-стимуляторов, в частности, вирусов, нарушена аутотолерантность и образуются высокие титры аутоантител, перекрестно реагирующих с многими антигенами. Иммуноглобулины к ДНК, реагируя с соответствующим антигеном ядер, образуют растворимые комплексы, связывающие комплемент. Болезни способствует нехватка C2, C4 и других белков комплемента, что связано с гаплотипом ГКГС DR2.
Эти иммунные комплексы - причина васкулита, полисерозита, эндокардита Либмана-Сакса и нефропатии, а также гемоцитопении. В развитии болезни участвуют и цитотоксические механизмы. Имеется модель СКВ у мышей NZB/NZW. Обнаружена модель заболевания у мышей MRL, в тимусе которых из-за отсутствия или дефекта поверхностного рецептора Т-клеток fas/APO-1 (триггера апоптоза, см. раздел “Механизмы апоптоза”) нарушен процесс внутритимической негативной селекции аутореактивных Т-клонов. В результате аутореактивные Т-хелперы могут персистировать и стимулировать многие клоны В-лимфоцитов к выработке аутоантител самой различной специфичности. Предполагается, что аналогичный механизм имеет место при ранней тяжёлой мультисистемной красной волчанке у детей. При поздних, менее тяжелых формах болезни могут присутствовать похожие дефекты молекул, участвующих в развитии периферических, пост-тимических механизмов толерантности, например CD28-маркера Т-клеток или В7/ВВ1-маркера В-лимфоцитов (Б.Ф.Хайнс, А.С.Фоси, 1994). Это объясняет неорганоспецифический, множественный характер аутоаллергии при СКВ и позволяет рассматривать иммунокомплексный процесс при этом заболевании, как вторичный, по отношению к аутоаллергии.
При других, сходных по патогенезу и клинике системных иммунопатологических поражениях неорганоспецифического характера (ранее именовавшихся коллагенозами) также широко представлены иммунокомплексные процессы, а различия в клинике коррелируют с особенностями спектра аутоаллергии (Е.М.Тан, 1982). Так, при склеродермии типичны аутоантитела к белкам центромера (при наличии синдрома Рейно) и к ДНК-топоизомеразе 1 ( старое название - анти- Sci70, наблюдается при диффузной форме болезни). Но частота их обнаружения не превышает 10%, несмотря на высокую специфичность для данного заболевания. По неизвестным причинам, васкулит при склеродермии имеет характерную тенденцию к исходу в фиброз. Чаще всего вовлекаются кожа дистальных отделов конечностей, ЖКТ и почки, реже - лёгкие. Нередко имеется тяжёлая ишемия дистальных отделов конечностей - феномен Рейно (см. также выше стр. 170 ), в сочетании с кожным кальцинозом, эзофагитом, склеродактилией и телеангиэктазией (CREST-синдром).
Для дерматомиозита типичны ингибирующие аутоантитела к аминоацил-тРНК-синтетазам (антиген Jo-1, частота обнаружения от 5%) и протеинкиназам. Васкулит охватывает скелетные мышцы и кожу. По неясным причинам, это сопровождается резко повышенной частотой злокачественных новообразований различных локализаций - до 8% больных дерматомиозитом страдают онкологическими болезнями (М.Метьюз и соавт. 1983; Д.Стетлер и соавт, 1982).
При синдроме Г.Шёгрена имеется аутоиммунитет к рибосомальным антигенам Ro (30%)и La (10%), в первом случае это коррелирует клинически с развитием гломерулонефрита. Синдром может наблюдаться отдельно, как атрофический сиалоаденит с сопутствующим поражением слёзных и даже потовых желез лица (“сухой синдром”), слизистых желёз вульвы и ануса, зудом. Иногда синдром сопровождает СКВ или ревматоидный артрит. Смешанное заболевание соединительной ткани комбинирует иммунные васкулиты и другие симптомы, вызванные аутоантителами различной специфичности, наиболее часто превалируют антитела к рибонуклеопротеидам (70%). Распространенным иммунокомплексным заболеванием, особенно, в Новом Свете, где поражены до 2% населения, является ревматоидный артрит. Иммунные комплексы, активирующие комплемент, откладываются в сосудах и в синовиальной оболочке суставов. Заболевание протекает как хронический синовиит с повторными обострениями и ремиссиями или постоянно прогрессирует, приводя к деструкции и тугоподвижности суставов (прежде всего, кистей и стоп). Помимо суставов в процесс вовлекаются кожа, где формируются гранулёмы, и реже - сердце, почки, легкие, ткани глаза и др. органы, а иногда - периферические нервы. Достаточно нередко возникает полисерозит. Предполагается, что этиология заболевания может быть связана с провокацией аутоиммунного процесса у лиц с определенными антигенами ГКГС (DR4) инфекционными агентами, в частности вирусом Эпштейна-Барр, и, возможно, микоплазмами, Proteus mirabilis и бореллиями. Типичный иммунодиагностический признак - обнаружение в сыворотке ревматоидных факторов. Они вырабатываются у 90% больных, но бывают и при других иммунокомплексных васкулитах, а также почти у 5% клинически здоровых людей (Р.С.Уильямс, 1982,1983). П.Кристенсен и А.Шрёдер считают их антиидиотипическими образами кокковых Fc-связывающих белков (1990).
 Это антитела, преимущественно класса M или G (реже - А и E), к собственным Fc-фрагментам IgG. По В.Аньелло (1980), они перекрестно реагируют с нативными комбинациями ядерных гистонов. Вследствие этого до 40% больных экспрессируют аутоантитела к ядерным гистонам. Формируя иммунные комплексы, ревматоидные факторы активируют лимфоциты, полиморфонуклеары, макрофаги и синовиоциты, что ведет к воспалению. Считается, что особенно важными медиаторами ревматоидного артрита в синовии служат ФНО и ИЛ-1. Под воздействием цитокинов формируется грануляционная ткань, инфильтрированная клетками-участниками воспаления - паннус, деформирующий суставную поверхность и разрушающий хрящ. К ревматоидному артриту относятся также:
Это антитела, преимущественно класса M или G (реже - А и E), к собственным Fc-фрагментам IgG. По В.Аньелло (1980), они перекрестно реагируют с нативными комбинациями ядерных гистонов. Вследствие этого до 40% больных экспрессируют аутоантитела к ядерным гистонам. Формируя иммунные комплексы, ревматоидные факторы активируют лимфоциты, полиморфонуклеары, макрофаги и синовиоциты, что ведет к воспалению. Считается, что особенно важными медиаторами ревматоидного артрита в синовии служат ФНО и ИЛ-1. Под воздействием цитокинов формируется грануляционная ткань, инфильтрированная клетками-участниками воспаления - паннус, деформирующий суставную поверхность и разрушающий хрящ. К ревматоидному артриту относятся также:
· синдром Фелти (форма пожилых, с высоким титром ревматоидных факторов, спленомегалией и иммунокомплексной панцитопенией),
· синдром Каплана ( с выраженным узловатым пневмофиброзом - форма, типичная для профессионального ревматоидного артрита шахтёров, возможно, комбинирует иммунокомплексный васкулит и описываемый ниже механизм феномена Артюса),
· болезнь Стилла (ювенильная форма с моноартритом и тяжелыми внесуставными поражениями, но при низком титре ревматоидных факторов).
Дата добавления: 2018-06-01; просмотров: 1239; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
