Врач предполагает наличие гиповитаминоза С у больного. Как можно провести биохимическую диагностику гиповитаминоза С?
Диагностика гиповитаминоза С проводится следующим образом: при введении в организм 100 мг аскорбиновой кислоты у здорового человека концентрация витамина С в моче увеличивается. При гиповитаминозе ткани задерживают аскорбиновую кислоту и ее выведение из организма снижается. Экскреция витамина С с мочой снижается при цинге, острых и хронических инфекционных заболеваниях, при недостаточном поступлении вит. С с пищей.
Билет 10
1)Простые и сложные белки…
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада. Классификация сложных белков: фосфопротеины (содержат фосфорную кислоту, кот присоединяется к ОН сер и тре), хромопротеины (флавопротеины(ФМН и ФАД) и гемопротеины(ферменты – цитохромы, каталаза и пероксидаза и неферменты – гемоглобин и миоглобин)), нуклеопротеины (содержат ДНК и РНК – рибосомы и хроматин), гликопротеины (содержат углеводы, кот связаны ковалентно с ОН гр сер и тре через О-гликозижную связь и с NH-гр арг и асп через N-гликозидную связь), липопротеины (содержат липиды, связанные с пом. нековалентных св: гидрофобных и ионных) и металлопротеины (содержат металлы). При функционировании белков может происходить их связывание с лигандами –низкомолекулярными веществами. Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 - ионными связями).
|
|
|
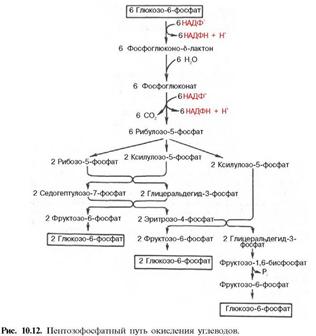
2)Пентозофосф. Путь превр.глюкозы…
Белок плазмы крови
А) экспресс-метод (метод «висящей» капли) В основу метода положена зависимость между содержанием белков в плазме и цельной крови и ее удельным весом. Определение удельного веса плазмы и цельной крови осуществляется путем погружения капли в растворы CuSO4 известного веса. Тот раствор CuSO4 , в котором капля сначала повисает, а затем опускается, равен удельному весу исследуемой жидкости. 65-85 г/л
6.5-8.5 мг% Гиперпротеинемия – увеличение общего содержания белков плазмы крови наблюдается при диарее у детей, рвоте, непроходимости верхнего отдела тонкой кишки, обширных ожогах. Потеря воды организмом приводит к повышению концентрации белка в крови: а) относительная гиперпротеинемия связана с потерей воды организмом (диарея, рвота, ожоговая болезнь, травмы); б) абсолютная гиперпротеинемия обусловлена резким нарастанием глобулинов при инфекциях, а также синтезом патологических белков или белков «острой фазы».
|
|
|
Гипопротеинемия – снижение общего содержания белков плазмы может быть обусловлено с несколькими причинами: а) нарушение белок-синтезирующей функции печени (паренхиматозная желтуха, гепатиты, цирроз печени). Происходит снижение белкового коэффициента за счет снижения синтеза альбуминов; б) задержкой воды при заболеваниях сердечно-сосудистой системы; в) потерей белка с мочой при патологии почек; г) кровопотерями при травмах и операциях
Б) биуретовый метод Метод основан на образовании биуретового комплекса Cu(OН)2 с пептидными связями, имеющего розово-фиолетовое окрашивание. Интенсивность окраски пропорциональна количеству пептидных связей.
В) метод Лоури. Метод основан на способности белков образовывать окрашенные комплексы синего цвета при осуществлении двух цветных реакций – биуретовой и реакции Фолина (восстановление белками смеси фосфорновольфрамовой и фосфорномолиюденовой кислот – реактив Фолина). Интенсивность окраски зависит от количества белка.
|
|
|
Активность аминотрансфераз (АлАт и АсАт) в крови. Метод определения активности АлАт и АсАт основан на определении оптической плотности дифенилгидразона пирувата, явлвющегося продуктом дезаминирования аланина и иаспартата. АлАт 0.1-0.7
 АсАт 0.1-0.55 Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к 4-5 дню активность АсАт не снижается, то пророгноз плохой.
АсАт 0.1-0.55 Повышение активности аминотрансфераз в сыворотке крови отмечено при целом ряде заболеваний и особенно при поражении органов и тканейЮ, богатых данными ферментами (печень, миокард). АсАт – резкое повышение через 6-12 часов после возникновения инфаркта миокарда, достигает максимума к 24-48 часам, а затем постепенно к 5 дню приходит к норме. Если к 4-5 дню активность АсАт не снижается, то пророгноз плохой.
АлАт – при заболеваниях печени, токсических поражениях печени, холепатиях, холестазе, дерматомиозите. Повышение активности АлАт наблюдается при остром инфаркте миокарда, но не столь резко по сравнению с изменением АсАт. В норме соотношение акимвности АлАт и АсАт= 1.33±0.42. У больных инфекционным гепатитом происходит снижение коэффициента, а при инфаркте миокарда – резко возрастает.
|
|
|
4) У больного с наклонностью к гиперхолестеринемии, прием даже умеренного количества углеводов с пищей ведет к гиперхолестеринемическому кризу. Почему ?
Углеводы, являются одним из источников Ацетил-КоА для организма, который в норме утилизируется в цикле Кребса. При предрасположенности к гиперхолестеринемии происходит снижение утилизации Ацетил-КоА в и направление его на синтетические процессы, в том числе и синтез холестерина.
Билет 11
1)Регуляция действия ферментов…
2)Биосинтез глюкозы…
Биосинтез глюкозы (глюконеогенез) из молочной кислоты. Глюконеогенез – обращение реакций гликолиза. Из 11 реакций гликолиза 3 необратимы (1-ая, 3-я и 10-я):
1. глюкоза → глюкозо-6 фосфат
2. фруктозо-6-фосфат → фруктозо-1,6-дифосфат
3. фосфоенолпируват → пируват
Для этих реакций существуют обходные пути. Первый обходной путь начинается в матриксе митохондрий. Пируват проникает сквозь мембрану митохондрий в матрикс митохондрии, затем пируват подвергается карбоксилированию под действием фермента пируваткарбоксилаза (с использованием биотина и энергии АТФ). В результате этой реакции образуется оксалоацетат. Затем оксалоацетат превращается в малат, чтобы выйти из митохондрий в цитозоль клетки для дальнейшего превращения. В цитозоле малат обратимо превращается в оксалоацетат (под действием цитозольной малатдегидрогеназы). Образовавшийся оксалоацетат под действием фермента фосфоенолпируваткарбоксикиназы (при участии биотина и энергии ГТФ) превращается в фосфоенолпируват. В дальнейшем реакции глюконеогенеза идут до образования фруктозо-1,6-дифосфата (обратимые реакции гликолиза). Второй обходной путь: Фруктозо-1,6-дифосфат + Н2О → фруктозо-6-фосфат + Фн (реакцию катализирует фруктозо-1,6-бифосфатаза) Третий обходной путь: Глюкозо-6-фосфат + Н2О → глюкоза + Фн (реакцию катализирует глюкозо-6-фосфатаза) В процессе глюконеогенеза 7-я реакция гликолиза (1,3-дифосфоглицерат + АДФ ↔ 3- фосфоглицерат + АТФ) расходуется 2 АТФ. В ходе синтеза глюкозы используются макроэргические соединения: 4 АТФ и 2 ГТФ. Регуляция глюконеогенеза происходит с участием гормонов и с участием метаболитов.
1. Гормональная регуляция. Глюкокортикоиды проникают в клетку, усиливают биосинтез ферментов глюконеогенеза, способствуют повышению уровня сахара в крови.
2. Метаболическая регуляция. Ацетил-КоА стимулирует пируваткарбоксилазу, осуществляющую реакцию превращения пирувата в ЩУК и далее в глюкозу. АТФ участвует в процессах карбоксилирования, стимулирует глюкозо-6-фосфатазу и фруктозо-1,6-бисфосфатазу, усиливает процессы глюконеогенеза. Витамин Н (биотин) – кофермент пируваткарбоксилазы. Фруктозо-2,6- дифосфат ингибирует фруктозо-1,6-бисфосфатазу.
Цикл Кори. В процессе анаэробного гликолиза в скелетных мышцах образуется лактат, который выходит из клеток в кровь, доставляется в печень, где включается в реакции глюконеогенеза с образованием глюкозы. Глюкоза выходит в кровь, доставляется к тканям, где используется как источник энергии. Цикл Кори выполняет две важные функции: 1) обеспечивает утилизацию лактата в реакциях глюконеогеназа; 2) предотвращает накопление лактата и развитие лактоацидоза (смещение рН в кислую сторону)
3) Количест-венное опре-деление би-лирубина в сыворотке крови мето-дом разбав-ления по Бакальчуку Метод основан на цветной реакции билирубина с диазореак-тивом. Для появления розово-фиолетовой окраски достаточно 0,00156 мг билирубина в 1 мл, что соответствует,16 мг%. Чтобы найти наименьшее количество сыворотки, дающее с диазореактивом характерную окраску и соответствующее 0,16 мг% билирубина, сыворотку разбавляют в геометрической прогрессии пока не будет найдена граница видимой окраски. Отметить последнюю пробирку, в которой наблюдается окраска от прибавления реактива. Расчет ведут по формуле:
Билирубин (мг%) = 0,00156мг•разведение •100 1,7-20,5 мкмоль/л Определение общего билирубина и его фракций в крови имеет важное значение при дифференциальной диагностике желтух
Дата добавления: 2018-06-01; просмотров: 384; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
