Опыт 5. Взаимодействие металлического Mg - с водой (показательный)
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №9
На тему: «Химические свойства металлов IA и IIA- подгрупп»
Выполнил
студент группы__________ ______________ Фамилия И.О.
(Подпись, дата)
Принял
доцент кафедры ОАХ ______________ Чалова О.Б.
(Подпись, дата)
Цель работы:
- Изучить свойства металлов IA и IIA- подгрупп;
- Изучить свойства характеристичных соединений металлов IA и IIA- подгрупп;
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны
IA- подгруппа:
IIA- подгруппа:
Степени окисления: IA- подгруппа ………..IIA- подгруппа …….
В главных IA и IIA подгруппах периодической системы Д.И. Менделеева с увеличением заряда ядра
радиусы атомов…………………………, энергии ионизации………………………., электроотрицательность элементов…………………………..
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
|
|
|
φ(Men+/Me) =
- активность металлов:
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) K б) Be
- взаимодействие с галогенами (хлором):
а) Cs б) Sr
- взаимодействие с серой:
а) Rb б) Mg
- взаимодействие с азотом:
а) Li б) Be
- взаимодействие с водой:
а) K б) Ba
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Ca + HBr → б) Mg + HF →
- Металл IIA – подгруппы …………….. не взаимодействует с водой, так как …………………………………, но легко вытесняет водород из водного раствора щелочи
……… + NaOH + H2O →
- взаимодействие с концентрированной H2SO4:
а) Mg + H2SO4(конц) → ………….+ S + H2O
б) Ca + H2SO4(конц) → ………….+ H2S + H2O
|
|
|
- взаимодействие с разбавленной и концентрированной HNO3:
а) Mg + HNO3(разб) → ………….+ N2 + H2O
б) Mg + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксидов металлов IA и IIA- подгрупп:
- формулы оксидов металлов IA …………и IIA- подгрупп……………….
- формулы гидроксидов металлов IA ……………..и IIA- подгрупп……………
- растворимость, взаимодействие с водой оксидов и гидроксидов металлов IA и IIA- подгрупп
а) оксид бария б) оксид бериллия
- диссоциация в водном растворе гидроксидов металлов IA и IIA- подгрупп;
а) гидроксид стронция б) гидроксид лития
Оксиды и гидроксиды металлов IA и IIA- подгрупп проявляют………………………… свойства, за исключением ………………........, проявляющие амфотерные свойства.
- взаимодействие оксидов и гидроксидов металлов IA и IIA- подгрупп с кислотами и кислотными оксидами.
а) CaO + H2SO4 → б) Mg(OH)2 + H2SO4 →
- взаимодействие оксида и гидроксида Be с основаниями при сплавлении происходит с образованием бериллата натрия:
BeO + NaOH → Na2BeO2 + H2O
|
|
|
Be(OH)2 + NaOH → Na2BeO2 + H2O
- взаимодействие оксида и гидроксида Be с водными растворами щелочей происходит с образованием комплексного соединения – тетрагидроксобериллата натрия:
BeO + NaOH + H2O → Na2[Be(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH)4]
4. Нахождение в природе и получение простых веществ - щелочных и щелочноземельных металлов.
NaCl → Na +
5. Получение и применение соединений щелочных металлов:
Составьте формулы:
каустической соды…………… кальцинированной соды…………… пищевой соды….
Все опыты со щелочными и щелочноземельными металлами следует проводить осторожно, не роняя кусочков металла на пол, одежду, и строго соблюдая методику проведения опыта. Категорически запрещается наклонять лицо над сосудом, в котором происходит реакция!
Опыт 1. Получение бинарных соединений магния реакцией горения (показательный)
Взять в тигельные щипцы стружку магния и поджечь.
Охарактеризовать внешний вид металлического магния.
Объяснить, почему в обычных условиях металлический магний устойчив на воздухе.
Отметить, как протекает реакция: активно или нет, что выделяется;
- стружка магния сгорела полностью или нет, объяснить;
|
|
|
- охарактеризовать внешний вид продуктов реакции;
- составить уравнения реакций магния с основными компонентами воздуха:
Mg + O2 →
Mg + N2 →
- вывод:
Опыт 2. Взаимодействие продуктов горения магния с водой
Белые порошкообразные продукты горения магния на воздухе (опыт 1) перенести в пробирку с дистиллированной водой, добавить 2 капли индикатора фенолфталеина.
- Отметить наблюдения;
- охарактеризовать растворимость оксида и гидроксида магния в воде;
- фенолфталеин окрасил раствор в ……………………..цвет, это свидетельствует о том, что среда в растворе полученных продуктов ……………………..
- составить уравнения реакций взаимодействия бинарных соединений магния с водой:
MgO + H2O →
Mg3N2 + H2O →
- составить уравнение электролитической диссоциации гидроксида магния;
Mg(OH)2↓ 
- охарактеризовать кислотно-основные свойства оксида и гидроксида магния.
Опыт 3. Взаимодействие металлического Na с водой (показательный)
Налить в широкий стакан до половины объёма дистиллированной воды, добавить несколько капель фенолфталеина и опустить в него кусочек натрия, быстро прикрыть стакан часовым стеклом и наблюдать за протеканием реакции.
- Охарактеризовать внешний вид металлического натрия
- Отметить, как протекает реакция
- как изменился внешний вид кусочка натрия в ходе рееакции…………
- взаимодействие натрия с водой идет с выделением или поглощением тепла………………
- составить уравнение реакции:
Na + H2O ®
- указать восстановитель……….. и окислитель…………….
- выделяется газ………………
- рассчитать потенциал «водородного электрода» 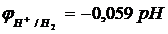 =
=
(при рН=7);
- рассчитать ЭДС реакции: ЭДС = (φок. – φвос.) =
- фенолфталеин окрасился в…………………..цвет, в растворе полученных продуктов ………………….. среда;
- ответить, какие металлы активно взаимодействуют с водой.
Опыт 4. Взаимодействие металлического Ca с водой (показательный)
Налить в широкий стакан до половины объёма дистиллированной воды, добавить несколько капель фенолфталеина и опустить в него кусочек кальция, быстро прикрыть стакан часовым стеклом и наблюдать за протеканием реакции.
- Охарактеризовать внешний вид металлического кальция
- Отметить, как протекает реакция с Ca при комнатной температуре;
- сравнить активность металлов Na и Ca
- составить уравнение реакции:
Ca + H2O ®
- указать восстановитель……….. и окислитель…………….
- выделяется газ………………
- рассчитать ЭДС реакций: ЭДС = (φок. – φвос.) =
- фенолфталеин окрасился в…………………..цвет, в растворе полученных продуктов ………………….. среда;
- ответить, какие металлы активно взаимодействуют с водой.
Опыт 5. Взаимодействие металлического Mg - с водой (показательный)
В пробирку налить 2-3 мл дистиллированной воды, добавить 2 капли раствора фенолфталеина и поместить немного металлического магния. Наблюдать за изменениями в пробирках в течение 3-5 минут. Пробирку с магнием нагреть на спиртовке до кипения.
- Отметить, как протекает реакция с Mg при комнатной температуре;
- Отметить, как протекает реакция с Mg при нагревании;
- сравнить активность металлов Ca и Mg ;
- составить уравнение реакции:
Mg + H2O ®;
- указать восстановитель……….. и окислитель…………….
- рассчитать ЭДС реакций: ЭДС = (φок. – φвос.) =
- при комнатной температуре магний практически не взаимодействует с водой, потому что ….
- что «пассивирует» Mg и почему при нагревании реакция осуществляется;
- фенолфталеин окрасился в…………………..цвет, в растворе полученных продуктов ………………….. среда;
- ответить, какие металлы активно взаимодействуют с водой.
Опыт 6. Свойства гидроксидов бериллия и магния
а) В две пробирки налить по 3 ... 5 капель раствора хлорида бериллия и добавить в каждую пробирку раствор гидроксида аммония по каплям до образования осадка. Затем в одну пробирку добавить HCl, а в другую - избыток NaOH до растворения осадков.
- Охарактеризовать внешний вид осадка гидроксида бериллия;
- составить уравнение реакции образования гидроксида бериллия в молекулярной и ионной форме:
BeSO4 + NH4OH →
- отметить, какие изменения происходят с осадком гидроксида бериллия при добавлении избытка соляной кислоты …………………………….и избытка гидроксида натрия…………………………..;
- составить уравнение реакции взаимодействия гидроксида бериллия с соляной кислотой в молекулярной и ионной форме:
Be(OH)2 + HCl →
- составить уравнение реакции взаимодействия гидроксида бериллия с избытком гидроксида натрия:
Be(OH)2 + NaOH →
- ответить, какие кислотно-основные свойства проявляет гидроксид бериллия.
Б) В две пробирки налить по 3 ... 5 капель раствора хлорида магния и раствора NaOH до образования осадка. Отметить цвет осадка. Затем в одну пробирку добавить 3 ... 5 капель (избыток) NaOH, а в другую - 5 капель (избыток) HCl.
- Охарактеризовать внешний вид осадка гидроксида магния;
- составить уравнение реакции образования гидроксида магния в молекулярной и ионной форме:
MgSO4 + NaOH →
- при добавлении избытка соляной кислоты осадок гидроксида магния …………………………….
- при добавлении избытка гидроксида натрия осадок гидроксида магния …………………………..;
- составить уравнение реакции взаимодействия гидроксида магния с соляной кислотой в молекулярной и ионной форме:
Mg(OH)2 + HCl →
- ответить, какие кислотно-основные свойства проявляет гидроксид магния.
Опыт 7. Получение осадков солей металлов IIА подгруппы
а) В три пробирки внести по 2 ... 3 капли растворов солей: в первую пробирку – хлорида кальция, во вторую - нитрата стронция, в третью хлорида бария и прилить в каждую пробирку по 2 ... 3 капли разбавленного раствора серной кислоты.
- Отметить внешний вид, цвет и количество выпавших осадков.
- первым выпал осадок………..……., вторым – осадок …….………….. и третьим - ……………………..
- Выписать из таблицы произведения растворимости и сравнить растворимость образовавшихся осадков:
ПРCaSO4 = ПРSrSO4 = ПРBaSO4 =
- Составить уравнения реакций в молекулярной и ионной форме:
Вывод:
Дата добавления: 2018-05-31; просмотров: 1992; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
