ОПЫТ 3. ПОЛУЧЕНИЕ ИОДА И ИЗУЧЕНИЕ ЕГО ФИЗИЧЕСКИХ СВОЙСТВ
 3.1. Получение кристаллическогоиода.
3.1. Получение кристаллическогоиода.
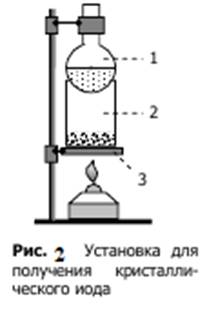
Собрать установку, схема которой дана на pис. 6.
На асбестированную секу (3) поставить стакан (2), в который поместить по 0,5 г измельченных иодида калия и оксида марганца и хорошо перемешать. Затем добавить 7-8 капель концентрированной серной кислоты и накрыть стакан колбой (1) с холодной водой. Подогревать реакционную смесь в течение 20 мин. Что наблюдается
и почему?
……………………………………………………………………………………………
По окончании реакции прекратить нагрев. (После демонстрации кристаллы иода тщательно соскрести с колбы и сдать препаратору.)
Получение жидкогоиода.
Поместить в пробирку 0,3 г кристаллического иода (взять у препаратора), заткнуть пробирку ватой и нагревать ее в пламени спиртовки. Что наблюдается? Почему?
…………………………………………………………………………………………………………………………………………………….
Показать получение жидкого иода группе и продемонстрировать невозможность расплавления иода в открытой фарфоровой чашке (на плитке под тягой и не более одного кристаллика).
Изучение растворимости иода.
Налить в три пробирки по 1 мл воды и опустить в них по кристаллику иода. Взбалтывать содержимое пробирок в течение минуты. Что наблюдается?
…………………………………………………………………………………………………………………………………………………….
Что можно сказать о растворимости иода в воде?
…………………………………………………………………………………………………………………………………………………….
|
|
|
Каков состав полученной иодной воды?
…………………………………………………………………………………………………………………………………………………….
В одну из пробирок с раствором иода всыпать 6-7 кристаллов иодида калия, во вторую добавить 1 мл этилового спирта, а в третью – 1 мл воды. Хорошо перемешать содержимое пробирок. Растворяются ли при этом кристаллы иода?…………………………………………………………………………………………………………………………………………………….
Отметить и сравнить окраску растворов в трех пробирках и объяснить наблюдения.
…………………………………………………………………………………………………………………………………………………….
Далее в присутствии группы в процессе демонстрации в третью пробирку (с иоднойводой) прилить 0,5 мл бензина и, закрыв пробирку пробкой, резко встряхивать ее до полного растворения кристаллов иода. После расслаивания жидкостей отметить их цвет и сделать вывод.
…………………………………………………………………………………………………………………………………………………….
Сравнение свойств «связанного» и «свободного» иода.
Разбавить раствор «синего» крахмала, полученный по пункту 1.1, до голубого цвета. Затем определить, изменяется ли его окраска при нагревании (показать группе), восстанав-
|
|
|
ливается ли при охлаждении. Почему?
…………………………………………………………………………………………………………………………………………………….
Этим раствором и для сравнения аптечным иодом сделать надписи на бумаге и после высыхания попытаться стереть их сухой тряпкой. Удается ли? Почему?
…………………………………………………………………………………………………………………………………………………….
ОПЫТ 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ИОДА
Химическое травление металла иодом.
Медную или железную пластинку отшлифовать наждачной бумагой до блеска и, используя зажженную свечу, покрыть ее парафином. Иголкой нарисовать на парафине любой рисунок (канавки должны доходить до металла). Затем нанести слой аптечногоиода на царапины с помощью капельницы. Когда иод побледнеет, его удалить, а на царапины нанести свежую порцию I2 . Через час снять слой парафина с пластинки. Что на ней видно?
…………………………………………………………………………………………………………………………………………………….
Объяснить результат эксперимента.
…………………………………………………………………………………………………………………………………………………….
|
|
|
Аналогично ли пойдет процесс с раствором иода в бензине? Почему?
…………………………………………………………………………………………………………………………………………………….
Вытеснение брома иодом.
К 5 каплям насыщенного раствора бромата калия добавить 6 капель 1М серной кислоты и кристаллик иода, а после его полного растворения еще и 6 капель бензина, резко встряхнуть пробирку и дождаться расслоения жидкостей. Что наблюдается и почему?
…………………………………………………………………………………………………………………………………………………….
Взаимодействие иода с активными металлами.
На асбестированной сетке тщательно смешать 1 г мелкорастертогоиода и 0,3 г цинковой пыли (или 0,1 г алюминиевой и 0,8 г иода), насыпать в виде холмика и, пригласив группу для наблюдения опыта, добавить 6 капель воды. Что происходит? Почему?
…………………………………………………………………………………………………………………………………………………….
ОПЫТ 5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СОЕДИНЕНИЙ ХЛОРА И ИОДА
Окисление сахара хлоратом калия.
На двух кафельных плитках смешать (с помощью стеклянной палочки) по лопаточке растертого сахара и бертолетовой соли. Поднести к одной смеси горящую лучину (что происходит?), а другую смочить из пипетки тремя каплями концентрированной H2SO4. Что наблюдается? Почему?
|
|
|
…………………………………………………………………………………………………………………………………………………….
Окисление иодида калия.
Поместить в пробирку 4 капли иодида калия и 1 мл 1M серной кислоты. Затем прибавлять по каплям 0,01М перманганат калия и, сильно встряхивая пробирку после добавления каждой капли, следить за изменением окраски раствора. (Объяснить его пожелтение и проверить объяснение экспериментально (с помощью какого реактива?) в отдельной пробирке.)
…………………………………………………………………………………………………………………………………………………….
К 2 каплям полученного раствора прилить 1 мл 1M серной кислоты и 0,5 мл бензина. Что происходит при добавлении избытка перманганата калия (по каплям и при постоянном встряхивании содержимого пробирки). Почему?
…………………………………………………………………………………………………………………………………………………….
Дата добавления: 2018-05-31; просмотров: 371; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
