Роль российского закона формирования спектров атомов и ионов в расшифровке структур атомов и ионов.
Таким образом, в условиях, когда оба электрона атома гелия находятся в атоме, и каждый из них взаимодействует со своим протоном в ядре, их энергии связи с ядром одинаковы. После удаления одного электрона из атома оставшийся электрон (второй электрон) начинает взаимодействовать не с одним, а с двумя протонами ядра.
Этот вывод имеет большое значение для химии. Оба электрона атома гелия имеют равную вероятность формирования связей с электронами других атомов, так как у них одинаковые энергии связи с ядром на всех энергетических уровнях. Из этого следует, что энергии поглощаемых фотонов распределяются между двумя электронами, и оба они одновременно переходят на другие энергетические уровни. Закон формирования спектров атомов и ионов отражает, описанную закономерность изменения энергий связи электронов с протонами ядер любого атома, которая даёт один и тот же результат для разных атомов, доказывая правильность высказанных предположений [2].
14.33. Почему энергия связи первого электрона атома лития (рис. 112, с) так же как и энергия связи первого электрона атома гелия близки к энергиям связи электрона атома водорода на соответствующих энергетических уровнях (табл. 40)? Анализ схемы атома лития на рис. 112, с, показывает, что симметрично расположенные электроны будут иметь одинаковые энергии связи с ядром.
На электрон, расположенный справа от ядра, будут действовать электростатические силы отталкивания двух других электронов, поэтому он будет расположен дальше от ядра и его энергия ионизации будет наименьшей. Этому электрону мы присваиваем первый номер и обращаем внимание на то, что энергия ионизации его Ei=5,392eV меньше соответствующей энергии ионизации атома водорода Ei=13,598eV. Схема атома лития (рис. 112, d) позволяет понять причину такого различия.
|
|
|
Как видно, два симметрично расположенных осевых электрона (2 и 3) своими электростатическими полями удаляют первый электрон атома лития от его ядра, уменьшая его энергию связи с протоном, а значит - и его энергию ионизации. Указанный расчёт выполняется по формуле (78) и представлен в табл. 40.
Таблица 40. Энергии связи 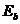 электрона атома водорода
электрона атома водорода 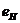 и первого, второго и третьего электронов атома лития
и первого, второго и третьего электронов атома лития 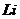 с ядром (121).
с ядром (121).
| N | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
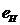
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 1 | 14,06 | 3,51 | 1,56 | 0,88 | 0,56 | 0,39 | 0,29 | 0,22 | 0,17 |
| 2 | 54,16 | 13,54 | 6,02 | 3,38 | 2,17 | 1,50 | 1,10 | 0,85 | 0,67 |
| 3 | 122,5 | 30,6 | 13,6 | 7,65 | 4,90 | 3,40 | 2,50 | 1,91 | 1,51 |
| N | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
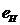
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 1 | 0,14 | 0,12 | 0,10 | 0,08 | 0,06 | 0,06 | 0,05 | 0,05 | 0,04 |
| 2 | 0,54 | 0,45 | 0,38 | 0,32 | 0,28 | 0,24 | 0,21 | 0,19 | 0,17 |
| 3 | 1,23 | 1,01 | 0,85 | 0,72 | 0,63 | 0,54 | 0,48 | 0,42 | 0,38 |
|
|
|
Анализируя таблицу 40, принадлежащую атому лития (рис. 112, с и d), видим близость энергий связи электрона атома водорода, и первого электрона атома лития на первом, втором и третьем энергетических уровнях, и почти полное совпадение на всех остальных. Это – одно из доказательств того, что первый электрон атома лития взаимодействует с одним протоном ядра [2].
Постепенное уменьшение разницы между энергиями связи электрона атома водорода и первого электрона атома лития по мере увеличения номера 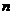 энергетического уровня объясняется уменьшением взаимного влияния всех трех электронов атома лития друг на друга. Начиная с 9-го энергетического уровня (табл. 40) это влияние исчезает, и энергии связи электронов атома водорода и первого электрона атома лития со своими протонами оказываются одинаковыми.
энергетического уровня объясняется уменьшением взаимного влияния всех трех электронов атома лития друг на друга. Начиная с 9-го энергетического уровня (табл. 40) это влияние исчезает, и энергии связи электронов атома водорода и первого электрона атома лития со своими протонами оказываются одинаковыми.
Нетрудно видеть, что, если в атоме лития останется один (третий) электрон, то он начнет взаимодействовать сразу с тремя протонами и его энергия связи с ядром увеличится. Спектр такого иона будет назваться спектром водородопобного атома.
|
|
|
14.34. Позволяет ли формула (78) рассчитать энергию связи любого электрона с протоном ядра атома и иона лития в момент пребывания электрона на любом энергетическом уровне?Конечно, позволяет. Для расчёта энергии связи электрона иона атома лития надо взять энергию ионизации атома водорода Ei=13,569eV, умножить её на квадрат количества 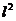 протонов в ядре атома и разделить на квадрат
протонов в ядре атома и разделить на квадрат 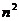 энергетического уровня, и сравнить результат с экспериментальными данными таблицы 40. Видим полное совпадение теоретических результатов с экспериментальными данными.
энергетического уровня, и сравнить результат с экспериментальными данными таблицы 40. Видим полное совпадение теоретических результатов с экспериментальными данными.
14.35. Какой электрон атома лития является главным валентным электроном?Это первый электрон с наименьшей энергией ионизации. Он дальше других расположен от ядра атома, поэтому имеет преимущества, перед другими электронами, вступать в связь с аналогичным электроном соседнего атома и при формировании молекул лития (рис. 113, d).
14.36. Почему 100% ядер атома бериллия (не считая изотопы) имеют 5 нейтронов и 4 протона (рис. 113)? Потому что только 5 нейтронов позволяют соединить 4 протона линейно в двух взаимно перпендикулярных направлениях, с помощью магнитных полюсов.

Рис. 113.
14.37. Почему энергии связи всех четырёх электронов атома бериллия (табл. на рис. 113) одинаковы на одноименных энергетических уровнях в условиях, когда они все находятся в атоме? Потому, что это симметричный атом (рис. 113). Каждый из его четырёх электронов взаимодействует со своим протоном ядра. Симметричность ядра порождает симметричность атома и симметричность электростатических сил, действующих между его электронами. В результате, когда они все находятся в атоме, то энергии связи у них с протонами ядра одинаковы на одноимённых энергетических уровнях, что хорошо видно в экспериментальной таблице на рис. 113, внизу [2].
|
|
|
14.38. Следует ли из экспериментов равенство энергий связей всех электронов атома бериллия на одноимённых энергетических уровнях? Анализируя таблицу на рис. 113, обратим внимание на то, что при удалении всех электронов от ядра атома их энергии связи с протонами уменьшаются и, начиная с 13 энергетического уровня, оказываются равными энергии связи электрона атома водорода с его ядром [2]. Это убедительное доказательство достоверности закона формирования спектров атомов и ионов (72), и следующего из него закона (71) формирования энергий связи любого электрона любого атома со своим протоном в его ядре.
14.39. Почему энергии связи всех четырех электронов атома бериллия (рис. 113) имеют энергии связи с протонами ядра, аналогичные энергиям связи электрона атома водорода, начиная лишь с 13-го энергетического уровня? Потому что на более низких энергетических уровнях они взаимодействуют друг с другом и для их удержания в атоме требуется энергия связи большая, чем у электрона атома водорода. По мере удаления электронов от ядра и перехода их на более высокие энергетические уровни, расстояния между электронами атома бериллия увеличиваются, и они перестают взаимодействовать друг с другом. А их энергии связи с протонами ядра, начиная с 13-го энергетического уровня, становятся такими же, как энергии связи электрона атома водорода со своим единственным протоном (таблица на рис. 113).
14.40. Откуда взяты энергии связи электронов атома бериллия, представленные в таблице на рис. 113? Это результаты расчёта по уже приведённой формуле (88). В их основе лежат экспериментальные значения энергий связи всех четырёх электронов со своими протонами.
14.41. Можно ли привести примеры ошибочных фундаментальных знаний, закладываемых в головы школьников?Они по адресам:
Дата добавления: 2018-06-27; просмотров: 286; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
