Основные направления экологического контроля
Определение уровня радиоактивности и наличия радиоактивных веществ
Тяжелые металлы – это металлы с плотностью 8000 кг/м3 и более (кроме благородных металлов). К тяжелым металлам относят свинец, медь, цинк, никель, кадмий, кобальт, сурьма, олово, висмут, ртуть.
Почти все тяжелые металлы – высокотоксичные. Антропогенное рассеивание тяжелых металлов в т.ч. в виде солей приводит к отравлению или угрозе отравления живых органических организмов.
Установление и определение содержания канцерогенных и вредных органических веществ
1) Биологическая оценка загрязнителей
Медь – норма 15 – 60 мг/кг; избыток более 60мг/кг приводит к заболеванию печени.
Кобальт – норма 2 – 50 мг/кг; избыток – угнетение синтеза витамина В.
Цинк – норма 10 – 30 мг/кг; при концентрации более 30 мг/кг – угнетение окислительно-восстановительных процессов.
Марганец – норма до 300 мг/кг; избыток – заболевание костной системы.
Молибден – норма 1,5 – 50 мг/кг; избыток – подагра.
Свинец – избыток – рак почек, желудка, кишечника, воздействует на нервную систему.
Никель – рак полости рта, толстой кишки, врожденные пороки и уродства, рак носа.
Ртуть – психические расстройства, нарушение сенсорных функций и координации, вызывает почечную недостаточность.
Кадмий – является причиной острых и хронических заболеваний, злокачественных образований. Кадмий в сочетании со свинцом вызывает умственную отсталость у детей.
|
|
|
Железо – избыток приводит к артриту, печеночной недостаточности, диабету.
Хром – вызывает рак легких, злокачественные образования в желудочно-кишечном тракте.
Таблица 5 – Естественное содержание некоторых металлов, вызывающих заболевания человека
| Тяжелые металлы | В горных породах, мг/кг | В угле, мг/кг |
| Кадмий | 0,2 | 0,25 |
| Хром | 100 | 60 |
| Кобальт | 25 | 15 |
| Свинец | 12,5 | 5 |
| Ртуть | 0,08 | 0,08 |
| Никель | 75 | 35 |
| Серебро | 0,07 | 0,1 |
| Талий | 0,45 | 0,5 |
| Ванадий | 135 | 40 |
Определение опасных для здоровья химических элементов.
ЛД-50 – летальная доза химического вещества, вызывающая при попадании в организм 50% гибели живой массы, мг/кг живой массы.
Персистентность в материалах – продолжительность биологической активности загрязняющего материал химического вещества, характеризующая степень его устойчивости к процессу разложения.
Предельно допустимая концентрация (ПДК) в материале химического вещества – максимальная массовая загрязняющего сырье материала химического вещества, не вызывающего прямого или косвенного влияния, включая отдельные последствия на окружающую среду и здоровье человека.
Миграция загрязняющего химического вещества – горизонтальное и (или) вертикальное перемещение химического вещества, загрязняющего сырье, материалы и (или) из них в другие объекты окружающей среды и обратно.
|
|
|
Таблица 6 – Предельные нормы показателей по классам опасности химических веществ
| Показатели | Нормы классов опасности | ||
| 1-го | 2-го | 3-го | |
| 1 Токсичность ЛД-50 | до 200 | 200 – 1000 | более 1000 |
| 2 Персистентность в материалах, мес. | более 12 | 6 – 12 | менее 6 |
| 3 ПДК в материалах, мг/кг | менее 0,2 | 0,2 – 0,5 | более 0,5 |
| 4 Миграция химических веществ | мигрируют | слабо мигрируют | не мигрируют |
| 5 Персистентность в окружающую среду, мес. | 3 и более | 1 – 3 | менее 1 |
| 6 Влияние на потребительские качества материала | сильно снижает | умеренно снижает | не снижает |
Главные направления развития анализа
К средствам анализа сырья, строительных материалов относится обычно все, что служит и способствует получению правильной информации о составе материала.
Такие методы исследования, как пробоотбор, подготовка проб, способы разложения сырья требуют совершенствования, т.к. в этих стадиях аналитической подготовки заключены большие возможности повышения точности всего химического анализа. Например, стадия растворения проб позволяет при определенном наборе растворной смеси во многих случаях достичь лучшей селективности уже в самом начале аналитического процесса.
|
|
|
Кроме определения содержания компонентов анализ осуществляет контроль и др. показателей, например, гранулометрического состава, влажности, плотности и т.д.
Основной тенденцией развития анализа на предприятиях промышленности строительных материалов – это применение анализа без перевода их в раствор. В практике массового контроля как применение спектро-фотометрического метода легко поддается полной автоматизации.
Классификация методов анализа
Разнообразие сырьевых ресурсов, сложность их минеральных составляющих как объектов анализа выдвигает требования по применению самых различных способов анализа, включающих процессы идентификации веществ, качественного и количественного анализа состава.
Химический анализ сырья для строительных материалов – относительно новым и перспективным направлением в него входят составной частью значительное количество методов, характерных для геологических объектов, органических веществ, методических минералогических исследований. Исходя из требований технологии, при выполнении химического анализа сырья предпочтителен многокомпонентный анализ, сочетающий химический, физический, физико-химический и биохимические методы анализа.
|
|
|
Создание рациональных схем многокомпонентного анализа с применением комплекса методов основного направления в анализе сырья и строительных материалов.
Методы проведения анализа зависит от конкретных условий, состава сырья материалов и целесообразности сочетания различных методов анализа.
Основная цель методов исследования – получение полной аналитической информации о химическом составе, строении и свойствах веществ, находящихся в смеси с другими веществами или соединениями.
Главные тенденции развития анализа: повышение точности, чувствительности, экспрессности, широкого набора мобильных способов обеспечения экологической безопасности не только сырья материалов, но и самой технологии.
Наибольшая экспрессность анализа может быть достигнута главным образом на основе физического метода анализа состава по возможности без предварительной подготовки проб.
Способы анализа широко используется при изучении различного сырья, в том числе техногенных отходов, часто рассматриваемых с позиции информатики, уточняя его название определением аналитической информатики.
Достоинство этой схемы – это возможность установления ошибок на той или иной стадии анализа, ее влияние на конечный результат, что позволяет также проводить сопоставления различных методов анализа по точности и пригодности для решения конкретной аналитической задачи.
Методы анализа подразделяются на физические, физико-химические, химические и биохимические.
Физические методы анализа:
- термографический
- радиометрический
- ядерно-физический
- изотопный
- рентгено-спектроскопический
- ядерно-магнитнорезонансный
- масспектрометрический
- рефрактометрический
физико-химические методы анализа:
- атомно-абсорбционный
- атомно-эмиссионный
- титриметрический
- гравиметрический
- экстракционнофотометрический
- хемилюминесцентный
- атомно-флуоресцентный
- спектрофотометрический
- потенциометрический
- полярографический
- кондуктометрический
- флуориметрический
- хроматографический
Биохимические методы анализа:
- микробиологический
- ферментохимический
- химикобактериальный
Говоря о классификации методов анализа необходимо иметь ввиду, что подразделение их на физико-химические, химические, биологические, физические – чисто условно. В основе любого метода лежат химические превращения и физические явления. Смысл разделения в относительной оценке соотношении объемов физических явлений и химических реакций.
В основе метода анализа лежат реакции образования малорастворимых в воде или легко растворимых в органических растворах соединений, окислительно-восстановительное взаимодействие, комплексообразование, нейтрализация, процесс электронных переходов, радиоактивность.
Важным методом в структуре контроля спектроскопия, которая открывает большие возможности по быстрому определению наличие химических элементов.
Физико-химические методы анализа
Спектроскопия – раздел, посвященный изучению спектров электромагнитного излучения.
По диапазону длин волн различают следующие типы излучения:
- радиоспектроскопия
- инфракрасная спектроскопия
- спектроскопия видимого излучения
- ультрафиолетовая спектроскопия
- рентгеновская спектроскопия и др.
По типам исследуемых атомных систем:
- атомная спектроскопия
- молекулярная спектроскопия.
В зависимости от источника излучения используемых приборов:
- лазерную
- вакуумную и др.
Спектроскопия является основой спектрометрического анализа.
Схема основных методов анализа
Спектрометрический анализ – это физико-химический метод качественного и количественного определения состава вещества, проводимый по его оптическим спектрам.
Качественный анализ – совокупность методов идентификации элементов, ионов, и веществ. Важнейшие характеристики методов качественного анализа: специфичность, т.е. способность обнаружения искомого элемента в присутствии примеси.
Количественный анализ – совокупность методов определения содержания элементов, ионов, радикалов, функционирующих групп, веществ и фаз в анализируемом объекте. Характеристикой методов количественного анализа помимо специфичности и чувствительности является точность.
Различают атомный и молекулярный спектрометрический анализы. Абсорбционный, т.е. по спектрам поглощения, и эмиссионный, т.е. по спектрам испускания.
В качественном спектрометрическом анализе, полученный спектр интерпретирует с помощью таблиц и атласов, спектров, элементов.
В количественном анализе определенное содержание исследует вещества по относительной или абсолютной интенсивности линий или полос в спектре.
Оптические спектры – это спектры электромагнитных излучений в диапазоне длин волн до 10-3 мкм. Различают спектры:
- испускание, (эмиссионный от источника света)
- поглощение (абсорбционные), получаемые прохождением света через вещество
- рассеивания, отражения.
Спектры возникают при квантовых переходах в атомных системах. По виду спектры могут быть линейными (из отдельных спектральных линий), полосатыми (из спектральных полос, характеризующих некоторый интервал длин волн), сплошные.
Для атомов типичны линейчатые спектры, для молекул – полосатые спектры.
Спектральные линии – линии спектров электромагнитного излучения атомов, молекул и других квантовых систем. Излучение, соответствующее данной спектральной линии, характеризуется определенной длиной волн.
Основные этапы анализа
Флуориметрия.
Люминесцентный метод – метод систематического контроля за состоянием биосферы, техногенных продуктов и др., позволяющий определить микроэлементы, а также суммарное содержание загрязняющих органических веществ и соединений.
Наиболее распространен фотолюминесцентный метод, источником возбуждения в котором служат ртутно-кварцевые лампы.
Различают флуоресцентные, фосфорисцентные, экстракционно-флоуресцентные, хемилюминесцентные и другие методы анализа. Чаще используют флуоресцентный и экстракционно-флуоресцентный методы, основанные на образовании комплексных соединений элементов с органическими реагентами.
В основе флуориметрического метода лежит явление люминесценции – испускание света при переходе молекул из возбуждаемого состояние в невозбуждаемое. Процесс формирования состоит из трех стадий:
1. поглощение энергии
2. преобразование этой энергии веществом
3. высвечивание избыточной энергии.
Зависимость интенсивности излучения, испускаемого раствором флуоресцирующего вещества в нефлуоресцирующем растворителе от его концентрации выражается соотношение:
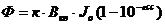
к – фактор пропорциональности
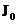 – интенсивность возбуждаемого потока
– интенсивность возбуждаемого потока
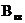 – квантовый выход флуоресценции
– квантовый выход флуоресценции
 - молярный коэффициент светопоглощения
- молярный коэффициент светопоглощения
с – концентрация
l – толщина поглощающего слоя
Выход флуоресцирующего соединения в растворах зависит от длины волны возбуждающего потока, концентрации флуоресцирующих веществ, кислотности и температуры раствора, присутствия некоторых веществ (природных растворителей).
Флуоресценция подчиняется закономерности: спектр излучения и его максимум всегда вдвинуты по сравнению со спектром поглощения и его максимумом в сторону длинных волн.
Влияние концентрации флуоресцирующих веществ в том, что пропорциональность между яркостью свечения раствора и массой флуоресцирующего вещества соблюдается лишь в определенных пределах его содержания.
Влияние кислотности раствора, выражающейся в зависимости интенсивности флуоресценции от рН раствора. Изменения температуры раствора могут привести к уменьшению выхода флуоресценции.
Посторонние вещества влияют на флуоресценцию определяемого компонента. Обычно они вызывают снижение яркости свечения вследствие различия физических и химических явлений.
Следует иметь ввиду, что при флуоресцентном методе правильность результатов находится в прямой зависимости от частоты реагентов, дистиллированной воды и особенно применяемой посуды, на которой возможна сорбция ионов других элементов.
Для измерения интенсивности флуоресценции применяют отечественные флуориметры.
Рентгеновская спектроскопия.
Это спектроскопия рентгеновского излучения. Для получения рентгеновских спектров исследуемое вещество бомбардируют электрон в рентгеновской трубке, либо возбуждают флуоресцирующие исследуемые вещества, облучая его рентгеновским излучением.
Титриметрический метод анализа.
Титриметрический анализ – это совокупность методов количественного химического анализа, заключающийся в измерении объема раствора реактива известной концентрации, расходуемого на реакцию с данным количеством определяемого вещества.
Титриметрический метод осуществляется путем титрования, конечную точку которого находят при помощи химических индикаторов или по резкому изменению какой-либо физической характеристики, исследуемого раствора.
Методы титрования подразделяются на способы нейтрализации, осаждения, комплексонометрии и окислительно-восстановительных процессов.
Редоксметрия – группа методов титриметрического анализа, связанных с применением окислительно-восстановительных реакций.
Комплексонометрия – титриметрический метод химического анализа, основанный на образовании комплексных соединений, например, металлов с комплексонами.
Комплексоны – это аминокарбонатные кислоты и их производные.
В практике химического анализа используют три типа комплексонометрического анализа: прямой, обратный и косвенный.
Содержание основного вещества в анализируемом препарате х% вычисляется по формуле
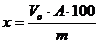
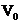 – объем 0,05 молярного раствора комплексона, израсходованного на титрование
– объем 0,05 молярного раствора комплексона, израсходованного на титрование
А – количество основного вещества в анализируемом соединении, соответствующее 1 мл точно 0,05М комплексона III группы.
m – масса навески.
Изменение концентрации определяемого металла в процессе титрования в зависимости от количества прибавляемого титранта представлено в виде кривой титрования. Величина скачка в точке эквивалентности зависит от значения константы нестатности. Чем больше скачок, тем выше точность комплексометрического определения. Для нахождения точки эквивалентности применяют индикаторы – органические соединения, образующие с определенным ионом металла окрашенные комплексные соединения.
Дата добавления: 2018-06-27; просмотров: 335; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
