Единицы измерения топливно-энергетических ресурсов
Условное топливо. Нефтяной эквивалент
Различные виды органического топлива, используемые для энергообеспечения потребителей, при сжигании единицы объема или массы выделяют различное количество теплоты. Количество теплоты, выделяющееся при
полном сгорании 1 кг твердого или жидкого либо 1 м газообразного топлива, называюттеплотой сгорания топлива (теплотворной способностью) топлива. Поскольку один и тот же объем газов при различных температурах и давлениях будет иметь разную массу, то теплота сгорания газов измеряется
в мегаджоулях (либо в гигакалориях) на 1 м газа, взятого при нормальных
условиях* (р = 760 мм рт. ст., t = 0 °С), т.е. на 1 нм . В ряде случаев расчет
теплоты сгорания газового топлива ведется на 1м при других условиях: р = 760 мм рт. ст., t = 20 °С. В этом случае низшая теплота сгорания
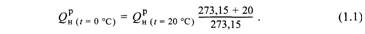
На практике теплота сгорания чаще всего определяется экспериментальным путем. Для топлива известного химического состава ее можно приближенно вычислить по таким формулам, как, например, известная формула Д.И. Менделеева.
Максимальное количество теплоты, которое можно получить в результате химической реакции горения топлива, называютвысшей теплотой сгорания топлива  .
.
*Далее везде объем газа при определении теплоты сгорания приводится к нормальным условиям
Низшая теплота сгорания топливаотличается от высшей на количество теплоты, которое затрачивается на испарение воды, содержащейся в топливе, а также образующейся в результате химической реакции горения топлива.
|
|
|
Поскольку теплота, затраченная на испарение влаги, чаще всего удаляется из энергетических установок в виде паров с дымовыми газами, то она редко полезно применяется на практике. Поэтому в теплотехнических расчетах обычно используется низшая теплота сгорания топлива.
Для сопоставления энергетической ценности различных видов топлива и сравнения суммарного потребления энергоресурсов объектами с различной структурой энергетического баланса введено понятиеусловного топлива.В качестве условного принимается топливо, которое имеет низшую теплоту сгорания 29,33 МДж/кг (7000 ккал/кг). Введение понятия условного топлива позволяет, например, сопоставить энергетические затраты двух различных регионов страны, не уточняя какое количество тех или иных конкретных видов топлива сжигается в этих регионах. Энергетический баланс промышленного предприятия или другого потребителя топливно-энергетических ресурсов (ТЭР), использующего несколько энергоносителей, удобно для анализа также представить в пересчете на условное топливо. Зная теплоту сгорания любого вида топлива, можно определить его эквивалент в условном топливе:
|
|
|

где — массовый эквивалент z-го вида топлива в условном топливе, кг;
— массовый эквивалент z-го вида топлива в условном топливе, кг; — масса, кг, и теплота сгорания, МДж/кг, i-го вида топлива.
— масса, кг, и теплота сгорания, МДж/кг, i-го вида топлива.
Экономию всех видов энергии также удобно представлять в тоннах условного топлива (т у.т.). Различные марки угля, мазута и других видов топлива имеют разную низшую теплоту сгорания. Для оценок можно принять, что 1 т у.т. эквивалентна: 1,2 —1,8 т каменного угля; 1,8 — 3,2 т бурого угля; 0,70 — 0,75 т мазута; 0,8 — 0,9 тыс. м3 природного газа.
Низшая теплота сгорания различных видов топлива и коэффициенты пересчета на условное топливо представлены в табл. 1.2 —1.4.
Другой универсальной мерой потребления топлива и энергии является нефтяной эквивалент. Это понятие чаще встречается в зарубежной литературе. За нефтяной эквивалент принята 1 т топлива с теплотой сгорания 10 000 ккал/кг (41,9 МДж/кг) [5], близкой к теплоте сгорания сырой нефти, которая составляет 10430— 11026 ккал/кг (43,7—46,2 МДж/кг). Выбор численного значения нефтяного эквивалента обусловлен желанием обеспечить удобство в расчетах. При этом 1 т в нефтяном эквиваленте соответствует 1,43 т условного топлива. Зная теплоту сгорания, легко выразить любое количество другого топлива в нефтяном эквиваленте. Например, 1£Ю0 м природного газа с низшей теплотой сгорания 35,2 МДж/м3 эквивалентна 0,84 т в нефтяном эквиваленте.
|
|
|
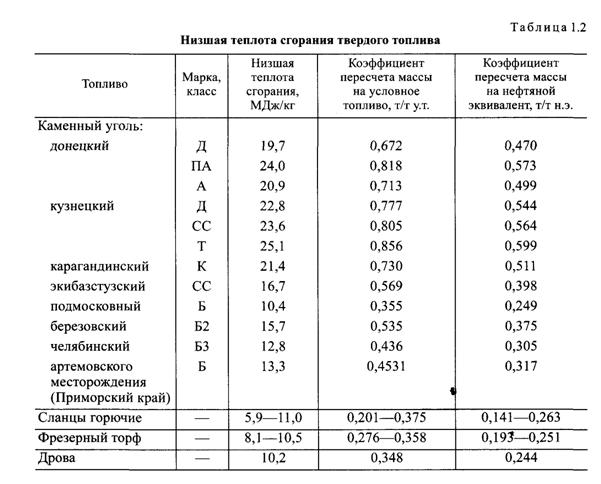 Таблица 1.3
Таблица 1.3
Дата добавления: 2018-06-27; просмотров: 2581; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
