Ориентировочная основа действия (ООД) для проведения самостоятельной работы студентов в учебное время.
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
Кафедра химии
| УТВЕРЖДЕНО на заседании кафедры Протокол №____от « »__________2013_г Заведующий кафедрой _______________ ___________Н.С. Иванова__________ |
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ДЛЯ СТУДЕНТОВ
к лабораторному занятию
Модуль №3 «Поверхностные явления. Адсорбция. Коллоидные растворы. Высокомолекулярные соединения»
учебной дисциплины Химия
для специальности 060101 «Лечебное дело»
курс ____I___семестр _I___
Составитель: к.х.н., доцент Задорожная А.Н.
Рецензент: ст.преподаватель Усова М.Г.
Владивосток, 2013
Тема: «Хроматография. Разделение смеси неорганических и органических веществ с помощью бумажной и тонкослойной хроматографии»
2. Мотивация изучения темы. Адсорбция играет важную роль в жизнедеятельности человека, являясь предварительной стадией многих процессов, обеспечивающих обмен веществ. Поэтому знание закономерностей адсорбционных явлений позволяет раскрыть возможности для решения теоретических и практических проблем в:
- биохимии: хроматографическое разделение БАВ, анализ метаболитов и биохимического анализа и очистки фармпрепаратов;
- фармакологии: осушка и очистка лекарственных препаратов;
- микробиологии: использование адсорбентов для приготовления антигенного диагностикума, в начальном акте фагоцитоза, бактериологии;
|
|
|
- клинических исследованиях: очистка крови и лимфы активированными углями, причина возникновения «кессонной болезни», использование адсорбентов при пищевых отравлениях и т.д.;
- санитарно-гигиенических исследованиях: способов контроля загрязненности и очистки объектов окружающей среды, для определения содержания различных соединений в пищевых продуктах.
Цели занятия.
3.1 Общая цель: изучение темы направлено на формирование компетенций по ФГОС специальности ПК – 2, ПК - 3.
Конкретные цели и задачи.
После изучения темы студент должен:
«Знать»- физико-химические методы анализа в медицине (хроматографический), биологическую, экологическую и медицинскую роль адсорбции, факторы формирования эффективно работающей системы «адсорбент – адсорбтив», правила техники безопасности и работы в физических и химических лабораториях с реактивами и приборами.
«Уметь» - проводить хроматографическое разделение смесей и идентификацию отдельных веществ, на основании экспериментальных данных рассчитывать Rf веществ, пользоваться физическим и химическим оборудованием.
|
|
|
«Владеть» -навыками безопасной работы в химической лаборатории, техникой проведения химических экспериментов.
Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
1. Строение и функции биологических мембран (кафедра биологии, экологии).
5. Задания для самостоятельной подготовки к лабораторному занятию:
5.1. Перечень контрольных вопросов для самоконтроля знаний.
1. Основные понятия. Типы адсорбционных систем.
2. Причина адсорбции: СЭП. Факторы, влияющие на неё.
3. Поверхностное натяжение. ПАВ и ПИАВ. Правило Траубе – Дюкло. Уравнение Гиббса.
4. Факторы, влияющие на адсорбционную способность твёрдых адсорбентов.
5. Уравнения изотерм адсорбции Лэнгмюра, Фрейндлиха, БЭТ; их анализ.
6. Основы адсорбционной терапии.
7. Принципы хроматографического разделения.
8. Классификация хроматографических методов по механизму процесса разделения.
9. Классификация хроматографических методов по агрегатному состоянию подвижной и неподвижной фаз.
10. Способы проведения хроматографического процесса.
11. Использование хроматографии в биологии и медицине.
5.2. Задания для СРС во внеучебное время.
Задача № 1.
|
|
|
Площадь поперечного сечения молекулы этилацетата равна 2,2 · 10-19 м2 . Определите длину молекулы данного вещества (ρ = 0,9 г/см3 ).
Задача № 2.
Найти поверхностный избыток (кмоль/м2) пеларгоновой кислоты 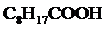 при 100 С для концентрации раствора 50 мг/л. Поверхностное натяжение воды при данной температуре 74,22·10-3 Дж/м2 , а раствора кислоты - 57·10-3 Дж/м2.
при 100 С для концентрации раствора 50 мг/л. Поверхностное натяжение воды при данной температуре 74,22·10-3 Дж/м2 , а раствора кислоты - 57·10-3 Дж/м2.
Задача № 3.
Скорость движения вещества на хроматографической бумаге равна 4 см/час, скорость фронта растворителя – 8 см/час. Чему равен коэффициент Rf исследуемого вещества?
Задача № 4.
Коэффициент Rf исследуемого вещества на хроматограмме равен 0,4. Какую скорость могут иметь растворитель и вещество. Если круговая бумажная хроматограмма не превышает диаметра 20 см?
5.3. Задания для самоконтроля подготовки к лабораторному занятию.
Вариант теста № 1.
В качестве противоядия при отравлениях метанолом применяют этанол. Обоснованием такому применению этанола является:
а) более высокая поверхностная активность этанола по сравнению с метанолом;
б) равенство  qС Н ОН и qСН ОН;
qС Н ОН и qСН ОН;
в) более высокая поверхностная активность метанола по сравнению с этанолом.
Вариант теста № 2.
В системе полярный адсорбент – неполярный растворитель:
|
|
|
а) неполярная часть молекулы ПАВ обращена к поверхности адсорбента, а полярная часть погружена в растворитель;
б) молекулы растворителя выигрывают конкуренцию за активные центры адсорбента;
в) полярная часть молекулы ПАВ обращена к поверхности адсорбента, неполярная часть погружена в растворитель.
Вариант теста № 3.
Эффективность хроматографии зависит:
а) физико-химических свойств подвижной и неподвижной фазы;
б) от сродства разделяемых веществ к фазам и условий хроматографирования (Т, uПФ, tразд);
в) от всех перечисленных факторов.
Вариант теста № 4.
Дана смесь веществ Х(¯), У( ¯), Z ( ), для которых стрелками указано сродство к ПФ () и НФ (¯). Накапливаться на хроматограмме ближе к линии старта будет:
а) х;
б) у;
в)z.
Вариант теста № 5.
Молекулярно-ситовая хроматография основана:
а) на геометрическом соответствии структуры активного центра адсорбента и структуры адсорбтива;
б) на различии в размерах молекул адсорбтива;
в) на различиях в растворимости отдельных компонентов смеси в 2-х несмешивающихся жидкостях.
Вариант теста № 6.
Обнаружение Cu2+ при обработке K4[Fe(CN)6] связано с появлением на хроматограмме:
а) розового пятна Cu2[Fe(CN)6];
б) Cu(CN)6;
в) K2SO4.
6. Этапы проведения лабораторного занятия.
| № | Название этапа | Цель этапа | Время, мин |
| I. Вводная часть занятия | 10 | ||
| 1. | Организация занятия | Проверка присутствующих, их внешнего вида, наличия рабочих тетрадей и лекций | 5 |
| 2. | Определение темы, мотивации, целей, задач занятия | Формирование мотивации данного занятия, значимости его в подготовке врача | 5 |
| II. Основная часть занятия | 160 | ||
| 3. | Контроль исходных знаний, умений и навыков | Выявление исходного уровня знаний, умений и навыков, обеспечение единого уровня | 10 |
| 4. | Общие и индивидуальные задания для СРС в учебное время | Дифференцированное ориентирование студентов к предстоящей работе | 30 |
| 5. | Демонстрация методики | Ознакомление с ООД к самостоятельной работе | 10 |
| 6. | Управляемая СРС в учебное время | Выполнение эксперимента. Овладение профессиональными компетенциями ПК-2, ПК-3 | 60 |
| 7. | Реализация планируемой формы занятия | Контроль результатов обучения и оценка с помощью дескрипторов | 40 |
| 8. | Итоговый контроль | Закрепление приобретённых ЗУН, выявление ошибок и их корректировка | 10 |
| III. Заключительная часть занятия | 10 | ||
| 9 | Подведение итогов занятия | Оценка деятельности студентов, определение достижения цели занятия | 5 |
| 10. | Общие и индивидуальные задания на СРС во внеучебное время | Указание по самоподготовке студентов к занятию «Определение порога коагуляции. Коллоидная защита» | 5 |
Ориентировочная основа действия (ООД) для проведения самостоятельной работы студентов в учебное время.
I группа.«Разделение ионов меди и железа».
Приборы и реактивы: химический стакан 100 мл, две стеклянные палочки, колечки резиновые, хроматографическая бумага, капилляр, пульверизатор, мерный цилиндр на 10 мл, раствор калия гексацианоферрата (II) С = 0,05 моль/л, насыщенный раствор смеси нитрата меди (II) и нитрата железа (III), дистиллированная вода.
Дата добавления: 2018-06-27; просмотров: 243; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
