ВОПРОСЫ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ» Кафедра химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
и задания для выполнения контрольной работы
по дисциплине
ЕН. Ф. 04. 02 органическая ХИМИЯ
Для студентов заочного обучения
направления:
111201 Ветеринария
УФА 2010
УДК
ББК
М
Рекомендовано к изданию
методической комиссией ветеринарного факультета
(протокол № от года)
Составили:
доцент Галеева Р.И.
доцент Ишбердина Р.Р.
Рецензент:
доцент кафедры кормления
животных и физиологии, к.б.н. Клевец Е.И.
Ответственный за выпуск:
заведующий кафедрой химии
доцент Нигматуллин Н. Г.
ВВЕДЕНИЕ
Органическая химия-наука об органических соединениях и законах, которым они подчиняются; она изучает методы получения, строение, превращение и пути практического применения органических соединений.
|
|
|
Органические соединения содержат в своем составе атомы углерода, связанные между собой или с иными элементами периодической системы элементов.
Термины «органическая химия» и «органические соединения» возникли исторически в период исследований соединений, являющихся продуктами жизнедеятельности животных и растительных организмов.
Шведский ученый И. Берцелиус (1779-1848), как и его современники, считал, что органические вещества могут быть получены только в живом организме с помощью «жизненной силы». Поэтому эта ветвь химии и была названа «органическая химия». Это идеалистическое представление об участии «души» или «силы» получило название витализма от латинского vitalis-жизненный.
Но уже при жизни Берцелиуса успехи органической химии наносят сокрушительный удар этим представлениям.
В 1824 году ученик Берцелиуса Велер синтезировал щавелевую кислоту, а в 1828 году мочевину-вещество животного происхождения (из неорганических веществ цианида калия и сульфата аммония).
В 1842 году наш соотечественник Н. Н. Зинин получил анилин, который до этого получили из природного красителя.
Французский ученый Бертло в 1854 году синтезировал вещество, относящееся к классу жиров, а в 1861 году знаменитый русский химик А. М. Бутлеров осуществил синтез одного из сахаров метиленитана. Стало ясно, что органические вещества могут быть получены синтетическим путем.
|
|
|
Новый период развития органической химии начинается с 60-х годов XΙX века, когда А. М. Бутлеровым была создана теория химического строения органических соединений, которая получила дальнейшее развитие.
Многие разделы органической химии развиваются настолько интенсивно, что выросли в самостоятельные разделы химии: биохимия, химия высокомолекулярных соединений, элементорганических соединений, красителей, природных соединений и витаминов.
В настоящее время известно более десяти млн. различных органических соединений. Стройная классификация органических соединений, основанная на теории химического строения, дает возможность легко разобраться в таком большом разнообразии. Органические соединения классифицируются прежде всего по строению углеродной цепи следующим образом:
1. Алициклические соединения (алифатические или соединения жирного ряда), куда относятся соединения с незамкнутой цепью атомов углерода.
2. Карбоциклические соединения характеризуются замкнутой цепью углеродных атомов. Эта группа соединений разделяется на два ряда: а) алициклические соединения. К этой группе относятся все карбоциклические соединения, за исключением бензола и его производных; б) ароматические соединения характеризуются по строению, присутствием бензольного ядра.
|
|
|
3. Гетероциклические соединения. К этой группе относятся вещества циклического строения, но цикл которых состоит не только из атомов углерода, но и из атомов других элементов.
В пределах каждого из трех разделов существуют классы соединений. Например, к ациклическим соединениям относятся:
· Углеводороды
· Галогенопроизводные
· Спирты
· Альдегиды
· Кетоны
· Карбоновые кислоты
· Амины и т.д.
При изучении каждого класса должны быть выделены следующие вопросы: определение и номенклатура каждого класса, особенности строения и функциональная группа, явление изомерии, способы получения, основные физические и химические свойства, важнейшие представители этого класса и применение.
1 АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
1.1. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ)
Изучение предельных углеводородов - начальный этап познавания основного класса органических соединений- углеводородов. Изучению их следует уделить наибольшее внимание. Это вызывается рядом обстоятельств. Поскольку все другие органические вещества могут рассматриваться как производные углеводородов, успехи генетического рассмотрения веществ во многом определяются знанием исходных углеводородов. При изучении углеводородов затрагиваются почти все теоретические вопросы курса, в связи с этим вводится много новых понятий, и от них зависит уровень дальнейшего усвоения предмета.
|
|
|
Прежде всего необходимо иметь ввиду, что углерод в органических соединениях всегда четырехвалентный, что атомы углерода в алканах соединены одной валентной связью, а все остальные валентности насыщены атомами водорода.
Общая формула предельных углеводородов СnH2n+2 . По структуре они отличаются один от другого на единицу СН2 и поэтому образуют гомологический ряд; отдельные члены ряда называются гомологами; группа СН2 – гомологической разницей. Приступая к изучению углеводородов целесообразно повторить сведения о типах химических связей, о строение атома углерода в стационарном состоянии, возбужденном и гибридизованном.
На основе электронных представлений необходимо иметь понятие, почему у атомов углерода сильно выражено свойство соединяться друг с другом.
Пространственное представление о строение углеводородов складываются из понятий о направленности валентных связей, тетраэдрическом направлении химических связей атома углерода, зигзагообразном строении углеродной цепи, различной форме этих цепей вследствие вращения атомов углерода вокруг связей (конформация). Доступнее всего это сделать на примере метана и бутана.
При изучении предельных углеводородов необходимо научиться составлять структурные формулы изомерных веществ. Следует помнить, что явление изомерии является одним из основных положений теории А. М. Бутлерова. Органические соединения, имеющие одинаковый химический состав, но различную структурную формулу, называются изомерами. Следует заметить, что углеродные атомы, составляющие цепь в молекулах углеводородов и их производных, могут быть первичными, когда они соединены с одним атомом углерода, вторичными – с двумя атомами углерода, третичными – с тремя атомами углерода и четвертичные – с четырьмя. Часто в реакциях одни и те же группы атомов переходят в конечные продукты реакции без изменений. Такие группы атомов называются радикалами. Радикалы называются по тем углеводородам, из которых они образованы, но при этом окончание названий углеводородов «ан», меняется на «ил». Например, СН4 – метан, - СН3 – метил, СН3 – СН3 – этан, - СН2 – СН3 – этил и т.д.
При написании изомерных формул данного вещества можно пользоваться простым приемом. Исходя из формул изомеров предшествующего гомолога, заменять в них различные по положению атомы водорода (при первичном, вторичном, третичном атомах углерода) группой СН3.
Например, если требуется написать изомерные углеводороды состава С5Н12, сначала пишут формулы изомерных углеводородов состава С4Н10, которых всего два:

Заменяя различные водородные атомы в формулах изомеров бутана группой СН3, получают:

При названии изомеров возникают трудности. При этом пользуются рациональной и ИЮПАК (Международной) номенклатурами (см. Методические указания по теме «Номенклатура органических соединений»). Напоминаем, что для построения названия соединения по международной номенклатуре (ИЮПАК) следует:
1. Установить самую длинную цепь углеродных атомов в соединении.
2. Пронумеровать углеродные атомы самой длинной цепи. Направление нумерации выбирают так, чтобы цифры, указывающие положение заместителей, были наименьшими.
3. Вначале называют радикалы (начиная с меньшего по числу углеродных атомов). Перед названием радикала ставится цифра, означающая от какого углеродного атома самой длинной цепи ответвляется называемый радикал. Если углеводород содержит несколько одинаковых радикалов, например, две метильные группы, то после двух цифр, обозначающих их места, называют «диметил», при наличии трех метильных- «триметил» и т.д. После названий радикалов называют самую длинную цепь по числу углеродных атомов. Например,

2,2,4- триметилпентан

2,4- диметилгексан
Приступая к изучению химических свойств следует иметь в виду, что предельные углеводороды обладают малой химической активностью (парафины- малоактивные). Для предельных углеводородов характерными реакциями являются реакции замещения (галоидирование, нитрование, сульфирование).
Вопросы для самопроверки.
1. Приведите электронные конфигурации атома углерода в основном и возбужденном состояниях.
2. Какие виды гибридизации возможны для атома углерода? Охарактеризуйте в каждом случае форму и пространственную направленность атомных орбиталей.
3. Дайте определение σ- связям.
4. Какие частицы называются свободными радикалами? Чем они отличаются от ионов? Приведите примеры органических радикалов.
5. Что называется первичным, вторичным, третичным и четвертичным углеродными атомами?
6. В чем различие между гетеролитическими и гомолитическими способами разрыва ковалентных связей?
7. Что такое гомологические ряды и их значение в органической химии?
8. Что такое изомерия? Напишите изомеры гексана и назовите их по ИЮПАК.
9. Какие реакции свойственны предельным углеводородам?
10. В чем заключаются основные положения теории строения органических соединений?
1.2 НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Эти углеводороды, содержащие меньшее число атомов водорода, чем предельные углеводороды, с тем же числом атомов углерода.
1.2.1 ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКЕНЫ)
При изучении этой темы следует уяснить, что допущение существования двойной связи (одна из них σ – связь, другая – π- связь) в алкенах соответствует четырехвалентности углерода и хорошо объясняет присоединение галогенов и других веществ к двум соседним углеродным атомам за счет освобождения валентностей при разрыве p-связи.
Сопоставьте названия предельных и этиленовых углеводородов. При названии этиленовых углеводородов по ИЮПАК номенклатуре в качестве главной выбирают самую длинную углеродную цепь содержащую двойную связь, и нумеруют ее так, чтобы двойная связь получила наименьший порядковый номер. Называют длинную цепочку по количеству углеродных атомов так же, как и в случае предельных углеводородов, но вместо окончания –ан пишут окончания –ен. После окончание –ен пишется цифра, указывающая после какого углеродного атома длинной цепочки расположена двойная связь.


2- метилпентен- 2 3- метилпентен- 1
Для этиленовых углеводородов характерны три вида изомерии:
· Структурная,
· Изомерия положения двойной связи,
· Стереоизомерия (цис-, транс- изомерия)


цис – изомер транс - изомер
Следует запомнить следующие способы получения олефинов: дегидратация спиртов, отщепление галогеноводорода от галогенопроизводных.
При изучении химических свойств этиленовых углеводородов следует писать в тетради реакции:
· Гидрирования;
· Присоединения галогенов;
· Присоединения галогеноводородов и воды (гидратация) по правилу В.В. Марковникова;
· Окисления;
· Полимеризации.
Вопросы для самопроверки.
1. Какие углеводороды называются этиленовыми?
2. Напишите структурные формулы 2-метилбутен-1; 2-метилбутен-2;
3-метилбутен-1. Изомерами какого углеводорода они являются?
3. В чем заключается правило Марковникова? Напишите уравнение реакции взаимодействия пропена с НСl.
4. Особенности окисления алкенов в нейтральной и кислой средах. Напишите уравнение реакции окисления пропена в нейтральной и кислой средах.
5. В чем заключается правило Зайцева? Напишите уравнение реакции взаимодействия спиртовой щелочи с 2-бром-2-метилбутаном.
6. Какие промышленные методы получения полиэтилена вы знаете?
1.2.2 ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Обратите внимание, что в зависимости от взаимного расположения двойных связей относительно друг друга диеновые углеводороды делятся на три типа:
· Кумулированные 
· Изолированные 
· Сопряженные 
Из них большое практическое значение имеют углеводороды с сопряженными двойными связями. При изучении химических свойств обратите внимание, что у них химическая активность проявляется по концам сопряженной двойной связи, что можно объяснить с точки зрения современных электронных представлений. Кроме того, углеводороды с сопряженными двойными связями очень легко полимеризуются с образованием высокомолекулярных углеводородов. Это свойство их используется для получения синтетического каучука. Природный каучук является полимером изопрена. Следует выяснить строение природного каучука, а также синтез каучука по методу Лебедева и из ацетилена.
По международной номенклатуре (ИЮПАК) диеновые углеводороды называются так же, как этиленовые углеводороды, только вместо окончания –ен пишется окончание –диен. Положения двойных связей показывают цифрами.


2-метилбутадиен-1,3(изопрен) пентадиен-1,3(пиперилен)
Вопросы для самопроверки.
1. Какие углеводороды называются диеновыми углеводородами?
2. Напишите формулы изомеров пентадиена и укажите типы связи (кумулированные, сопряженные, изолированные).
3. Напишите уравнения реакций взаимодействия бутадиена-1,3 с хлором, водородом, хлористым водородом.
4. Напишите уравнение полимеризации изопрена. Как используется полученный полимер в народном хозяйстве?
5. Напишите схему синтеза каучука по Лебедеву.
1.2.3 АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ)
Необходимо знать, что к ацетиленовым углеводородам относятся органические соединения, отвечающие общей формуле СnН2n-2 образующие тройную углерод - углеродную связь.
Называют ацетиленовые углеводороды так же, как и этиленовые, но вместо окончания –ен, пишут -ин. После окончания –ин пишется цифра, показывающая место положения тройной связи в длинной цепи углеродных атомов.
Например,


3-метилпентин-1 пентин-2
Уясните электронное строение тройной связи среди трех связей, соединяющих атомы углерода в ацетилене, одна σ-связь и две π-связи.
π-связи располагаются в двух взаимноперпендикулярных плоскостях. При характерной для тройной связи sp-гибридизации орбиталей углеродных атомов электроны оказываются более глубоко втянуты внутрь молекулы и менее реакционно-способными, в то же время большее влияние при соударении с другими молекулами оказывают положительно заряженные ядра.
При рассмотрении химических свойств ацетиленовых углеводородов следует учитывать особенности ацетиленовых связей. Ацетилены, несмотря на большую непредельность, значительно менее активно реагируют с электрофильными реагентами (галогенами), чем этиленовые углеводороды, и в то же время в большей мере чем последние, склонны к реакциям с нуклеофильными реагентами (вода, спирты, амины). Этим же объясняется значительная кислотность ацетиленового водорода.
Из химических свойств обратите внимание на:
· Гидрирование,
· Присоединение галогенов,
· Гидратацию (реакция М. Г. Кучерова),
· Полимеризацию,
· Образование ацетиленидов.
Вопросы для самопроверки.
1. Какие углеводороды называются алкинами?
2. Напишите формулы следующих соединений: 3-метилбутин-1;
3-метилпентин-1.
3. Напишите уравнения реакций присоединения водорода, хлора, хлористого водорода к ацетилену. В каком случае нужно использовать правило Марковникова?
4. Напишите уравнение реакции взаимодействия ацетилена с водой. Как называется эта реакция?
5. Напишите уравнение реакции.
2 АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Ароматические соединения входят в группу карбоциклических соединений, т.е. соединений, в молекулах которых содержится кольцо (цикл), образованное атомами углерода.
Бензол – простейший представитель ароматических углеводородов, его химические особенности – «ароматический характер». При изучении этой темы обратите внимание, что бензол и его производные отличаются по строению и по свойствам от углеводородов с открытой цепью, а поэтому они и выделяются в особую группу под названием «ароматические соединения».
Все электроны, принимающие участие в образовании связей между атомами углерода в бензоле, распределены равномерно или, иными словами, во всех связях С – С в молекуле бензола электронная плотность распределена одинаковым образом.
Радикалы ароматических углеводородов носят общее название а р и л о в по аналогии с названием радикалов предельных углеводородов – алкилов.
Ароматические углеводороды получаются при сухой перегонке каменного угля, переработке каменноугольного дегтя и «ароматизацией нефти». Синтез гомологов бензола можно осуществить реакцией Фриделя-Крафтса, а бензола – из солей ароматических кислот и ацетилена.
Расположение электронных облаков обуславливает специфику так называемой ароматической связи и химических свойств всех атомов углерода бензола. Особенности ароматического кольца, его прочность сообщают ароматическим углеводородам свойства, легче вступать в реакции замещения, а не присоединения. Свойства боковых цепей, являющихся остатками предельных и непредельных углеводородов, приближаются к свойствам жирных углеводородов. Реакции замещения: алкилирование бензольного ядра; замещение атомов водорода галогенами; реакция нитрования и сульфирования.
Уясните себе правила замещения в бензольном ядре. Из других химических свойтсв ароматических углеводородов ряда бензола следует изучить: реакции присоединения, окисления.
Из галогенопроизводных ароматических углеводородов следует изучить строение, синтез, химические свойства и значение хлорбензола, хлористого бензила. Из сульфопроизводных ароматических веществ следует знать строение, получение и химические свойства хлорамидов.
Из нитропроизводных следует знать строение, получение и химические свойства нитробензола.
При изучении соединеий с конденсированными бензольными ядрами обратите внимание на строение, изомерию производных нафталина и его химические свойства;
· Гидрирование,
· Галогенирование,
· Нитрование,
· Сульфирование,
· Окисление.
Из производных нафталина наибольшее значение имеет 1,4-нафтохинон, ядро которого лежит в основе витамина К.
Вопросы для самопроверки
1. Классификация ароматических углеводородов.
2. Напишите формулы изомеров толуола и ксилола.
3. Какие типы реакций характерны для ароматических углеводородов?
4. На какие группы делятся заместители по характеру своего направляюще-
го действия?
5. Напишите уравнения реакций нитрования и бромирования бензола. Что такое гексахлоран, как он получается и где применяется?
2.1 АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ (ЦИКЛОАЛКАНЫ)
Название алициклических соединений возникло в связи с тем, что они содержат циклы и поэтому сходны с ароматическими соединениями, но по своим свойствам близки веществам жирного ряда – алифатическим углеводородам.
По химическим свойствам циклоалканы близки к предельным углеводородам за исключением циклопропана и циклобутана. Подобно ненасыщенным соединениям эти вещества способны присоединять галогены с разрывом кольца. Для объяснения различной устойчивости циклических систем А. Байер (1885 г) предложил теорию напряжения. Теория Байера применима лишь к трех-, четырех-, и пятичленным циклам. Начиная с циклогексана, циклические углеводороды имеют двухплоскостное строение, их валентные углы не отклоняются от тетраэдрического и в них отсутствует байерское напряжение.
Обратите внимание на свойства циклогексана, на его производные и на их применение в сельском хозяйстве.
Вопросы для самопроверки
1. Какие соединения называются циклопарафинами?
2. Укажите природный источник циклопарафинов.
3. Напишите формулы изомеров циклогексана.
4. Почему с циклопропаном и циклобутаном идут легче реакции присоединения, чем реакции замещения?
3 ГАЛОГЕНОПРОИЗВОДНЫЕ АЛИФАТИЧЕСКИХ
УГЛЕВОДОРОДОВ
Галогенопроизводными углеводородов называются такие производные, которые можно получить замещением в молекуле углеводородов одного или нескольких атомов водорода атомами галогенов.
По номенклатуре ИЮПАК галогенопроизводные углеводородов называют, прибавляя в качестве приставки название галогена к названию родоначального углеводорода. Место положения галогенов обозначают цифрами. Нумеруют цепь так, чтобы галоген получил наименьший номер.


2- хлор-3- метилпентен- 1 2- хлор-2- бромпентан
Обратите внимание на способы получения галогенопроизводных углеводородов. Следует учесть:
- непосредственное действие галогена,
- действие галогеноводородов на различные углеводороды.
Следует знать строение, свойства, получение и значение следующих галогенопроизводных алифатических углеводородов, с которыми вам придется встречаться на практике: хлороформ, иодоформ, четыреххлористый углерод, фреон-12, хлорвинил, хлористый этил, дихлорэтан, треххлорэтилен.
Вопросы для самопроверки.
1. Напишите формулы изомеров хлорбутана и назовите их по международной номенклатуре.
2. Напишите формулы изомеров дибромбензола и назовите по международной номенклатуре.
3. Какими способами можно получить хлорэтан? Напишите соответствующие уравнения реакций?
4. Напишите уравнение реакции получения бутана из хлорэтана по реакции Вюрца.
5. Хлороформ, его получение и применение.
6. Напишите схему полимеризации хлоропрена.
7. Напишите схему полимеризации хлорвинила.
8. Что такое тефлон? На чем основано его применение?
4 СПИРТЫ И ФЕНОЛЫ
4.1 СПИРТЫ
При изучении необходимо четко уяснить и запомнить определение, классификацию и номенклатуру спиртов, а также правильно разобраться в изомерии спиртов.
По международной номенклатуре (ИЮПАК) названия спиртов составляют из названий соответствующих углеводородов, прибавляя окончание – ОЛ. После окончания - ОЛ ставят цифру, указывающую положение углеродного атома, при котором находится функциональная группа спиртов – ОН. Нумерация углеродных атомов начинается с того конца, к которому ближе расположена –ОН – группа.

2- метилпентанол- 2
Из способов получения изучите: получение из сложных эфиров, при брожении, из галогенопроизводных, из этиленовых углеводородов гидратацией, из альдегидов и кетонов восстановлением.
Запомните химические свойства, характерные для атома водорода в гидроксиле (образование алкоголятов, простых и сложных эфиров), для гидроксила спирта (образование галогенопроизводного) и для радикала спирта (замещение атома водорода в радикале галогенами). Сравните окисляемость первичных, вторичных и третичных спиртов.
Из отдельных представителей изучите получение и свойства следующих спиртов: метилового, этилового и бутилового спиртов.
При изучении способности двух- и трехатомных спиртов образовывать гликоляты и глицераты обратите внимание на химическую природу хелатов.
Вопросы для самопроверки.
1. Что такое спирты? Укажите, какие бывают спирты в зависимости от количества гидроксильных групп.
2. Напишите пять первых представителей гомологического ряда предельных одноатомных спиртов, назовите их и укажите, с какого представителя начинается изомерия.
3. Приведите примеры первичных, вторичных, третичных спиртов и объясните, чем они отличаются друг от друга.
4. Напишите формулы бутанол- 1, бутанол- 2.
5. Напишите уравнения реакций окисления первичного и вторичного спиртов.
6. Написать уравнение реакции образования эфира из пропанол- 2 и бутанол- 1.
7. Напишите уравнения реакции получения алкоголята, гликолята, глицерата.
8. Напишите уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом.
4.2 ФЕНОЛЫ
При изучении одноатомных фенолов запомните получение фенолов в промышленных условиях. Обратите внимание какие из этих методов применяется в Башкирии.
Изучите химические свойства, характерные для гидроксила фенолов:
- слабокислые свойства,
- образование простых эфиров,
- образование сложных эфиров,
- реакция окрашивания с FeCl3 , а также свойства, характерные для ароматического ряда фенолов; замещение атома водорода в бензольном ядре галогенами, реакция сульфирования, реакция нитрования, реакция ацилирования.
Из отдельных представителей запомните свойства и значение фенола и крезолов.
Изучите строение и свойства двухатомных фенолов и их производных (пирокатехин, резорцин, гидрохинон), трехатомных фенолов (пирогаллол, флороглюцин).
Вопросы для самопроверки.
1. В чем различие в строении и химических свойствах фенолов и ароматических спиртов?
2. Напишите все изомеры двухатомного фенола и уравнение реакции восстановления хинона в гидрохинон.
3. Напишите все изомеры трехатомного фенола.
4. Какие химические реакции свойственны одноатомным фенолам? Какие производные фенола применяются в сельском хозяйстве?
5. В чем выражается взаимное влияние гидроксила и бензольного ядра в молекуле фенола?
5 ОКСОСОЕДИНЕНИЯ
5.1 АЛЬДЕГИДЫ
Следует при изучении альдегидов выяснить электронное строение двойной связи карбонильной группы. Эта связь сильно поляризована благодаря электроотрицательности кислорода. Наличие сильно поляризованной двойной связи в карбонильных группах альдегидов и кетонов является причиной их высокой реакционной способности.
Из способов получения запомните образование альдегидов при окислении спиртов, из дигалогенопроизводных углеводородов и по реакции Кучерова из ацетиленовых углеводородов.
Благодаря высокой реакционной способности альдегиды способны к реакциям присоединения по месту карбонила:
- гидрирование,
- гидратация,
- образование полуацеталей,
- образование циангидридов,
- образование бисульфитных соединений;
Все эти реакции следует изучить: реакции полимеризации и альдольной конденсации; реакции замещения атома кислорода карбонильной группы (на атомы галогенов, на остаток гидроксиламина, на остаток фенилгидразина); реакции окисления (серебряного зеркала, медного зеркала); реакции, обусловленным превращениями в радикале альдегидов. Из отдельных представителей следует знать получение и свойства формальдегида (метаналь), уксусного альдегида (этаналь).
5.2 КЕТОНЫ
Следует изучить реакции получения кетонов из вторичных спиртов, из дигалогенопроизводных и из кальциевых солей карбоновых кислот.
Благодаря наличию сильно поляризованной двойной связи кетоны обладают рядом характерных для карбонильной группы свойств и способны к реакциям присоединения к карбонилу (гидрирование, образование циангидринов, гидросульфитных соединений); к реакциям замещения кислорода карбонильной группы (галогенами, остатком гидроксиламина и фенилгидразина); к реакциям, обусловленным превращением в радикалах кетонов. Эти реакции следует изучить. Из отдельных представителей следует знать способы получения, свойства и значение ацетона и диацетила.
6 КАРБОНОВЫЕ КИСЛОТЫ
6.1 МОНОКАРБОНОВЫЕ КИСЛОТЫ
При изучении этой темы обратите внимание на определение карбоновых кислот как производных углеводородов с функциональной карбоксильной группой

Остаток карбоновой кислоты, получающийся после отнятия гидроксильной группы, носит общее название АЦИЛ. Различают предельные и непредельные карбоновые кислоты.
Изучите эмпирические названия и строение кислот: муравьиная, уксусная, пропионовая, масляная, валериановая, капроновая, пальмитиновая и стеариновая и т.д., а также нескольких изомеров. Следует знать реакции получения предельных одноосновных кислот из альдегидов, и трехгалогенопроизводных углеводородов. Каков механизм диссоциации, если смещение электронной плотности в карбоксильной группе указано стрелками.

Из химических свойств надо знать реакции образования солей (свойство водорода в карбоксильной группе); галогеноангидридов (свойства гидроксила карбонильной группы); ангидридов, сложных эфиров, амидов, а также реакцию образования трихлоруксусной кислоты.
Из отдельных представителей следует знать получение, свойства и значение муравьиной, уксусной кислот и уксусного ангидрида, а из высших жирных кислот – пальмитиновой, стеариновой и церотиновой кислот.
При изучении одноосновных ненасыщенных карбоновых кислот обратите внимание, что изомерия у них зависит не только от строения цепи углеродных атомов, но и от положения двойной связи (на примере винилуксусной, метакриловой и кротоновой кислот). Для них характерна и геометрическая (цис-, транс-) изомерия. Студент должен уметь написать реакцию перехода олеиновой кислоты в элаидиновую. Следует знать реакции образования акриловой кислоты из аллилового спирта и акролеина, кротоновой – из β-оксимасляной кислоты.
Из химических свойств характерными для них являются гидрирование, галогенирование и окисление радикалов кислот. Изучить строение, свойства и значение акриловой, олеиновой, линоленовой кислот.
Вопросы для самопроверки
1. Дайте определение одноосновным предельным карбоновым кислотам.
2. Напишите уравнение диссоциации пропионовой кислоты.
3. Напишите уравнения реакций образования: а) ацетата натрия; б) хлорангидрида уксусной кислоты; в) амида уксусной кислоты.
4. Напишите уравнение реакции образования сложного эфира из пропионовой кислоты и пропанол- 2.
5. Напишите уравнение реакции гидрирования олеиновой кислоты.
6. Напишите уравнение реакции образования сложного эфира из акриловой кислоты и пропанол- 2.
7. Напишите уравнение реакции взаимодействия глицерина с тремя молекулами олеиновой кислоты.
6.2 ДИКАРБОНОВЫЕ КИСЛОТЫ
При изучении этого раздела обратите внимание на эмпирические названия и строение двухосновных предельных карбоновых кислот: щавелевой, малоновой, янтарной, глутаровой и адипиновой. Следует знать, что дикарбоновые кислоты можно получить:
- окислением двухатомных спиртов (гликолей) с первичными спиртовыми гидроксилами;
- омылением нитрилов или цианидов.
Из характерных реакций следует знать декарбоксилирование (выделение из карбоксила СО2) и образование из дикарбоновых кислот внутренних циклических ангидридов. Следует знать строение, свойства и значение щавелевой, малоновой, янтарной и адипиновой кислот.
При изучении двухосновных ненасыщенных карбоновых кислот обратите внимание на способы получения, строение, свойства и значение двух геометрических (цис-, транс-) изомеров этилендикарбоновой кислоты: фумаровой, малеиновой.
Вопросы для самопроверки
1. Напишите уравнение реакции образования ангидрида янтарной кислоты.
2. Напишите уравнения реакций образования кислого и среднего эфира янтарной кислоты и этанола.
3. Напишите уравнение реакции образования малеинового ангидрида.
4. Напишите уравнения реакций образования кислого и среднего эфира фумаровой кислоты и этанола.
6.3 ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ: СЛОЖНЫЕ ЭФИРЫ, ЖИРЫ И МЫЛА
Сложные эфиры – производные кислот, у которых атом водорода в карбоксиле замещен радикалом, по способу получения их часто рассматривают как ангидриды кислот и спирта. Сложные эфиры могут быть образованы органическими и неорганическими кислотами. Изучите реакцию этерификации уксусной кислоты с образованием уксусноэтилового эфира (этилацетата), а также получение сложного эфира из хлорангидридов кислот и спиртов. Из характерных для сложных эфиров химических свойств изучите реакцию омыления (гидролиза). Следует знать, строение, свойства и значение диметилсульфата (алкилирующее средство), тринитрата глицерина, аллинитрита, этилацетата и спермацета.
Жиры (триглицериды) – сложные эфиры, образованные трехатомным спиртом глицерином и высшими жирными кислотами.
Обратите внимание на наиболее часто встречающиеся в составе жиров высшие жирные кислоты: предельные кислоты – пальмитиновая и стеариновая, лауриновая и миристиновая; непредельные кислоты – олеиновая, линолевая и линоленовая. Из критериев физических свойств жиров запомните, что такое температура плавления и от чего она зависит, а также йодное число, являющееся показателем ненасыщенности триглицерида. Из химических свойств изучите реакции омыления едкими щелочами, гидрогенизацию жиров, а также химизм прогоркания жиров. Применение жиров в технике, медицине и ветеринарии.
Мыла – соли высших жирных кислот. В медицине и ветеринарии часто применяется жидкое (калиевое) мыло, называемое медицинским мылом. Важнейшим этапом производства мыла является омыление (гидролиз) жиров едкими щелочами. Изучите реакцию омыления трипальмитина с образованием глицерина и мыла – натриевой соли пальмитиновой кислоты. Что такое свинцовые мыла? Механизм моющего действия мыла.
Вопросы для самопроверки
1. Какие соединения называются: жирами, восками, мылами?
2. Напишите уравнение реакции образования триолеина.
3. Что называется омылением? Мылом?
4. Какие соединения называются амидами и как они получаются?
5. Напишите уравнение реакции получения мочевины различными способами.
7 ОКСИКИСЛОТЫ
Оксикислоты являются соединениями со смешанными функциями, т.к. содержат различные функциональные группы: карбоксильную ( кислотную) и гидроксильную (спиртовую). Их классифицируют с учетом числа карбоксильных и гидрокарбоксильных групп. Следует изучить прежде всего эмпирические названия оксикислот. У оксикислот возможны три вида изомерии:
- изомерия цепи углеродных атомов (структурная);
- изомерия положения спиртовой группы;
- пространственная изомерия (оптическая).
При изучении одноосновных оксикислот следует обратить внимание на получение их при реакциях:
- неполного окисления гликолей;
- замены галогена на гидроксил в молекуле галогензамещенных кислот;
- омыление оксинитрилов.
Для оксикислот характерны химические свойства, обусловленные карбоксильной группой (образование солей и сложных эфиров); спиртовым гидроксилом (окисление, образование простых и сложных эфиров). Следует изучить и химические свойства характерные только для оксикислот; расщепление 2- оксикислот на альдегиды (или кетоны) и муравьиную кислоту; реакции, протекающие с выделением Н2О. При изучении физических свойств вспомните, что такое поляризованный свет и каковы его свойства; каков принцип работы прибора, предназначенного для измерения оптической активности; почему такие кислоты, как молочная, обладают оптической активностью и что такое ассиметрический углеродный атом? Для мысленного представления пространственной изомерии запомните (тетраэдрические) модели ассиметрических молекул молочной кислоты. По каким причинам различают: L(-) –молочная кислота и D(+)- молочная кислота (мясомолочная)? Что такое оптические антиподы и рацемические соединения? Изучите три способа разделения (Л. Пастер) рацематов. Из отдельных представителей надо изучить строение, свойства и значение гликолевой, молочной и β-оксимасляной кислот.
Из двухосновных оксикислот следует знать яблочную, проекционные формулы оптически активных форм, а также строение и свойства виннокаменных кислот, их оптически активных D- и L- изомеров, мезовинной и виноградной кислот.
Из трехосновных оксикислот изучите строение и свойства, а также значение лимонной кислоты.
Чаще пользуются эмпирическими названиями оксокислот. Эти кислоты широко распространены в природе. Их можно получить синтетически при окислении оксикислот. Изучите реакции образования глиокисловой и пировиноградной кислот. Из отдельных представителей изучите строение, свойства и значение глиоксиловой, пировиноградной, ацетоуксусной и α- кетоглутаровой кислот.
Вопросы для самопроверки
1. Какие соединения называются оксикислотами? Как они классифицируются?
2. Напишите формулы всех изомеров оксимасляной кислоты.
3. Напишите уравнения реакций с молочной кислотой, характерные для спиртовой группы.
4. Напишите уравнения реакций с гликолевой кислотой, характерные для карбонильной группы.
5. Напишите формулы всех изомеров оксибензойной кислоты.
6. Напишите уравнения реакций образования сложного эфира из салициловой кислоты и этанола.
7. Напишите уравнения реакций с пировиноградной кислотой, характерные для карбоксильной группы.
8. Напишите уравнения реакций с глиоксиловой кислотой по альдегидной группе.
8 АРОМАТИЧЕСКИЕ КИСЛОТЫ
При изучении одноосновных ароматических кислот обратите внимание на строение бензойной кислоты и ее получение из галогенопроизводных и ароматических углеводородов окислением боковой цепи. Эти кислоты проявляют реакции, характерные для карбоксильной группы (образование солей, сложных эфиров и галогеноангидридов) и бензольного ядра (галогенирование, нитрование, сульфирование). Из отдельных представителей следует знать строение, свойства и значение бензойной кислоты, хлористого бензола, п- аминобензойной кислоты, анестезина и новокаина.
8.1 ФЕНОЛОКИСЛОТЫ И ОКСИКИСЛОТЫ АРОМАТИЧЕСКОГО РЯДА
Наиболее важным представителем фенолкислот является салициловая кислота. Изучите ее синтез методом карбоксилирования фенолята. Для салициловой кислоты характерны химические свойства ароматических кислот и фенолов. Следует знать реакцию образования фенолятосолей. Из отдельных представителей изучите строение, свойства и значение салициловой кислоты и ацетилсалициловой кислоты.
Ароматические оксикислоты- производные ароматических кислот, содержащие гидроксид в боковой цепи. Изучите строение и свойства миндальной кислоты.
9 УГЛЕВОДЫ
9.1 ПРОСТЫЕ УГЛЕВОДЫ (МОНОСАХАРИДЫ)
При изучении особенностей строения моносахаридов на примере глюкозы обратите внимание на доказательства наличия в ее молекуле неразветвленной цепи атомов углерода, альдегидной, спиртовых групп. Следует разграничить представления о строении моносахаридов, выдвинутые с одной стороны Киллиани, Фишером и А.А. Колли, и с другой- А.А Колли, Толленсом и Хеуорсом→гидратная → Циклическая (полуацетальная форма ). Заучите определение, которое дается полуацетальному, или гликозидному гидроксилу. Как выглядят формулы Хеурса?
Моносахариды классифицируют в зависимости от числа атомов углерода в молекулах (пентозы, гексозы) и от наличия альдегидной или кетоновой группы (альдозы и кетозы).
Между числом ассимитрических атомов углерода (n) и числом возможных-стереизомеров (N) существует математическая зависимость N=2n. Поэтому альдогексозы, содержащие 4 ассиметрических атома углерода, могут иметь 16 изомерных форм. Изучите принципы разделения стереоизомеров ( по М.А.Розанову) на Д- и L-ряды (по конфигурации Д- и L-глицеринового альдегида).
Существуют различные циклические таутомерные формы моносахаридов. Различия циклических таутомерных форм моносахаридов зависят от того, что циклы могут быть шестичленными (пиранозными) и пятичленными (фуранозными); цикличесике таутомерные формы отличаются расположением в пространстве полуацетального (гликозидного) гидроксила.

Д- глюкоза Проекционная α- Д- глюкопираноза
формула по Фишеру по Хеорсу
Моносахариды могут быть получены:
- гидролизом полисахаридов;
- альдольной конденсацией (А.М. Бутлерова);
- неполным окислением многоатомных спиртов.

Д- фруктоза Проекционная α- Д- фруктофураноза
формула по Фишеру по Хеуорсу
Из физических свойств изучите сущность явления мутаротации.
При изучении химических свойств обратите внимание на реакции окисления моносахаридов, образования озазонов, сахаратов, простых и сложных эфиров, гликозидов, а также брожение.
Из отдельных представителей моносахаридов следует знать строение, свойства и значение пентоз (L- арабиноза, Д- ксилоза, Д- рибоза, Д- дезоксирибоза) и гексоз (Д- глюкоза, Д- галактоза, Д- фруктоза, Д- манноза). Что такое уроновые кислоты и аминосахара (Д- глюкозамин и Д- галактозамин).
9.2 СЛОЖНЫЕ УГЛЕВОДЫ
Полисахариды- ангидриды моносахаридов делят на две группы: олигосахариды и высшие полисахариды.
Из олигосахаридов интерес представляют дисахариды, которые могут быть разделены на две подгруппы:
- восстановливающие;
- невосстанавливающие.
Из восстанавливающих дисахаридов изучите циклические и альдегидные таутомерные формы мальтозы и лактозы, а из невосстанавливающих дисахаридов- циклические формы сахарозы.
В отличие от невосстанавливающих, дисахариды мальтозного типа строения (восстанавливающие) переходят в альдегидные таутомерные формы и окисляются в щелочной среде при действии слабых окислителей- реакция серебряного зеркала, Троммера и Фелинга. Все дисахариды проявляют спиртовые свойства.
Из высших полисахаридов наибольший интерес представляют крахмал, гликоген, клетчатка и мукополисахариды.
Изучите схему гидролиза крахмала, отметив его промежуточные и конечные продукты распада. Обратите внимание на различие в строении фракций крахмала- амилозы и амилопектина.
Молекулы гликогена построены по тому же принципу, как и молекулы амилопектина (с наличием α- 1,4- и α- 1,6- гликозидных связей). Молекулы клетчатки имеют линейное строение с β- 1,4- гликозидными связями. Изучите реакции образования мононитрата, динитрата и тринитрата в клетчатке.
Вопросы для самопроверки.
1. Какой атом углерода называется ассиметрическим?
2. Что называется рацематом?
3. Напишите карбонильные формулы Д- глюкозы, Д- фруктозы.
4. Что такое L- и Д-, α- и β- формы сахара?
5. Напишите альдегидные и циклические формы глюкозы.
6. Мутаротация. Объясните это явление на примере глюкозы.
7. Что такое гликозидный гидроксил? Какие реакции свойственны саха- рам по этому гидроксилу?
8. Напишите уравнения реакций образования мальтозы и целлобиозы. Чем отличаются формулы этих дисахаридов?
9. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов.
10. Гидролиз крахмала и клетчатки. Какие промежуточные и конечные продукты при этом образуются?
11. Строение гликогена и его биологическая роль.
10 АЗОТИСТЫЕ СОЕДИНЕНИЯ
(Амины жирного и ароматического ряда)
10.1 АМИНОСПИРТЫ
При изучении этой темы уясните разницу между аминами и четвертичными основаниями. Различают не только амины первичные, вторичные и третичные, но и по количеству аминогрупп – моноамины, диамины, триамины и полиамины.
Обычно амины называют по радикалам, которые входят в их молекулы, с прибавлением слова АМИН. По международной номенклатуре называют по общим принципам с указанием цифрой места положения аминогруппы в углеводородном остатке молекулы.

2-аминобутан 1,4-диаминобутен-2
Изучите принцип общего способа получения аминов из галогенопроизводных и аммиака (способ Гофмана). Вспомните реакцию аммиака с водой. Как реагируют амины с водой? Из химических свойств аминов изучите реакции образования кислых и средних солей, реакции с азотистой кислотой. Из отдельных представителей следует знать строение, способы получения и свойства метиламина, триметиламина, путресцина, кадаверина, коламина и холина.
10.2 АРОМАТИЧЕСКИЕ АМИНЫ
Многие ароматические амины носят эмпирические названия. Важнейшим способом получения их является метод Н.Н. Зинина. Изучите эту реакцию. Наличие основных свойств у ароматических аминов, выраженных очень слабо, доказывается реакцией образования солей. Изучите реакции образования солянокислого и сернокислого анилина. Из основных химических свойств надо знать реакции алкилирования и ацилирования, а также реакции образования триброманилина и сульфаниловой кислоты.
Из отдельных представителей следует знать строение, свойства и значение анилина, белого стрептоцида, дифениламина и диметиламина.
Вопросы для самопроверки
1. Классификация аминов. Что такое первичный, вторичный и третичный амин?
2. Напишите уравнения реакций взаимодействия аминов с соляной кислотой.
3. Как реагируют первичные, вторичные и третичные амины с азотистой кислотой?
4. Напишите уравнение реакции получения анилина по методу Н.Н. Зинина.
5. Почему амины обладают основными свойствами?
6. В чем различие химических свойств аминов жирного и ароматического ряда?
7. Какие соединения называются аминоспиртами?
8. Напишите формулу коламина и холина, укажите их биологическую роль.
11 АМИНОКИСЛОТЫ И БЕЛКИ
Аминокислоты классифицируют по количеству карбоксильных и аминных групп (моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые), по характеру углеводородного радикала (аминокислоты алифатического ряда, ароматические и гетероциклические аминокислоты), по месту положения аминогрупп (α-, β- и γ- аминокислоты), а также по наличию серы и гидроксигруппы (гидроксиаминокислоты и аминокислоты, содержащие серу).
Чаще используются эмпирические названия аминокислот. Например, гликокол, аланин, валин, лизин и др.
Для аминокислот характерны три вида изомерии:
- структурная,
- изомерия положения,
- оптическая изомерия (природные аминокислоты, относятся к L- ряду).
Изучите реакцию получения аминокислот действием на галогенокислоты аммиаком.
Следует знать следующие характерные для аминокислот химические реакции:
- образование внутренних солей,
- образование солей,
- взаимодействие с формальдегидом,
- образование сложных эфиров,
- образование ангидридов (дипептидов, трипептидов),
- действие азотистой кислоты.
Аминокислоты диссоцируют в воде как амфотерные соединения и характеризуются определенным значением изоэлектрической точки. Студент должен уметь написать реакции ионизации любой из указанных ниже аминокислот. Из отдельных представителей следует обратить внимание на строение, свойства и значение глицина, аланина, треонина, валина, лейцина, аспарагиновой и глутаминовой кислот, орнитина, аргинина, лизина, цистеина, цистина, метионина, серина, фенилаланина, тирозина, триптофана и гистидина. Следует иметь современное представление о строении белков.
Вопросы для самопроверки
1. Как подразделяются аминокислоты в зависимости от углеродного радикала, количества карбоксильных и аминных групп, входящих в молекулы аминоксилот?
2. Напишите реакции диссоциации аминокислот. Объясните, почему они обладают амфотерными свойствами?
3. Какие соединения называются полипептидами?
4. Строение глутатиона и его биологическая роль.
5. Классификация белков. Какие белки называются простыми, сложными?
6. Назовите основные качественные реакции на белки.
12 ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклические соединения широко распространены в природе и имеют большое биологическое и практическое значение. Многие из них имеют связь с алкалоидами, белками и некоторыми природными красящими веществами.
Изучите определение, классификацию, номенклатуру и свойства гетероциклических соединений, а также отдельных представителей, которые указаны в плане проработки.
В гетероциклических соединениях, в отличие от карбоциклических, кольца состоят не только из углеродных атомов, но и из атомов других элементов: N, O, S и др.
Они классифицируются по общему числу атомов в цикле, по названию гетероатомов и по числу гетероатомов.
Большое практическое значение имеют пяти- и шестичленные соединения, содержащие азот.
Обратите внимание, что некоторые гетероциклические соединения, имеющие в цикле сопряженные двойные связи, как например, фуран, пиррол и тиофен, по своей прочности и некоторым свойствам приближаются к бензолу и обладают ароматическим характером.
Ароматический характер пятичленных гетероциклов с одним гетероатомом обусловлен взаимодействием четырех π- электронов 4- углеродных атомов с двумя свободными р- электронами гетероатома. Изучите строение, способы получения, свойства и значение фурана (его производных – фурфурола и фурацилина), тиофена, пиррола (его производных – пирролина, пирролидина и пирроленина), индола и его производных – триптофана, синего и белого индиго).
Из пятичленных гетероциклов с двумя гетероатомами следует знать строение, способы получения, свойства и значение пирозола и его производных (пирозолин, пиразолидин, антипирин, амидопирин) имидазола и его производных (гистидин, гистамин), тиазола и его производных (норсульфазол, тиазолидин).
Следует знать строение, способы получения, свойства и значение шестичленных гетероциклов с одним гетероатомом (пиридин и его производных (витамин РР), пиперидин, хинолин, изохинолин, акридин) и двумя гетероатомами (пиримидин, урацил, цитозин, тимин, барбитуровая кислота, пиразин, феназин).
Из различных систем конденсированных гетероциклов следует знать строение, способы получения, свойства и значение пурина и его производных – ксатина, кофеина, аденина и гуанина. Студент должен иметь современное представление о структуре и свойствах нуклеиновых кислот РНК и ДНК.
Вопросы для самопроверки.
1. Объясните, что представляют собой гетероциклы, напишите структурные формулы гетероциклов пурина, пиримидина.
2. Напишите структурные формулы гетероциклов, входящих в состав аминокислот.
3. Чем отличается ДНК от РНК?
13 АЛКАЛОИДЫ
В большинстве случаев алкалоиды – это соединения сложного строения, часто содержащие в своих молекулах гетероциклы. Многие алкалоиды – азотистые соединения, обладающие основными свойствами и встречающиеся преимущественно в растениях и значительно реже – в животных организмах (к группе алкалоидов часто относят адреналин – гормон мозгового слоя надпочечников животных).
Название «алкалоиды» происходит от латинских слов «alkali» - щелочь и «oides» - подобный. Многие алкалоиды обладают сильным физиологическим действием: в больших дозах они являются ядами, а в малых – часто применяются в качестве ценных лекарственных веществ, например, стрихнин, атропин, кофеин, морфин и др. Ознакомьтесь с принципом классификации алкалоидов, методами выделения их из растений.
Из общих свойств алкалоидов обратите внимание на образование нерастворимых простых солей (реакции с таннином, пикриновой кислотой), образование двойных (комплексных) солей (реакция с раствором йода в растворе йодистого калия), а также реакции окрашивания.
При изучении представителей алкалоидов обратите внимание на строение, свойства и значение никотина, а также особенности строения, свойства и значение хинина, морфина и кодеина.
ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
После изучения курса органической химии студент выполняет одну контрольную работу. Ответы на вопросы контрольного задания должны соответствовать своему варианту.
В тетрадь переписывается вопрос и затем пишут ответ. Ответ должен быть конкретным. Формулы химических соединений должны быть изображены структурно. Реагирующие вещества и продукты реакции необходимо назвать.
В конце работы необходимо указать литературу, которой пользовались при выполнении работы. Если работа возвращается на доработку, исправление необходимо написать в конце контрольной работы, в той же тетради и отдать для повторной проверки.
Контрольная работа считается зачтеной после собеседования с рецензентом и затем необходимо представить на экзамен. Выполняемый вариант контрольного задания определяется по двум последним цифрам шифра. Например, шифр 2115, студент должен выполнить № 15.
ВОПРОСЫ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
1. Основные положения теории строения органических соединений А.М. Бутлерова. Напишите формулы всех изомеров гексана.
2. Углеводородные радикалы, их номенклатура. Напишите формулы изомеров октана с пятью атомами углерода в главной цепи, обозначьте в них первичные, вторичные, третичные и четвертичные атомы углерода.
3. Превратите бромистый изобутил в предельный углеводород:
а) с тем же строением углеродного скелета,
б) с удвоенным числом углеродных атомов и назовите их по номенклатуре ИЮПАК.
4. Какие соединения получаются при дегидратации следующих спиртов:
а) 3-метилбутанол-1; б) 4-метилпентанол-2; в) 2-метилпентанол-3. Сформулируйте правило Зайцева. Полученные соединения назовите по систематической номенклатуре.
5. Какие соединения получаются при гидрохлорировании следующих веществ: а) 2-метилгексен-2; б) 2-метилпентен-2. Сформулируйте правило Марковникова.
6. Какие соединения получаются в результате следующих превращений:

Назовите промежуточные соединения по ИЮПАК.
7. Напишите схему следующих превращений:

Назовите все соединения по систематической номенклатуре.
8. Из карбида кальция получите 2,2-дибромбутан.
9. На 2,3-диметилбутен-1 подействовали эквимольным количеством НВr, а затем металлическим натрием. Напишите уравнения реакций и назовите полученные соединения по ИЮПАК.
10. На пропин подействуйте следующими веществами:
а) метанолом; б) уксусной кислотой; в) синильной кислотой; г) уксусным альдегидом.
11. Напишите схемы следующих превращений. Какие реагенты нодо использовать?

12. Химические свойства предельных углеводородов. Иллюстрируйте эти свойства на примере соответствующих уравнений реакций пропана.
13. Химические свойства этиленовых углеводородов. Иллюстрируйте эти свойства на примере соответствующих уравнений реакций пропена.
14. Химические свойства ацетиленовых углеводородов. Напишите соответствующие уравнения реакций этина. Какая реакция называется реакцией Кучерова?
15. Химические свойства диеновых углеводородов с сопряженными связями. Напишите характерные реакции для бутадиена-1,3.
16. Химические свойства бензола. На какие группы делятся все заместители по характеру своего направляющего действия? Исходя из бензола, получите:
а) м-бромнитробензол; б) о-и п-бромнитробензол.
17. Спирты, их классификация. Напишите формулы изомеров спирта С4Н9ОН, укажите первичный, вторичный и третичный спирты.
18. В чем отличие первичных и вторичных спиртов по химическим свойствам? Ответ подтвердите соответствующими уравнениями реакций.
19. Напишите формулы промежуточных и конечных веществ в следующей схеме:

Назовите исходные соединения и продукты реакции по ИЮПАК.
20. Из карбида кальция получите:
а) 


Назовите исходные соединения и продукты реакции по ИЮПАК.
21. Предложите схему получения м-бромбензойной кислоты, исходя из ацетилена.
22. Получите орто-хлорнитробензол и мета-хлорнитробензол из бензола.
23. Из карбида кальция получите п-нитробензойную кислоту. Укажите условия протекания промежуточных реакций и назовите все соединения.
24. Напишите структурные формулы промежуточных и конечных продуктов реакций в следующей схеме превращений:

25. Напишите уравнения реакций взаимодействия, 2-бромпентана со следующими веществами: а) магнием; б) цианистым калием; в) водным и спиртовым раствором щелочи.
26. Ароматический углеводород состава С9Н10 легко обесцвечивает раствор брома, присоединяя 1 молекулу Вr2, а при окислении образует бензойную кислоту. Напишите структурную формулу исходного соединения.
27. Химические свойства двухатомных и трехатомных спиртов. Напишите качественную реакцию на многоатомные спирты.
28. Отличие в строение ароматических спиртов и фенолов. Как это отражается на их химических свойствах? Ответ иллюстрируйте соответствующими уравнениями реакций.
29. Тимол-антисептик, применяется при желудочно-кишечных заболеваниях. К какому классу органических соединений он относится? Какие типы химических реакций для него характерны?
30. Опишите все способы получения альдегидов и кетонов. Ответ подтвердите соответствующими уравнениями реакций.
31. Химические свойства альдегидов. Напишите уравнения реакций, характерных для уксусного альдегида:

32. Химические свойства кетонов. Ответ иллюстрируйте уравнениями реакций с ацетоном.
33. Почему у альдегидов и кетонов проявляются сходные химические свойства? Напишите уравнения реакций, которые могут протекать как с альдегидами так и с кетонами.
34. Классификация, номенклатура и способы получения карбоновых кислот.
35. Химические свойства предельных одноосновных карбоновых кислот на примере этановой (уксусной) кислоты. Напишите уравнение реакции образования сложного эфира этановой (уксусной) кислоты и пропанола-2.
36. Какие вещества образуются в приведенной ниже схеме реакций:

37. Получите спирты, исходя из:
а) метаналя и изопропилмагний бромида;
б) этаналя и втор-бутилмагний-бромида
38. Как получить 2-метилбутанол-2 из 2-метилбутанол-1?
39. Используя магнийорганический синтез, получите 2-метилпентанол-3. Проведите реакцию дегидратации, продукт окислите водным раствором КМnO4.
40. Напишите уравнения реакций взаимодействия пропанола-2 с: 1) уксусным альдегидом; 2) хлорангидридом пропионовой кислоты; 3) пятихлористым фосфором.
41. Напишите уравнения реакций, протекающих при взаимодействии:
а) фенолята натрия с хлористым этилом;
б) хлорбензола с изопропилатом натрия.
Назовите полученные соединения.
42. Напишите структурные формулы и назовите двух и трехатомные фенолы. Укажите их применение.
43. Напишите уравнения реакций взаимодействия фенола со щелочью, бромной водой, монохлоруксусной кислоты. Назовите образующиеся соединения.
44. Напишите и назовите продукты реакции в следующей схеме:

45. Какое соединение образуется в результате альдольной конденсации 2-метилпропаналя.
46. Напишите формулы строения промежуточных и конечных соединений в следующей схеме:

47. Из этанола получите бутанон-2.
48. Напишите схемы превращений 1-хлорпентана: в пентаналь, в пентанон-2.
49. Напишите схему превращения бутаналя в бутанон.
50. Какие соединения получаются при действии: а) этанола на пропаналь; б) метанола на этаналь.
51. Напишите реакции гидролиза дигалогенпроизводных:
а) 1,1-дибром-3-метилгексан;
б) 3,3-дихлор-2-метилпентан.
Назовите полученные соединения.
52. Получите бутановую кислоту, исходя из пропанола-1 (двумя способами).
53. Получите уксусноэтиловый эфир, используя в качестве исходного вещества этин (ацетилен).
54. Какая кислота получится при действии двуокиси углерода на изопропилмагнийбромид с последующей обработкой Н2О.
55. Напишите реакции, с помощью которых ацетон можно превратить в 2-метилпропановую кислоту.
56. Предложите схему синтеза м-хлорбензойной кислоты, исходя из ацетилена.
57. Используя только уксусную кислоту и неорганические соединения, получите пропанол-2.
58. На примере 2-метилбутановой кислоты получите: а) ангидрид; б) хлорангидрид; в) амид; г) сложный эфир.
59. Какие соединения называются оксикислотами? Их классификация и номенклатура. Напишите формулу салициловой кислоты и укажите, к каким оксикислотам она относится.
60. Основность оксикислот. Чему равна основность яблочной кислоты? Напишите уравнение реакции образования сложного эфира из яблочной кислоты и пропанола-2.
61. Атомность оксикислот. Чему равна атомность яблочной кислоты? напишите уравнение реакции образования сложного эфира из яблочной кислоты и уксусной кислоты.
62. Химические свойства оксикислот, обусловленные карбоксильной группой. Напишите уравнения реакций, подтверждающие эти свойства для молочной кислоты.
63. Химические свойства оксикислот, обусловленные спиртовой группой. Напишите уравнения реакций, подтверждающие эти свойства для молочной кислоты.
64. Молочная кислота, ее строение, изомерия. Напишите реакции взаимодействия молочной кислоты с: металлом, хлорангидридом уксусной кислоты, пятихлористым фосфором.
65. Особенности протекания реакции при нагревании с выделением воды у a-, b- и g- оксикислот. Напишите уравнения реакций с оксимасляными кислотами.
66. Реакции окисления оксикислот. Напишите уравнения данных реакций с a-, b- оксипропионовой и яблочной кислотами.
67. Изомерия фенолокислот. Напишите уравнения реакции образования простого и сложного эфира из салициловой кислоты и этанола.
68. Альдегидокислоты. На примере глиоксалевой кислоты напишите уравнения реакций, характерные для альдегидной и карбоксильной групп.
69. Кетокислоты. На примере пировиноградной кислоты (кетопропионовой) напишите основные уравнения реакций, характерные для кето- и карбоксильной групп.
70. Напишите уравнения реакций, с помощью которых можно осуществить превращение ацетилена в 2-оксипропановую кислоту.
71. Получите любым способом 2-окси-3,3-диметилбутановую кислоту. Для полученной оксикислоты напишите реакции с НСI и NaOH.
72. Получите из пропановой кислоты молочную кислоту и напишите для последней реакции с уксусным ангидридом и этиловым спиртом.
73. Из пропаналя через продукт альдольной конденсации получите 3-окси-2-метилпентановую кислоту.
74. Напишите структурные формулы промежуточных и конечных продуктов реакций следующей схемы превращений:

75. Химические свойства предельных двухосновных карбоновых кислот на примере щавелевой кислоты. Напишите уравнения реакций образование сложного эфира из щавелевой кислоты и пропанола-2.
76. Изомерия и химические свойства фталевых кислот. Напишите уравнения реакции образования кислого сложного эфира из терефталевой кислоты и пропанола-2.
77. Реакция этерификации. Напишите уравнение реакции образования тристеарина.
78. Жиры, их разновидности и способы получения. Напишите уравнение реакции образования трипальмитина.
79. Воски, их отличие от жиров. Напишите уравнение реакции образования триолеина.
80. Мыла, способы получения. Напишите уравнение реакции омыления трипальмитина щелочью.
81. Масла, их строение и применение. Напишите уравнение реакции гидролиза триолеина.
82. Классификация углеводов. Приведите примеры триоз, пентоз и гексоз. Напишите уравнение реакции серебряного зеркала с глюкозой.
83. Какой вид изомерии называется стереоизомерией и какой углеродный атом асимметрическим? Напишите проекционные формулы стереоизомеров глюкозы D и L- ряда. Отметьте асимметрические атомы углерода.
84. Химические свойства моносахаридов. Напишите соответствующие уравнения реакций с глюкозой.
85. Циклические формулы моносахаридов. Напишите проекционные формулы a-D-фруктофуранозы и b-D-глюкопиранозы.
86. Какой гидроксил называется полуацетальным (гликозидным). В чем его отличие от других гидроксильных групп в моносахаридах? Напишите уравнение реакции образования гликозида из a-D- галактопиранозы и этанола.
87. Как реагируют в присутствии НСI:
а) a-D-глюкофураноза с этанолом;
б) b-D-фруктофураноза с пропанолом-2?
88. Напишите уравнения реакций D-рибозы с:
а) синильной кислотой;
б) гидроксиламином;
в) уксусным ангидридом.
89. Что такое мутаротация? Приведите пример и объясните.
90. Напишите схему перехода в щелочной среде глюкозы во фруктозу.
91. Для глюкозы напишите реакции окисления, восстановления и получения метилглюкозида.
92. Из фруктофуранозы и фосфорной кислоты получите фруктозо-1,6-дифосфат.
93. Напишите реакции метилового спирта (в присутствии катализатора НСI):
а) с мальтозой; б) с целлобиозой; в) с лактозой.
94. Циангидриным синтезом (метод Фишера-Килиани) получите D-галактозу из D-ликсозы.
95. Из D-глюкозы получите D-глюконовую кислоту и сорбит.
96. Определение и классификация дисахаридов. Напишите уравнение реакции образования мальтозы и сахарозы.
97. Восстанавливающий тип дисахаридов. Напишите уравнение реакции серебряного зеркала с лактозой.
98. В чем заключается инверсия сахаров? Что такое инвертный сахар? Напишите уравнение реакции гидролиза сахарозы.
99. Какие продукты образуются при гидролизе клетчатки? Напишите уравнение реакции гидролиза целлобиозы.
100. Гликоген, его строение и свойства. Напишите уравнение реакции гидролиза мальтозы.
101. Амины, определение, классификация и номенклатура. Напишите уравнение реакции взаимодействия метиламина с серной кислотой.
102. Способы получения аминов. Реакции Н.Н. Зинина. Напишите уравнение реакции синтеза анилина (фениламина).
103. Химические свойства первичных аминов. Ответ иллюстрируйте уравнениями реакций для этиламина.
104. Химические свойства вторичных аминов. Ответ иллюстрируйте уравнениями реакций для диметиламина.
105. Химические свойства третичных аминов. Ответ подтвердите соответствующими уравнениями реакций для триметиламина.
106. Анилин, химические свойства. В чем выражается взаимное влияние радикала (фенила) и аминогруппы?
107. Мочевина Химические свойства. Напишите уравнения реакции образования биурета.
108. Аминоспирты, определение, распространение в природе. Напишите формулы этаноламина (коламина) и холина.
109. Классификация аминокислот. К каким аминокислотам относится аланин? Напишите диссоциацию аланина по кислотному и основному типу.
110. Напишите уравнения реакций взаимодействия аланина с NaOH, HCI, CH3OH.
111. Амфотерные свойства аминокислот. Ответ подтвердите реакциями с цистеином.
112. Приведите примеры оксиаминокислот. Напишите уравнения реакций образования сложного эфира из серина и фосфорной кислоты.
113. Какую реакцию будет иметь раствор аспарагиновой кислоты? Напишите диссоциацию указанной кислоты по основному и кислотному типу.
114. Пептиды, пептидная связь. Напишите уравнение реакции образования дипептида из серина и цистеина.
115. Пептиды, их номенклатура. Напишите уравнение реакции образования дипептида из валина и серина.
116. Белки, классификация и состав. Напишите уравнение реакции образования дипептида из фениламина и аланина.
117. Первичная, вторичная и третичная структуры белка. Напишите уравнение реакции образования трипептида из серина, аланина и глицина.
118. Получите из уксусного альдегида аланин по методу Зелинского.
119. Получите a-аминоизомасляную кислоту из ацетона по методу Н.Д. Зелинского.
120. Получите из уксусного альдегида b-аминомасляную кислоту по методу В.М. Родионова.
121. Напишите формулы промежуточных и конечных продуктов в схеме и назовите:

122. Подвергните нагреванию a, b, g-аминомасляные кислоты и назовите продукты реакции.
123. Напишите уравнения реакций действия азотистой кислоты на:
а) глицин; б) аланин; в) серин.
124. Дополните схему следующих превращений:
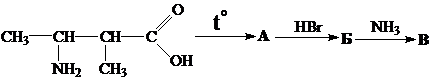
125. Из ацетилена получите аланин.
126. С глицином проведите следующие реакции:
а) с этиловым спиртом; б) с аммиаком; в) с гидроксидом меди.
127. Напишите формулы промежуточных и конечных продуктов в следующей схеме:

128. Напишите формулы и дополните схему следующих превращений:

129. Из ацетилена получите мета-аминобензойную кислоту.
130. Напишите уравнения реакций, с помощью которых из этилена можно получить: а) этиламин; б) пропиламин.
131. Расшифруйте цепь превращений:

132. Напишите формулы промежуточных и конечных продуктов в схеме:

133. Что называется реакцией гидрогенизацией? Напишите схему гидрогенизации триолеата глицерина. Назовите полученный продукт реакции.
134. Напишите схему получения трилиноленоата глицерина.
135. Как можно получить натриевую соль стеариновой кислоты (мыло) из жира?
136. Какие соединения называются лецитинами? Напишите их общую формулу.
137. Какие соединения называются кефалинами? Напишите их общую формулу.
138. Переэтирификация жиров. Какое практическое значение имеет этот процесс?
139. Какие соединения входят в состав нуклеозида цитидина? Напишите формулу цитидина.
140. Какие соединения входят в состав нуклеозида аденозина? Напишите формулу аденозина
141. Какие соединения входят в состав нуклеозида гуаназина? Напишите формулу гуаназина.
142. Какие соединения входят в состав нуклеозида уридина? Напишите формулу уридина.
143. Какие соединения входят в состав аденозинтрифосфата (АТФ)? Напишите формулу АТФ.
144. Какие соединения входят в состав нуклеотида АМФ? Напишите формулу АМФ.
145. Какие соединения входят в состав нуклеотида АДФ? Напишите формулу АДФ.
146. Напишите схему гидролиза гуанозинмонофосфата.
147. Рибонуклеиновая кислота (РНК), строение, виды РНК и их биологическая роль. Напишите нуклеотид, состоящий из урацила, рибозы и фосфорной кислоты.
148. Чем отличаются нуклеотиды от нуклеозидов? Напишите формулу нуклеотида, состоящего из цитозина, дезоксирибозы и фосфорной кислоты.
149. Какие азотистые основания входят в состав ДНК и РНК? Напишите формулу нуклеотида, входящего в состав ДНК.
150. Чем отличаются по составу нуклеотиды ДНК и РНК? Напишите формулу нуклеотида, входящего в состав РНК.
151. Понятие об алкалоидах. Напишите формулы никотина, конина, хинина, анабазина.
152. Напишите схему превращений пятичленных гетероциклов по Юрьеву.
153. Ароматический характер пятичленных гетероциклов. Приведите схему бромирования и сульфирования тиофена. К какому типу замещания относятся эти реакции.
154. Приведите схему иодирования пиррола в щелочной среде. Сравните реакционную способность бензола и пиррола в реакциях электрофильного замещения.
155. Объясните кислотные свойства пиррола. Напишите схему получения a-метилпиррола из пиррола.
156. Напишите уравнение реакции, доказывающей основные свойства пиридина.
157. Напишите схему получения a-аминопиридина (реакция Чичибабина). К какому типу относится данная реакция?
158. Из b-пиколина (b-метилпиридин), получите витамин РР (амид никотиновой кислоты).
159. Ароматичность пиридина. Сравните реакционную способность бензола и пиридина в реакциях электрофильного замещения (нитрования, сульфирования, галоидирование).
160. Пиридин. Нуклеофильное замещение. Приведите примеры реакций.
Таблица вариантов контрольных заданий по органической химии
| Номер варианта | Номера заданий | Номер варианта | Номера заданий |
| 00 21,35,46,59,68,69,80,85,90,160 01 14,30,47,60,68,69,78,86,91,159 02 12,37,48,58,67,70,78,87,92,150 03 28,38,49,57,66,71,77,88,93,103 04 5,27,39,50,56,65,72,89,94,155 05 18,26,40,41,55,64,73,75,95,105 06 7,19,29,42,54,63,82,91,96,106 07 8,20,24,33,43,53,62,73,83,92 08 9,12,32,44,52,61,72,84,98,126 09 10,22,31,45,51,70,71,94,109,127 10 12,29,40,42,58,79,95,82,110,157 11 3,38,39,43,59,69,78,96,111,120 12 4,14,27,38,44,60,77,84,112,121 13 5,26,45,51,67,76,98,113,138,149 14 25,46,52,66,75,86,99,114,123,141 15 7,17,24,35,47,53,65,74,115,124 16 8,18,23,34,48,52,64,73,116,125 17 9,19,22,32,49,54,63,72,117,126 18 10,20,21,31,50,62,71,109,118,127 19 1,11,30,41,55,61,80,110,120,128 20 3,15,30,39,45,57,78,111,129,158 21 4,12,29,38,46,58,69,77,130,154 22 5,13,28,37,47,59,76,107,131,153 23 14,27,48,60,66,75,108,114,132,152 24 7,15,26,35,49,51,74,85,133,151 25 8,16,25,34,52,73,86,116,134,150 26 9,17,24,33,44,65,87,117,135,149 27 10,18,23,31,42,61,71,88,118,148 28 1,19,22,33,54,63,80,119,137,147 29 2, 20,44,56,62,79,90,120,138,145 30 4,15,22,38,44,67,77,91,121,139 31 5,16,21,37,43,66,76,110,122,140 32 6,17,23,36,42,65,93,111,123,144 33 7,18,36,41,59,68,94,112,124,142 34 8,29,34,45,60,69,73,95,113,143 35 9,20,33,46,51,70,96,114,126,144 36 10,14,24,31,47,55,71,97,127,145 37 1,13,25,39,52,62,98,116,128,146 38 2,11,40,49,53,79,99,117,129,147 39 3,12,27,32,54,64,78,118,130,148 40 5,18,37,43,55,76,101,119,120,149 41 6,13,22,42,56,65,102,121,150,159 42 7,14,21,35,41,74,103,122,154,160 43 8,15,34,44,58,63,73,104,141,155 44 9,16,33,47,59,62,105,124,140,157 45 10,17,25,31,45,60,71,106,125,152 46 1,12,26,54,67,80,107,126,130,159 47 2,19,27,38,50,68,79,108,134,153 48 3,11,28,39,52,78,100,128,131,158 49 4,20,40,49,53,70,101,129,135,156 | 50 6,20,36,42,54,65,75,98,130,149 51 7,16,27,35,55,64,74,99,131,148 52 8,17,30,43,56,63,73,100,132,147 53 9,18,29,33,46,57,62,72,133,146 54 10,15,26,31,58,77,102,113,134,145 55 14,21,32,48,59,69,80,114,135,144 56 2,13,22,40,45,68,79,104,115,143 57 3,19,23,37,47,53,70,105,137,142 58 4,12,24,38,49,66,77,106,138,141 59 5,11,39,48,58,76,107,110,118,139 60 7,11,24,35,41,53,74,85,149,151 61 8,12,23,42,54,63,73,86,150,154 62 5,17,24,35,41,54,67,78,89,155 63 10,16,27,31,43,61,71,112,152,160 64 1,15,21,48,57,70,80,113,138,153 65 2,14,39,49,58,79,90,114,137,154 66 3,25,36, 44,59,78,91,115,136,155 67 4,18,40,60,67,77,92,116,132,156 68 5,19,29,37,58,76,93,117,131,154 69 6,20,38, 47,57,66,75,118,140,152 70 8,14,30,47,52,63,73,95,141,159 71 9,29,40,53,62,72,96,110,142,160 72 10,19,28,54,61,71,82,97,111,151 73 1,20,38,55,70,80,83,98,112,152 74 2,12,22,37,43,61,79,84,99,153 75 3,13,36,42,57,62,76,100,114,154 76 4,16,27,35,41,63,77,101,115,155 77 5,17,24,33,59,64,76,102,116,156 78 6,18,25,44,66,71,75,103,117,157 79 7,11,26,31,58,65,74,104,118,158 80 9,12,33,48,51,62,72,85,105,159 81 10,11,29,31,49,61,71,86,106,160 82 1,18,24,50,53,66,80,87,107,140 83 2,17,22,47,64,69,79,88,108,141 84 3,14,23,38,55,70,78,89,101,142 85 4,15,37,45,56,71,77,90,102,143 86 5,20,39,57,70,72,76,91,103,144 87 6,16,34,43,58,73,75,92,104,145 88 7,13,27,42,59,64,74,82,93,146 89 8,19,30,36,41,60,73,83,106,147 90 10,13,30,49,61,71,84,87,95,148 91 1,17,24,31,50,59,80,88,96,149 92 2,16,40,58,69,79,82,89,97,150 93 3,20,28,46,68,78,81,90,98,131 94 4,11,28,47,56,67,77,91,99,132 95 5,18,22,38,45,55,69,92,100,133 96 6,19,29,37,54,65,70,93,101,134 97 7,12,21,35,42,53,64,71,94,135 98 8,14,30,43,52,63,72,95,103,136 99 9,15,23,33,44,51,78,96,104,137 | ||
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Грандберг И. И. Органическая химия. Учебник для студентов сельскохозяйственных и биологических специальных вузов. – М.: Высшая школа, 2001, с. 671.
2. Вайзманов Ф.Л. Основы органической химии. ¾ С.-Петербург, «Химия», 1995, с. 475.
3. Баркан Я.Г. Органическая химия. – М.: Высшая школа, 1973, с. 552.
4. Артеменко А.И. Органическая химия.¾М.: Высшая школа, 1994, с. 559.
5. Райлс А., Смит К., Уорд Р. Основы органической химии. М.: Мир.,1983, с. 262.
6. Швехгеймер Г.А., Кабраков К.И. Органическая химии. – М.: Высшая школа, 1984. – С. 149-167.
Лицензия РБ на издательскую деятельность № 0261 от 10 апреля 1998 г.
Подписано в печать 2010г. Формат 60×84 Бумага типографическая.
Гарнитура Таймс. Усл.печ.л. Усл.изд.л. Тираж экз. Заказ №
Издательство Башкирского государственного аграрного университета.
Типография Башкирского государственного аграрного университета.
Адрес издательства и типографии: 450001. г. Уфа, 50-лет Октября, 54
Дата добавления: 2018-05-13; просмотров: 846; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
