Изотермы адсорбции и поверхностного натяжения растворов ПАВ. Уравнение Шишковского.
Коллоидная химия. Свойства коллоидных систем. Признаки объектов коллоидной химии. Коллоидная химия – наука о поверхностных явлениях и дисперсных системах. Поверхностные системы – это процессы, происходящие на границе раздела фаз в межфазном поверхностном слое и возникающие в результате взаимодействия сопряженных фаз. Дисперсные системы – гетерогенные системы, состоящие из двух и более фаз, одна из которых дисперсная раздроблена, а другая дисперсная среда - непрерывная часть системы. Свойства коллоидных систем: 1) Рассеяние света; 2) Медленная диффузия; 3) Малое осмотическое давление; 4) Коллоидные растворы способны к диализу (с помощью мембраны могут быть определены от примесей); 5) Способность к коагуляции (разрушение); 6) Возможность явления электрофореза (перемещение частиц под действием внешнего электрического поля). Признаки коллоидной системы: - гетерогенность; -дисперсность. 2. Классификация коллоидных систем. 1)d-дисперсность, а) Наносистемы d=1/10 мм б)Высокодисперсные d=10мм/1 мкм в)Грубодисперсные d=1/100 мкм 2) Фракционный состав а) Монодисперсные(один радиус) б)Полидисперсные 3) Кон-я частиц 4)Характер распределения а) Сплошное-континуальное б) Сетка тонких прослоек-биконтинуальное 5)Взаимодействие между частицами дисперсной фазы(по кинетическим фазам) а) свободно-дисперсные(малая V, ж или г дисперсионная среда) б) связно-дисперсные(V большая-биконтинуальные, ТВ.д.ср) 6) Взаимодействие между ч.д.ф и дис.средой а) Лиофильные(хорошо растворяются, самопроизвольно диспергируются, термодинамически устойчива)-р-ры коллоидных ПАВ, р-ры ВМВ б)Лиофобные-обладают избытком энергии, для них х-на коагуляция, получают непроизвольно 7) Агрегатное состояние фаз(смотрите лекцию) 3Получение КС Диспергационные методы. Дисперг методы-Это способы получ лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров. В зав-ти от вида внешн. работы, которая соверш над грубодисперсной системой, подразделяют на:1 мех. диспергир- это мех дробление грубодисперсн сист путем: раздробления, удара, истирания, расщепления. Измельчение частиц до мелких размеров с помощью шаровых мельниц. Шар мельница-это полый цилинр сосуд,заполненный частично шарами того же материала и при медленном вращении шары перекатыв, истирая и дробя материал. Работами Ребиндера устан явл понижения сопротивл тв тел упругим и пластич деформац, а также мех разруш пол влиянием адсорбции ПАВ. ПАВ облегчают дисперг и способств значительному повышении степени дисперсности. Мех дисперг –это оч энергоемкий процесс.2Физ дисперг- дисперг ультразвуком, происходит за счет разрывающих усилий. Они возник в жик или тв теле при прохождении через них ультразвуковых колеб с частотой более 20.000Гц в сек. При прохождении звук волны в сист возникают местные, быстро чередующиеся сжатия и расширения в-ва, котор приводят к его разрушению.Этот метод применим только при дисперг малопрочных в-в (сера, крахмал и тд).3Физ-хим способ-метод пептизации. Измельчен материал или промытый осадок в-ва, получ в рез-те хим реакции осаждения, промыв небольшим кол-вом р-ра пептизатора, образ высокодисперсная сист.Не могут пептизироваться плотные, тяжелые осадки,а наоборот, рыхлые, свежеприготовленные. Фактич пептизация –это не дисперг. Пептизир осадок-это уже диспег материал, доведенный до коллоидн степени измельчения, в котор частицы в рез-те слипания образ крупный агрегат. Пептизация-это наруш связей между слипшимися частицами. Чем слабее эти связи, тем легче происх пептиз. 4Конденсационные методы получения дисперсных систем.Системы с размером частиц -100 нм получают кондесационными методами.В основе конденсационных методов лежит процесс образования дисперсной фазы из веществ, находящихся в молекулярном или ионном состоянии– создание пересыщенного раствора, из которого должна быть получена коллоидная система. Физические методы конденсации: 1) охлаждение паров жидкостей или твердых тел при адиабатическом расширении или смешивании их с большим объемом воздуха; 2) замена на другой растворитель,в котором диспергируемое вещество хуже растворяется. (туман, смог). Замена растворителя приводит к образованию золя в тех случаях, когда к исходному раствору добавляют другую жидкость, которая хорошо смешивается с исходным растворителем, но является плохим растворителем для растворенного вещества.Химические методы конденсации основаны на выполнении различных реакций, в результате которых из пересыщенного раствора осаждается нерастворенное вещество,не только обменные, но и окислительно-восстановительные реакции, гидролиза и т.п.Дисперсные системы можно также получить методом пептизации, который заключается в переводе в коллоидный «раствор» осадков, частицы которых уже имеют коллоидные размеры. 5.Очистка коллоидных систем: диализ, ультрафильтрация. Для очистки коллоидных растворов от примесей используют такие методы, как фильтрация, диализ, электродиализ, ультрафильтрация.Фильтрация (основана на способности коллоидных частиц проходить через поры обычных фильтров.При этом более крупные частицы задерживаются.Элементарный процесс фильтрования может происходить только при условии, что имеет место разность давлений жидкости над перегородкой и под ней. Диализ - удаление с помощью мембран низкомолекулярных соединений из коллоидных растворов и растворов ВМС. При этом используют свойство мембран пропускать молекулы и ионы малого размера и задерживать коллоидные частицы и макромолекулы. Жидкость, подвергаемую диализу, отделяют от чистого растворителя соответствующей мембраной. Малые молекулы и ионы диффундируют через мембрану в растворитель и при его достаточно частой замене почти нацело удаляются из диализуемой жидкости. Проницаемость мембраны для низкомолекулярных веществ обусловливается тем, что малые молекулы и ионы или свободно проходятчерез капилляры, пронизывающие мембраны, или растворяются в веществе мембраны. Электродиализпозволяет в несколько десятков раз увеличить скорость диализа низкомолекулярных электролитов. С этой целью в диализаторе создают постоянное электрическое поле с падением потенциала 20—250 В/см и выше. Ультрафильтрация применяется для очистки систем, содержащих частицы коллоидных размеров (золи, растворы ВМС, взвеси бактерий и вирусов). Суть метода - в продавливании разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. 6. Межмолекулярное взаимодействие. Молекулярные силы (силы Ван-дер-Ваальса).Межмолекулярное взаимодействие может иметь разный характер: 1)Химические связи. Образуются путем перекрывания электронных орбиталей и потому сугубо специфичны. 2)Водородные связи возникают между молекулами, содержащими функциональную группу OH (кислоты, щелочи, вода, спирты). 3) Силы Ван-дер-Ваальса. Молекулярные связи, которые действуют между любыми молекулами. К этим силам относят: а) ориентационные – возникают между полярными молекулами в результате взаимодействия дипольных моментов. Из-за диполь-дипольного взаимодействия молекулы приобретают определенную ориентацию относительно друг друга. б) индукционные – у полярных и неполярных молекул. Диполь-неполярные молекулы возникают в электрическом поле ил под действием поля полярной молекулы. в) дисперсионные силы действуют между всеми молекулами и возникают из-за непрерывного движения электронов в атомах, приводящего к образованию мгновенных диполей. Электрическое поле мгновенного диполя 1-ого атома индуцирует дипольный момент другого атома, что приводит к возникновению сил притяжения. 7. Поверхностное натяжение. Зависимость поверхностного натяжение от различных факторов. Методы измерения поверхностного натяжения. Пов.нат. – работа обратимого изотермич. обр-я ед пов-ти. Факторы: 1) температура: с ув-ем T пов.нат. уменьшается: усиливается тепловое дв-е мол-л, кот.ведет к ослаблению межмол. вз-я => ум-ся внутр.давл => ум-ся пов.нат. 2) природа фазы: чем больше межмол. вз-е внутри фазы, тем больше пов.нат на границе раздела фаз. 3) природа граничащих фаз: чем больше межмол. вз-е между контактирующими фазам, тем меньше пов.нат на границе раздела этих фаз. Если жид. Раств-ся друг в друге, то пов.нат на границу ж1/ж2 приблизит-но равны разности пов.нат взаимно насыщ.жид-й на границе с возд. 4) влияние добавок: 1.ПНАВ; 2.ПИВ (р-ры электролитов, кот. в воде дисс-ют с обр-ем ионов, ионы гидротируются, т.к. Епол/н2о>Eн2о/н2о, поэтому ионы интенсивно втяг-ся вглубь р-ра и әσ/әТ>0. 3.ПАВ(мол-лы с несимметрич.дефильным строением из непол. УВ-рад и пол группы) Методы определения: 1) статч: осн. на изуч. утстойч. равновес. сост, к кот.самопроизв.приз.сист. 1.метод капиллярного поднятия (рис+формула) 2. м.висячей или лежачей капли: осн.на изуч-и формы капель в поле силы тяж. Ведется учет отклон-я их формы от сферич. (рис) 3. м.уравновеш-я пластинки: толщ.d закр.на коромысле весов погруж.в исслед.жид.,кот.хорошо.смач.её пов-ть. σ=F/2d. 2 )полустатич: осн.на изуч.усл,при кот сист.теряет равновесие. 1. метод наиб.давл.в пузырьке газа σ =1/2ΔPmax*r0(рис) 2. метод отрыва кольца σ=F/4πr*K (рис) 3. сталагмометрич: осн.на опред.веса капель,отрыв.под дейст.силы тяж. в момент отрыва капли её вес уравновеш.силами пов.нат, умнож.на её капилляры. Р=2πr0σ/K (рис) 3) днамческие: метод колеблющихся струй: изуч.св-ва поверх.жид.через малые пром-ки врем после их образ-я. С пом-ю эллиптич.отв-я образ.струю в фотрме эллиптич.цил. под д-ем сил пов.нат.,кот стрем.придать ф-му цил и инерц-х сил устан поперечное колебструи. 8. Внутренняя поверхностная энергия.Поверхностная энергия – это избыток энергии в тонком слое вещества у поверхности соприкосновения фаз по сравнению с энергией вещества внутри фазы. Полная поверхностная энергия складыва- ется из работы образования поверхности, т.е. работы, необхо-димой для преодаления сил межмолекулярного взаимодейст-вия при перемещении молекул из объема фазы в поверхностный слой, и теплового эффекта, связанного с этим процессом. В соответствии с термодинамическими зависимостями удельная полная п.э. равна: dU=- T (∂σ/∂T)+σ/ при V=const уравнение Гиббса-Гельмгольца. σ уменьшается линейно с ростом Т. И в линейной области ∂σ/∂T = const, ∂2σ/∂T2=0, дифференциальное уравнение по Т дает: ∂U/∂T=∂σ/∂T-∂σ/∂T-Т(∂2σ/∂T2), ∂U/∂T=0. Таким образом, величина U является температурным инвариантом. Благодаря этому свойству удельная поверхностная энергия – одна из важнейших характеристик межмолекулярных сил в чистых жидкостях. 9. Физическая адсорбция и хемосорбция. Количественные характеристики адсорбции.Адсорбция – процесс самопроизвольного изменения концентрации компонентов системы между поверхностным слоем и объемной фазой. В зависимости от характера сил, действующих между частицами адсорбата и адсорбента, различают физическую и химическую (хемосорбцию). Физическая адсорбция происходит под влиянием сил Ван-дер-Ваальса и по своей природе аналогична процессам конденсации паров адсорбата. Хемосорбция обусловлена перекрыванием электронных орбиталей частиц адсорбата и адсорбента, т.е. вызывается их химическим взаимодействием. Теплота хемосорбции соизмерима с теплотами химических реакций. Хемосорбция необратима, физическая обратима. Физическая малоспецифична, химическая специфична (адсорбция происходит, только если возможна хим. реакция). Физ. адсорбция сопровождается образованием полислоев, химическая монослойна. Количественные характеристики: 1) а- Абсолютная адсорбция. Число моль или грамм адсорбата, приходящиеся на единицу поверхности или массы адсорбента. 2) г – Избыточная (Гиббсова) адсорбция. Избыток адсорбата в поверхностном слое по сравнению с его количеством в таком же объеме фазы, приходящейся на единицу поверхности, или массы адсорбента. 10.Адсорбция паров и газов на однородной поверхности. Изотерма адсорбции Ленгмюра.Основные положения теории Ленгмюра, которая описывает данный вид адсорбции: 1.Адсорбция мономолекулярна 2.Адсорбция локализована 3.Энергетическая однородность пов-ти(все центры адсорбции обладают равной энергией и адсорбированные молекулы не взаимодействуют друг с другом) Ур-е Ленгмюра Г=Г∞bc/1+bc, изотерму рисуем сами. 11ПАВ и ПИВ.Поверхн активность.Прав Дюкло-Траубе.Ур-ие Гиббса.ПИВ-это растворы электролитов,котор в воде диссоц с образованием ионов, ионы в свою очередь гидротир, поэтому ионы интенсивно втягив вглубь р-ра,что получ s>0.ПАВ-орган молек с несимметр дефильным строением сост из неполярного углевод радикала и полярной группы.Правило Д-Т:С увелич длины углеводородного радикалана одну группу СН2 поверх активность растет в гомологич ряду в 3-3,5 раза. =3-3,5.Г бесконечность одинак потому, что опред величина одной группы. Ур-ие Гиббса .
|
|
|
|
|
|
|
|
|
|
|
|
Изотермы адсорбции и поверхностного натяжения растворов ПАВ. Уравнение Шишковского.
)Там три графика если что. Ур-е Шишковского σ=σ0-Вln(1+AC)
13. Представления о неоднородности поверхности. Изотермы Адсорбции Темкина и Фрейндлиха.Причина неоднородности могут иметь разную природу: а)биографическая неоднородность э то первонач выход на поверхность раздела фазразличных кристаллографич. граней, роббер, узлов. б)индуцированная неоднородность – связана с процессом адсорбции из-за электростатич адсорбции из-за электростатич взаимодействия адсорбир частиц,изменения электронной структуры адсорбента из-за изменения концентрации свободных электронов.Для случая неоднородности уравнение изотермы Темкина 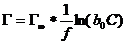 , где f – показатель неоднородности, b0 – коэффициент на наиболее сильно адсорбирующих центрах. Это логарифмическая изотерма. Для случая экспотенциальной неоднородности она описывается Ур-нием Фрейндлиха
, где f – показатель неоднородности, b0 – коэффициент на наиболее сильно адсорбирующих центрах. Это логарифмическая изотерма. Для случая экспотенциальной неоднородности она описывается Ур-нием Фрейндлиха 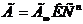 или
или 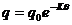
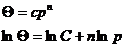
14. Представления о полимолеку-
лярной адсорбции. Изотерма адсорбции БЭТ. Теория Поляни.
Теория Поляни,основные положения:
1. адсорбция обусловлена чисто физическими силами взаимодействия, в адсорбционном пространстве действуют только дисперсионные силы, не зависящие от температуры.
2. вблизи пов-ти адсорбента образуется непрерывное силовое поле.
3. все адсорбированное вещество находится в жидком состоянии.
4. за меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал, т.е. работа по переносу одного моль газа с поверхности жидкого адсорбата в равновесную газовую фазу. Адсорбционный потенциал :
ξ= RTln(P0/P) .
допущение, что практически все адсорбированное вещество находится в жидком состоянии позволяет заменить зависимость адсорбционного потенциала от расстояния на функцию объема жидкого адсорбата. Зависимость ξ как функция R или V называется потенциальной кривой адсорбции или характеристической кривой, поскольку вид кривой не зависит от температуры.
Для количественного описания изотерм различных типов используется теория БЭТ:
1.адсорбция многослойна
2. первый слой адсорбата образуется в результате действия вандерваальсовых сил между адсорбатом и адсорбентом, последующие – конденсации наиболее «холодных» молекул пара, обладающих кинетической энергией, меньшей QL
3. возможно построение последующих слоев при незаконченном первом.
Положения: адсорбция локализована, поверхность энергетически однородна, теплота адсорбции постоянна и равна теплоте конденсации.
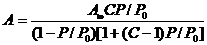 C= К адс./К конд.
C= К адс./К конд.
15. Получение, классификация твердых пористых адсорбентов.
Класс-я: 1). По структуре: а) корпускулярные: стр-ры из сросшихся м/у собой мельчайших частиц, связ-х хим.или физ.силами (корпускулы) синтетические прир. Б) кристаллич-е стр-ры (цеолиты)-молекул.цетали – оллмосиликаты, облад-е строгорегул-й кристаллич. Стр-рой. в) губчатые – массивные тела, пронизанные порами. 2) по полярности: полярные (бумага, стекло,силикагели,оллюмогели), неполярные (угли, сажа,парафины) 3) по размеру пор: П=Vпор/Vадсорбента, макропоры (r=100-200нм, Sуд=0,2-2м2/г), переходнопористые(2-100, 10-500), микропористые(0,5-2, 500-1000)
16. Понятия о капиллярных явлениях. Теория капиллярной конденсации.
Капиллярные явления наблюдаются в содержащих жидкость капиллярных сосудах, у которых расстояние между стенками капилляра соизмеримо с радиусом кривизны поверхности жидкости. Кривизна возникает в результате взаимодействия жидкости со стенками сосудов (адгезия, смачивание). Специфика поведения жидкости зависит от того, смачивает или нет она стенки сосудов. Рассмотрим положение уровня жидкости в двух капиллярах, один из которых имеет лиофильную поверхность(смачивается жидкостью)
,а другой нет. ΔР стремится растянуть жидкость и поднимает ее в капилляре до тех пор, пока капил.давление не уравновесится с гидростатическим давлением столба жидкости.
Теория капиллярной конденсации. Явления капиллярной конденсации состоит в том, что конденсация пара адсорбции в тонких капиллярах происходит при меньших давлениях, чем давление насыщенного пара над ровной поверхностью, при данной температуре в условиях смачиваемости поверхности пор жидким адсорбатом.
Условия действия капиллярных сил:
1. смачивание поверхности адсорбента жидкостью, кот. появляется в результате конденсации пара адсорбатом.
2. наличие пор с удельной поверхностью от 10 до 500 м2/г, что соответствует переходно-пористым адсорбентам(радиус капилляра = радиусу кривизны поверхности)
микропористая структура обеспечи-
вает резкое увеличение адсорбционного потенциала из-за перекрытия поверхностных сил. С увеличением давления газа начинают действовать капиллярные силы. Капиллярная конденсация начинается при определенном заполнении пор адсорбента или при определенном значении пара адсорбата. К этому моменту поверх. энергия практически скомпенсирована в результате полимолекулярной адсорбции, а микропоры заполнены жидким адсорбатом. С увеличением давления газа конденсация происходит и в более крупных порах, радиус мениска жидкости r в которых находится в соответствии с уравнением капил.конденсации Кельвина.
lnP0/P=2σVм/rRT P0/P<<1
при смачивании поверхности конденсация в порах наступает при давлении меньшим, чем Ро.
1.пора конусообразная: конденса-
ция начинается со дна поры, где кривизна наибольшая, по мере заполнения поры радиус увеличи-
вается и давление повышается. Процесс десорбции описывется той же кривой.
2. пора цилиндрическая с открытм концом: конденсация адсорбата идет со дна поры, где кривизна сферическая, т.е.наибольшая. Т.к. пора цилиндрическая она заполняя-
ется при 1-ом значении радиуса мениска, соответствующего опред. давлению Р
3. цилиндрическая пора с 2-мя открытыми концами: конденсация начинается на стенках цилиндра, имеющего кривизну в 2 раза меньшую, чем у сферы того же радиуса. Адсорбция приводит к уменьшению радиуса поры и мгновенному заполнению ее при Рцил., на концах поры образуются мениски, поэтому десорбция начинается при давлении соответствующем большей кривизне сферической, давление открытия поры меньше, чем давление закрытия поры.
17. Основные закономерности адсорбции из растворов неэлектролитов на твердых адсорбентах.Молекулярная адсорбция – адсорбция из растворов неэлектролитов или слабых электролитов. Растворенные вещества адсорбируются на поверхности твердого тела в виде молекул. Особенность: наряду с растворенным веществом адсорбируются молекулы растворителя.
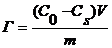 моль/г
моль/г
Адсорбция зависит от:
1) концентрации адсорбента.
Ур-я Ленгмюра, Фрейндлиха и БЭТ.
2) природа растворителя.
а) чем хуже адсорбция растворителя, тем лучше адсорбция растворенного вещества.
б) чем лучше в-во (адсорбат) растворяется, тем хуже адсорбируется из данного растворителя.
3) влияние природы адсорбента.
Подобные адсорбируются на подобном (по полярности).
4) Влияние природы адсорбата.
а) правило Ребиндера: Процесс адсорбции идет в сторону уравнения полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей адсорбента и растворителя. Если адсорбат – ПАВ, то на поверхности образуется слой, ориентированный определенным образом. Неполярный радикал в сторону неполярной фазы, а полярная группа в сторону полярной.
б) правило Дюкло-Траубе: Адсорбция гомологов возрастает при повышении углеводородного радикала.
18. Основные закономерности адсорбции из растворов электролитов на твердых адсорбентах.Твердые адсорбенты-природные или искусственные материалы с большой наружной или внутренней энергией на которой происходит адсорбция газов или р-ров. Их классификация:
1.По структуре
а) Корпускулярные-это структуры из сросшихся между собой мельчайших, связанных физ. Или хим. Силами (корпускулы)
Синтетические:синтез гидрозоля→коагуляция(гель)→сушка,дробление
Природные: уголь, древесина, картон, кожа, зерна, почва, грунты.
б) Кристаллические цеолиты, амосиликаты - обладающие строго регулярной кристалл. Структурой
в)Губчатые – массивные тела пронизанные порами( активированные угли, никель Рэнея)
2. По полярности
-полярные: бумага, силикагель, алюмогель
-неполярные: угли,сажа
3. Пористость(по размеру пор)
П= Vпор/Vадс
Макропоры(r=100/200 нм) Sуд= 0.2/2 м2/г
Переходно-пористые( r=2/100нм) Sуд=10/500 м2/г
Микропористые r=0.5/2 нм) Sуд=500/1000 м2/г
Основные закономерности заключаются в следующем:
-Поверхность твердого тела, в отличие от поверхности жидкости, имеет сложный неоднородный характер. Даже полированное зеркало имеет на пов-ти выступы размерами до 3*10-7см
 -Адсорбция происходит не на всей пов-ти а, лишь на активных центрах
-Адсорбция происходит не на всей пов-ти а, лишь на активных центрах
-Адсорбция кинетически обратима - наряду с адсорбцией газа происходит его десорбция. Адсорбционное равновесие устанавливается очень быстро.
20. Избирательное смачивание. Способы определения краевого угла смачивания. Инверсия смачиваемости поверхности.
при нанесении на пов-ть 2х жид нераств друг в друге, м/у ними обр краевой угол, хар-й относ. спос-ть этих жид.смач-ть данное тело. Для сравнит.оценки смач.пов.сопост-е проводят по ср-ю с водой (с пол.жид-ми) 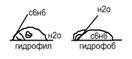
инверсия: закл.в качеств-м измен-и смач-ти пов-ти за счет адс-и ПАВ
Избир-е см-е: добыча нефти, офсетная печать,изгот-е пигментов для масл.красок, флотация (обогащение руд, цв.Ме)
21. Молекулярно-кинитические свойства дисперсных систем: броуновское движение, диффузия.Броуновское движение проявляется в хаотическом движении частиц дисперсной фазы под действием ударов молекул растворителя, находящихся в состоянии интенсивного молекулярно-теплового движения. Смещением или сдвигом частицы называется расстояние между проекциями начальной и конечной точек траектории на оси смещения. Диффузия – это процесс самопроизвольного выравнивания концентрац. В сис-ме, приводящий к установлению равенства хим. Потенциала во всех точках системы. Движущая сила - броуновское движение.Количеств хар-ка диффузии-диффузион поток-это колво моль вещества,переносимого диффузиейза ед времени через ед площади пов-ти, перпенд располож к поверхности. 1 закон Фика 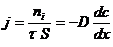 [D]=м2\с
[D]=м2\с 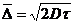
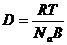 ,
, 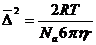
Дата добавления: 2018-05-12; просмотров: 585; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
