Соотношения между спектрами люминесценции и поглощения
Лекция 7. Люминесцентные методы анализа
Общая характеристика методов
Люминесцентный анализ — совокупность оптических методов анализа, основанных на явлении люминесценции.
Люминесценция — свечение вещества, возникающее при его возбуждении различными источниками энергии.
Люминесцентные методы анализа относятся к эмиссионным.Но, в отличие от ранее рассмотренной высокотемпературной атомной эмиссии, люминесценция — процесс неравновесный.Возбуждение здесь имеет нетермическую природу, а частицы в основном и возбужденном состоянии не находятся между собой в термодинамическом равновесии. Доля излучающих возбужденных частип на много порядков превосходит равновесную; поэтому люминесцентные методы характеризуются очень высокой чувствительностью.
С практической точки зрения люминесценция отличается от равновесной эмиссии тем, что протекает, как правило, при низких температурах("холодное свечение"), а также повышенной длительностью свечения (от 10~8 с до нескольких часов). Процессы люминесценции сложны и многообразны. Классификацию люминесцентных методов можно провести по нескольким независимым позициям:
1) природа излучающих частиц: атомная, молекулярная, твердотельная (рекомбина-ционная) люминесценция;
2) природа процесса люминесценции: флуоресценция, замедленная флуоресценция, фосфоресценция;
3) источник энергии для возбуждения: фотолюминесценция (излучение оптического диапазона), хемилюминесценция (химические реакции), катодолюминесценция (пучок электронов) и т.д.
|
|
|
Мы ограничимся рассмотрением лишь наиболее распространенного в химическом анализе способа возбуждения люминесценции — фотолюминесценции.Перевод частиц в возбужденное состояние при этом осуществляется за счет поглощения света от внешнего источника. В таком варианте люминесцентный метод, являясь по своей сути эмиссионным, в то же время обладает и многими особенностями, характерными для абсорбционных методов - с точки зрения как физической сущности процессов, так и аппаратурной реализации.
Сущность явления люминесценции
Люминесценция молекул.
Нормальная (быстрая) флуоресценция.При поглощении кванта света подходящей энергии молекула переходит в одно из возбужденных электронных состояний; при этом может измениться также колебательная составляющая энергии (рис. 15, процессы 1,3). Избыток колебательной энергии быстро теряется без излучения вследствие соударений частиц (колебательная релаксация; рис. 15, процессы 2,4).
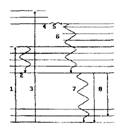

Рис.15. Схема процесса нормальной (быстрой) молекулярной флуоресценции. Прямыми стрелками обозначены излучателъные (погло-щательные) переходы, волнистыми — безызлу-чательные
|
|
|
Рис.16. Схема процессов молекулярной флуоресценции и замедленной флуоресценции
Энергии возбужденных электронных состояний молекулы обычно близки, поэтому нижний колебательный уровень верхнего электронного состояния почти совпадает по энергии с каким-либо колебательным уровнем более низкого возбужденного состояния. В этом случае происходит внутренняя конверсия— переход молекулы в более низкое по энергии электронное состояние без изменения полной энергии (рис. 15, процесс 5). В результате последующей колебательной релаксации (процесс б) молекула опять-таки оказывается на нижнем колебательном уровне самого первого возбужденного состояния.
В этом состоянии молекула обладает избытком электронной энергии, который она может отдать двумя способами. Один из них — это безызлучательная релаксация (процесс 7), частным случаем которой служит рассмотренная выше колебательная релаксация. Однако колебательная релаксация — без изменения электронного состояния — всегда происходит очень быстро, а релаксация с изменением электронного состояния может быть кинетически затруднена. В этом случае большую роль начинает играть другой процесс, люминесценция,т.е. излучательныйпереход в основное состояние (процесс 8). При этом также может измениться колебательная составляющая энергии.
|
|
|
Соотношение вероятностей люминесценции и безызлучательной релаксации характеризует квантовый выходлюминесценции, равный отношению числа испущенных квантов света к числу поглощенных:
фэн = Nлюм/Nпогл (5.2.1)
Для подавляющего большинства молекул эта величина ничтожно мала. Такие вещества можно считать практически не люминесцирующими. Люминесцирующим обычно считается вещество, для которого фкв>0.01. Круг таких веществ весьма ограничен.
Помимо квантового, используется также энергетическийвыход люминесценции, равный отношению полных энергий(или интенсивноетей) испускаемого и поглощаемого световых потоков:
фэн = Nлюм/Nпогл = Iлюм/Iпогл (5.2.1)
Соотношение между фю и фэн обсуждается в следующем разделе.
Рассмотренный процесс молекулярной люминесценции называется нормальной (быстрой) флуоресценцией.Она характеризуется достаточно малой длительностью свечения (-10~8 с). Для спектра быстрой флуоресценции справедливо правило зеркальной симметрии (разд. 5.4).
|
|
|
Фосфоресценция и замедленная флуоресценция.В молекулах может осуществляться и более сложная схема электронных переходов, также приводящая к люминесценции. Для молекул, основное состояние которых синглетное (без неспаренных электронов), возможны как синглетные S, так и триплетные Т (с двумя неспаренными электронами) возбужденные состояния. Прямые переходы с изменением спина S—>Т и Т—*S запрещены квантовомеханическими правилами отбора (крайне маловероятны). Однако вероятность таких переходов возрастает с уменьшением разности энергий между состояниями.
Молекула, способная к люминесценции, может обладать строением электронных, уровней, подобным изображенному иа рис. 16 -— между основным So и низшим возбужденным синглетным Si состояниями может находиться триплетный уровень Т. В этом случае после возбуждения 1 и колебательной релаксации 2 молекула оказывается, как и в рассмотренном ранее случае, на нижнем колебательном уровне возбужденного синглетного состояния Si. Наряду с уже известными процессами безызлучательной релаксации 3 и быстрой флуоресценции 4 здесь появляется возможность возврата в основное состояние So через триплетный уровень Т. Переход из Si в Т становится возможным в результате внутренней конверсии5 (снятие запрета ввиду близости энергий!), называемой в этом случае интеркомбинационной.После колебательной релаксации 6 молекула оказывается на нижнем колебательном уровне триплетного состояния.
Переход Т—>So снова может осуществляться как безызлучательный (7) либо излучательный (8). Излучательный переход 8 происходит весьма медленно, так как вероятность его мала. Он называется фосфоресценцией.От быстрой флуоресценции фосфоресценция отличается как длительностью(10~3 с и более), так и спектральным составом:по сравнению со спектром флуоресценции спектр фосфоресценции смещен в сторону меньших энергий(больших длин волн).
Еще одна возможность возврата из состояния Т в основное состояние So — через уровень Si. Под действием тепловой энергии молекула может перейти на верхний колебательный уровень триплетного состояния Т, а затем — опять вследствие конверсии — на уровень Si(nponeccbi, обратные процессам 6 и 5 рис. 16). В дальнейшем может произойти флуоресценция 4. Такая флуоресценция называется замедленной. От быстрой флуоресценции она отличается только повышенной длительностью свечения (1 0-5-1 О-4 с). По спектральному составу быстрая и замедленная флуоресценция идентичны.
Люминесценция атомов. Ее можно наблюдать только в условиях существования свободных атомов, т.е. в газовой фазе при высоких температурах. Спектры люминесценции атомов, как и любые атомные оптические спектры, имеют линейчатый характер. Поскольку в свободных атомах отсутствует колебательная составляющая энергии, внутренняя конверсия невозможна; поэтому при люминесценции атомов наблюдаются и переходы из высших возбужденных состояний. Обычно в спектрах атомной люминесценции наблюдаются только главная (резонансная) серия линий (с. 22), т.е. эти спектры значительно проще атомно-эмиссионных. Примером атомной люминесценции служит излучение ламп с полым катодом, применяемых в качестве источников света в атомно-абсорбционном методе (разд. 3.4). Возбуждение атомов здесь осуществляется под действием тлеющего электрического разряда. По характеру свечения люминесценция атомов представляет собой флуоресценцию; процессы фосфоресценции при столь высоких температурах невозможны (с. 33).
Люминесценция твердых тел. В твердых телах вместо дискретных энергетических уровней существуют непрерывные энергетические зоны, принадлежащие всему кристаллу в целом. Нижняя по энергии зона называется валентной, верхняя — зоной проводимости.
Если эти зоны перекрываются, тело является проводником. Взаимодействие электромагнитного излучения с проводниками не сопровождается никакими оптическими эффектами, кроме отражения и рассеяния света.
Если между валентной зоной и зоной проводимости существует энергетический зазор — запрещенная зона — то тело является диэлектриком либо — при малой ширине запрещенной зоны (до 5 эВ) — полупроводником. При взаимодействии излучения с такими телами могут наблюдаться явления, аналогичные рассмотренным выше различным видам люминесценции молекул. Отличие состоит в том, что в твердых телах электрон, оказавшись в зоне проводимости, может свободно перемещаться по ней. Соответственно и вакансия ("дырка"), образовавшаяся в валентной зоне вследствие ухода из нее электрона, тоже может по ней перемещаться. Таким образом, важнейшая особенность люминесценции твердых тел состоит в том, что поглощают излучение одни частицы, а испускают — другие (рис. 17, а). При этом излучательный переход можно трактовать как рекомбинацию (воссоединение) электрона и "дырки". Поэтому твердотельную люминесценцию обычно называют рекомбинационнон.
Рис.17. Примеры процессов, происходящих при люминесценции твердых тел.
а — межзонная люминесценция
6, в — люминесценция на центрах свечения
г — люминесценция изолированного цент 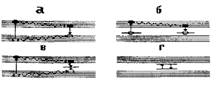 ра свечения
ра свечения
Процесс, изображенный на рис. 11, а я связанный с переходами непосредственно между валентной зоной и зоной проводимости, наблюдается редко из-за большой вероятности безызлучательной релаксации. Гораздо большее значение в аналитической химии имеют другие виды люминесценции твердых тел, связанные с наличием всевозможных дефектов кристаллической структуры — например, за счет примесных атомов. Наличие таких дефектов приводит к усложнению энергетической структуры твердого тела, возникновению дополнительных энергетических уровней, локализованных в том числе и в запрещенной зоне. В этом случае возможными становятся разнообразные процессы, примеры которых приведены на рис. 17,6 и в. Некоторые из таких переходов являются разрешенными, другие — запрещенными; в этих случаях возникает, соответственно, флуоресценция либо фосфоресценция. В некоторых ситуациях, например, при наличии в пределах запрещенной зоны двух или более энергетических уровней одного и того же центра свечения может осуществляться процесс, показанный на рис. 17, г. Он представляет собой точную аналогию молекулярной люминесценции, поскольку при этом поглощение и излучение происходит на одном и том же центре.
Соотношения между спектрами люминесценции и поглощения
Правило Стокса-Ломмеля. Большинство элементарных актов фотолюминесценции связано с потерей части световой энергии вследствие колебательной релаксации. Поэтому средняя энергия испускаемого кванта ниже, чем поглощаемого:
Елкш^Епогл (5<3.1)
Соотношение (5.3.1) означает, что спектр люминесценции в целом, а также его максимум смещены относительно спектра (максимума) поглощения в сторону меньших энергий (больших длин волн). Это положение называется правилом Стокса-Ломмеля. Оно справедливо для всех видов молекулярной и рекомбинапиопной люминесценции — как флуоресценции, так и фосфоресценции. При этом спектр фосфоресценции смещается в более длинноволновую область, чем спектр флуоресценции (с. 50).'
Из правила Стокса-Ломмеля следует, что энергетический выход люминесценции меньше, 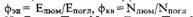 чем квантовый. Действительно, по определению,
чем квантовый. Действительно, по определению,
 (5.3.2)
(5.3.2)
Вывод (5.3.1) о соотношении энергий поглощенного и излученного кванта справедлив лишь для их средних энергий. Для элементарных актов может иметь место и обратное соотношение ЕЛк>м>ЕПОгл. Это возможно при поглощении кванта света частицей, обладающей запасом колебательной энергии. Процесс с Елк>м<Епогл называется стоксо-вым, с Елюм>Е„огл - антистоксовым (рис. 18). Вероятность антистоксовых процессов, очевидно, меньше, чем стоксовых, поскольку заселенность высших колебательных уровней меньше, чем основного.
Правило зеркальной симметрии. Оно было сформулировано В.Л.Левшиным и гласит следующее:
спектры флуоресценции и поглощения одного и того же вещества, нормированные к их максимумам1', зеркально симметричны относительно вертикали, проходящей через точку их пересечения (рис. 19,а).
Пояснение правила зеркальной симметрии дает рис. 19,6. Как видно из него, если в основном и возбужденном электронном 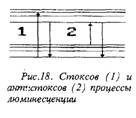 состояниях структура колебательных уровней примерно одина-
состояниях структура колебательных уровней примерно одина-
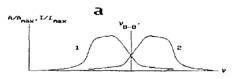

Рис.19. Правило зеркальной симметрии (а) и его иллюстрация (б). 1 - спектр люминесценции, 2 - спектр поглощения
кова (как правило, это так), то каждому абсорбционному переходу с энергией Ео-о' + АЕхол соответствует эмиссионный переход с энергией Есм>—ДЕК0Л. Таким обра-
зом, энергии абсорбционных и эмиссионных переходов "зеркально симметричны" относительно величины Ео-о— энергии чисто электронного перехода.
Приведенные рассуждения показывают, чтодля проверки правила зеркальной симметрии по спектральной оси абсцисс следует откладывать энергию квантов или пропорциональную ей величину (частоту, волновое число), но не длину волны, которая обратно пропорциональна энергии. Детальное квантовомеханическое рассмотрение правила зеркальной симметрии, проведенное Д.И.Блохинцевым, показало, что оно соблюдается более строго, если для построения нормированных спектров использовать не величины I и А, а, соответственно, I/v4 и A/v. Точка пересечения нормированных спектров, построенных в этих координатах, позволяет весьма точно определить частоту
Vo-0'.
Правило зеркальной симметрии справедливо только для молекулярной флуоресценции(нормальной и замедленной). Для фосфоресценции, а также большинства видов реком-бинационной люминесценции оно не соблюдается.
Дата добавления: 2018-05-12; просмотров: 1637; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
