Определение общей жесткости котловой воды
Метод основан на свойстве трилона Б с содержащимися в воде солями кальция и магния окрашенные комплексные соединения.
Окончание реакции определяют по изменению окраски раствора от розовой до синевато-сиреневой в присутствии индикатора хромтемносинего.
Проведение испытания
В колбу наливают 50 мл испытуемой воды, вводят туда 5 мл аммиачно-буферного раствора, щепотку индикатора хромтемносинего и интенсивно перемешивая, медленно титруют пробу трилоном Б до изменения розовой окраски раствора в синевато-сиреневую.
Общая жесткость, выраженная в мг-экв/дм3, численно равна количеству мл 0,01 н раствора трилона Б, пошедшего на титрование 100 мл испытуемой пробы, умноженному на 0,1.
Формула расчета жесткости:

где а – количество трилона Б, пошедшего на титрование, мл;
н – нормальность трилона Б;
V – объем пробы взятый для анализа, мл.
Для облегчения расчета можно пользоваться таблицей 5.3.
Таблица 5.3 - Расчет жесткости по объему трилона Б,
пошедшего на титрование
| Нормальность трилона Б | Общая жесткость, при объеме пробы, взятой на анализ | ||
| 25 мл | 50 мл | 100 мл | |
| 0,01 | 0,4 а | 0,2 а | 0,1 а |
| 0,05 | 2 а | 1 а | 0,5 а |
| 0,1 | 4 а | 2 а | 1 а |
Определение содержания хлоридов в котловой воде
Реактивы: азотнокислое серебро 0,028н раствор;
хромовокислый калий 10% раствор;
фенолфталеин 1% раствор;
серная кислота 0,1 н раствор.
|
|
|
Из отобранной пробы котловой воды берут 10 мл воды в колбу, добавляют 40 мл дистиллированной воды. Разбавленную пробу нейтрализуют: сначала прибавить в пробу 2 – 3 капли фенолфталеина, проба окрашивается в малиновый цвет, затем по каплям титруют 0,1 н раствором серной кислоты до обесцвечивания. Затем добавляют 10 капель хромовокислого калия, проба окрашивается в желтый цвет и из бюретки приливают по каплям раствор азотнокислого серебра, до тех пор, пока в воде не появится устойчивый бурый оттенок.
Содержание хлоридов в воде равно:
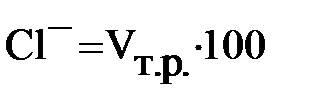
Определение щелочности котловой воды
Метод основан на способности кислоты нейтрализовать содержащуюся щелочь, которая в присутствии фенолфталеина окрашивает раствор в малиново-красный цвет. Окончание реакции определяют по исчезновению окраски при титровании серной кислотой.
Проведение испытания
100мл исследуемой воды помещают в коническую колбу, прибавляют 2-3 капли фенолфталеина.
При наличии щелочности вода окрашивается в малиновый цвет.
Титрование производят 0,1 н раствором серной кислоты до исчезновения окраски.
Величина щелочности численно равна количеству кислоты в мл, затраченной на титрование.
|
|
|
Щелочность можно выразить также величиной щелочного числа, которое равно величине щелочности умноженной на 40 (40 – эквивалент NaOH).
Определение содержания фосфатов в котловой воде
Реактивы: реактив на фосфаты.
Определение фосфатов в котловой воде основано на образовании растворимого соединения P2O5×V2O5×22MoO3 х n H2O, окрашенного в интенсивно – желтый цвет. Содержание фосфатов измеряется в компараторе путем сравнения окрасок испытуемой пробы и эталонных пленок. Набор эталонных пленок имеет окраску, соответствующую 10, 20, 30, 40, 50 мг/дм3 ионов фосфатов.
Проведение испытания
В градуированную пробирку отбирают 10 мл пробы котловой воды и добавляют в нее 2 мл реактива на фосфаты. Раствор тщательно перемешивают. Через 5 минут содержимое пробирки переливают в кювету, вставляют ее в средний паз компаратора, а в левом пазу последовательно поднимают стандартные пленки желтого цвета до тех пор, пока их окраска не сравняется с окраской испытуемой пробы.
Дата добавления: 2018-05-12; просмотров: 3729; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
