Корпускулярно-волновой дуализм возможно существует и у частиц вещества, в частности у электронов.
λ=h/mν -формула де Бpойля.
Опытное обоснование корпускулярно-волнового дуализма свойств вещества.
Фотоэлектрический эффект

Волновая функция и ее статистический смысл.

Стационаpные состояния.
Стационарных состояний – состояний с фиксированными значениями энергии. Если силовое поле, в котором движется частица, стационарно, т.е. функция  не зависит явно от времени и имеет смыл потенциальной энергии.
не зависит явно от времени и имеет смыл потенциальной энергии.
Уpавнение Шpедингеpа для стационаpных состояний.
Основное уравнение нерелятивистской квантовой механики сформулировано в 1926г. Э. Шредингером. Это уравнение имеет вид:

 где
где 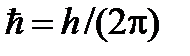 ,
, 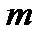 ‑ масса частицы,
‑ масса частицы,  ‑ оператор Лапласа
‑ оператор Лапласа
(  ),i – мнимая единица,
),i – мнимая единица,  ‑ потенциальная функция частицы в силовом поле, в котором она движется
‑ потенциальная функция частицы в силовом поле, в котором она движется  ‑ искомая волновая функция частицы.
‑ искомая волновая функция частицы.
Уравнение (1) является общим уравнением Шредингера. Его также называют уравнением Шредингера, зависящим от времени. Для многих других физических явлений, происходящих в микромире, уравнение (1) можно упростить, исключив зависимость  от времени, иными словами, найти уравнение Шредингера для стационарных состояний – состояний с фиксированными значениями энергии.
от времени, иными словами, найти уравнение Шредингера для стационарных состояний – состояний с фиксированными значениями энергии.
Туннельный эффект.
Тунне́льный эффект, туннели́рование — преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект — явление исключительно квантовой природы, невозможное в классической механике. Аналогом туннельного эффекта в волновой оптике может служить проникновение световой волны внутрь отражающей среды (на расстояния порядка длины световой волны) в условиях, когда, с точки зрения геометрической оптики, происходит полное внутреннее отражение. Явление туннелирования лежит в основе многих важных процессов в атомной и молекулярной физике, в физике атомного ядра, твёрдого тела и т. д.
|
|
|
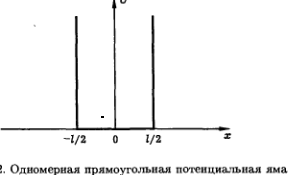
Частица в одномерной бесконечно глубокой прямоугольной потенциальной яме.

50.Опыт Резеpфоpда.

Постулаты Боpа.

Атом водрода.

Спектpы водоpодоподобных атомов.
. 
Формул Бальмера.
где m имеет в каждой данной серии постоянное значение, m=1,2,3,4,5,6 (определяет серию), nпринимает целочисленное значение, начиная сm+1 (определяет отдельные линии этой серии).
Главное квантовое число.
 Главное квантовое число
Главное квантовое число  , согласно собственным значениям энергии
, согласно собственным значениям энергии
|
|
|
определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: 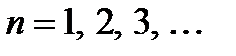
Орбитальное квантовое число.
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т.е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
 где
где  ‑орбитальное квантовое число, которое при заданном
‑орбитальное квантовое число, которое при заданном  принимает значения
принимает значения  ,
,
т.е. всего  значений, и определяет момент импульса электрона в атоме.
значений, и определяет момент импульса электрона в атоме.
Магнитные квантовое число.
Из решения уравнений Шредингера следует также, что вектор  момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция
момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция 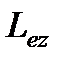 на направление
на направление  внешнего магнитного поля принимает квантованные значения, кратные
внешнего магнитного поля принимает квантованные значения, кратные  где
где  ‑магнитное квантовое число, которое при заданном
‑магнитное квантовое число, которое при заданном  может принимать значения
может принимать значения
 ,т.е. всего
,т.е. всего  значений. Таким образом, магнитное квантовое число
значений. Таким образом, магнитное квантовое число  определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве
определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве  ориентаций.
ориентаций.
|
|
|
Опыт Штерна и Герлаха.
О. Штерном и В. Герлахом были поставлены опыты целью которых являлось измерение магнитных моментов  атомов различных химических элементов. Для определения моментов
атомов различных химических элементов. Для определения моментов  и
и  одного электрона опыты должны быть поставлены с атомами, у которых орбитальные механические (и магнитные) моменты всех электронов, кроме одного, взаимно компенсируют друг друга. Такими атомами являются атомы химических элементов, образующие первую группу периодической системы Менделеева и имеющие один валентный электрон на внешней оболочке.
одного электрона опыты должны быть поставлены с атомами, у которых орбитальные механические (и магнитные) моменты всех электронов, кроме одного, взаимно компенсируют друг друга. Такими атомами являются атомы химических элементов, образующие первую группу периодической системы Менделеева и имеющие один валентный электрон на внешней оболочке.
Идея опытов Штерна и Герлаха заключалась в измерении силы, действующей на атом в неоднородном магнитном поле. В таком магнитном поле на атом должна действовать сила  . Здесь
. Здесь  – проекция магнитного момента атома на направление z магнитного поля, а В — индукция магнитного поля (направленная вдоль оси Z), неоднородного только вдоль этой же оси.Опыты Штерна и Герлаха обнаружили ошибочность классического предположения о том, что магнитный момент
– проекция магнитного момента атома на направление z магнитного поля, а В — индукция магнитного поля (направленная вдоль оси Z), неоднородного только вдоль этой же оси.Опыты Штерна и Герлаха обнаружили ошибочность классического предположения о том, что магнитный момент  и механический момент импульса
и механический момент импульса  атома произвольно ориентируются относительно направления внешнего поля, и подтвердили наличие пространственного квантования. И если бы момент импульса L; атома (и его магнитный момент рт) мог принимать произвольные ориентации в магнитном поле, то можно было бы ожидать непрерывного распределения попаданий атомов на пластинку с большей плотностью попаданий в середине пластинки и меньшей плотностью к ее краям. Опыты, проведенные с серебром и атомами других элементов периодической системы, привели к совершенно другому результату. На рис. показана фотография результата опыта Штерна и Герлаха с литием.
атома произвольно ориентируются относительно направления внешнего поля, и подтвердили наличие пространственного квантования. И если бы момент импульса L; атома (и его магнитный момент рт) мог принимать произвольные ориентации в магнитном поле, то можно было бы ожидать непрерывного распределения попаданий атомов на пластинку с большей плотностью попаданий в середине пластинки и меньшей плотностью к ее краям. Опыты, проведенные с серебром и атомами других элементов периодической системы, привели к совершенно другому результату. На рис. показана фотография результата опыта Штерна и Герлаха с литием.
|
|
|
Спин электрона.
Электрон обладает собственным неуничтожимым механическим моментом импульса, не связанными с движением электрона в пространстве, ‑спином. Спин электрона (и всех других микрочастиц) ‑ квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе. Если электрону приписывается собственный механический момент импульса (спин)  , то ему соответствует собственный магнитный момент
, то ему соответствует собственный магнитный момент  . Согласно общим выводам квантовой механики, спин квантуется по закону
. Согласно общим выводам квантовой механики, спин квантуется по закону  ,где s‑спиновое квантовое число.
,где s‑спиновое квантовое число.
Пpинцип Паули.
Распределение электронов в атоме подчиняется принципу Паули, который может быть сформулирован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l,  ,
,  , т.е.
, т.е.  или 1, где
или 1, где  ‑ число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел:
‑ число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел:  . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Уpовень Ферми.
 Химический потенциал
Химический потенциал  для ферми-частиц может быть только положительным, т.е.
для ферми-частиц может быть только положительным, т.е.  . Иначе при
. Иначе при 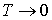 экспонента в знаменателе в обратилась бы в бесконечность, а числа заполнения - в нуль, чего, естественно, быть не может. Химический потенциал
экспонента в знаменателе в обратилась бы в бесконечность, а числа заполнения - в нуль, чего, естественно, быть не может. Химический потенциал  , который, как уже отмечалось, имеет размерность энергии, в случае ферми-частиц называют энергией Ферми или уровнем Ферми и обозначают
, который, как уже отмечалось, имеет размерность энергии, в случае ферми-частиц называют энергией Ферми или уровнем Ферми и обозначают  .
.
Дата добавления: 2018-05-12; просмотров: 335; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
