Строение атома и химическая связь
Казанский государственный технический университет им. А.Н. Туполева
СБОРНИК
КОНТРОЛЬНЫХ РАБОТ
ПО КУРСУ ОБЩЕЙ ХИМИИ
Учебное пособие
DH (реакции) =
=SDHf (продуктов) – S DHf (реагентов)
Казань – 2011
Печатается по рекомендации УМЦ КГТУ им. А.Н. Туполева
Рецензенты:
Будников Г.К. – докт. хим. наук, проф.Казанского Федерального университета
Евгеньев М.И. – докт. хим. наук, проф. Казанского государственного технологического университета
Авторы:А.Н. Глебов, А.Р. Буданов, И.Г. Григорьева, О.В. Лавриненко,
С.А. Мальцева, А.И. Шамкаева, Д.В. Фролов, Е.П. Чеклаукова
Сборник контрольных работ по курсу общей химии: Учебное пособие /
Под ред. проф. А.Н. Глебова. 4-е изд. Казань: Изд-во «Экоцентр», 2011. 32 стр.
Учебное пособие предназначено для студентов технического университета, изучающих общую химию по дневной, вечерней и заочной формам обучения. Пособие составлено в соответствии с учебным планом, программой курса общей химии. «Сборник контрольных работ» способствует более полному освоению изучаемого материала и развитию навыков самостоятельной работы студентов. В пособии приведены контрольные задания по основным темам курса общей химии, необходимые расчетные формулы, даны решения типовых задач.
ã Издательство «Экоцентр», 2011 г.
Содержание
| 1. Основные классы неорганических соединений | 4 |
| 2. Основные законы химии | 6 |
| 3. Строение атома и химическая связь | 9 |
| 4. Химическая термодинамика | 11 |
| 5. Химическая кинетика и равновесие | 14 |
| 6. Растворы | 17 |
| 7. Теория электролитической диссоциации | 20 |
| 8. Окислительно-восстановительные реакции | 22 |
| 9. Электрохимические процессы и системы | 25 |
| 10. Примеры решения типовых задач | 28 |
| Литература | 30 |
Основные классы неорганических соединений
Взаимосвязь между основными классами неорганических веществ (оксиды, кислоты, основания, соли) можно упрощенно представить в виде схемы:
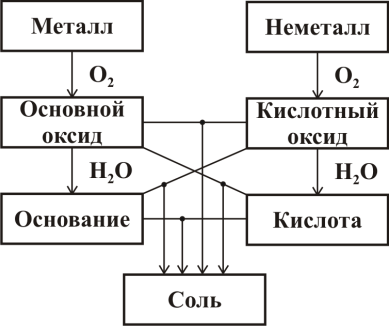
Химические свойства основных классов неорганических соединений:
| Металл | Основной оксид | Основание | Соль | |
| Неметалл | Fe + S = FeS | — | — | 2NaBr + Cl2 = 2NaCl + Br2 |
| Кислотный оксид | — | CaO + CO2 = CaCO3 | 2NaOH + CO2 = Na2CO3 + H2O | — |
| Кислота | Fe + 2HCl = FeCl2 + H2 | CaO + H2SO4 = CaSO4 + H2O | NaOH + HCl = NaCl + H2O | BaCl2 + H2SO4 = BaSO4↓ + 2HCl |
| Соль | Zn + CuSO4= Cu + ZnSO4 | — | CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 | AgNO3 + NaCl = AgCl↓ + NaNO3 |
1.1. Назовите вещество и укажите класс химических соединений:
1.1.1. Fe(OH)2Cl
1.1.2. K2CrO4
1.1.3. Mg(ClO3)2
1.1.4. NaHS
1.1.5. Al(OH)3
1.1.6. NaH2PO4
1.1.7. NH4OH
1.1.8. Na2Cr2O7
1.1.9. Ba(HSO3)2
1.1.10. Na2SO3
1.1.11. Ba(OH)2
1.1.12. HClO4
1.1.13. (CuOH)2CO3
1.1.14. Ba2P2O7
1.1.15. HMnO4
1.1.16. Al(OH)SO4
1.1.17. Ca(ClO)2
1.1.18. Ca(H2PO4)2
1.1.19. Al(NO3)3
1.1.20. K2ZnO2
1.2. Напишите формулы следующих соединений:
| 1.2.1. Хлорид фосфора (III) 1.2.2. Хромат калия 1.2.3. Гидрофосфат кальция 1.2.4. Гидроксид цинка 1.2.5. Дигидрофосфат калия 1.2.6. Пероксид водорода 1.2.7. Гидрокарбонат натрия 1.2.8. Оксид марганца (IV) 1.2.9. Селеновая кислота 1.2.10. Хлорид аммония | 1.2.11. Нитрат ртути (II) 1.2.12. Сульфат железа (III) 1.2.13. Гидрофосфат железа (II) 1.2.14. Угольная кислота 1.2.15. Бромоводородная кислота 1.2.16. Нитрат хрома (III) 1.2.17. Нитрат меди (II) 1.2.18. Гидроксид железа (III) 1.2.19. Ортофосфорная кислота 1.2.20. Перманганат натрия |
1.3. Составьте уравнение реакции получения следующего соединения и
рассчитайте массы реагентов, необходимых для получения 1 г вещества:
| 1.3.1. BaCrO4 1.3.2. (CuOH)2CO3 1.3.3. Al(OH)SO4 1.3.4. Ba(HSO3)2 1.3.5. NH4HS | 1.3.6.Cr(OH)SO4 1.3.7. Fe(NO3)3 1.3.8. NaHSO3 1.3.9. Ba(H2PO4)2 1.3.10. KClO3 | 1.3.11. MgHPO4 1.3.12. Fe(OH)Cl2 1.3.13. Ca(HSO4)2 1.3.14. NaH2PO4 1.3.15. Na2HPO4 | 1.3.16. Be(ClO4)2 1.3.17. Na4P2O7 1.3.18. LiHSO4 1.3.19. (NH4)2SO4 1.3.20. Al(OH)2NO3 |
1.4. Напишите уравнения соответствующих реакций, учитывая, что другие вещества можно использовать только в качестве катализаторов:
1.4.1. Даны: сульфат никеля, гидроксид натрия, хлор, водород. Получить: хлорид никеля (II), хлорид натрия, оксид никеля (II).
1.4.2. Даны: оксид меди (II), оксид серы (VI), натрий, вода. Получить: серную
кислоту, гидроксид меди (II), медь.
1.4.3. Даны: оксид меди (II), нитрат бария, серная кислота, гидроксид натрия,
вода. Получить: гидроксид меди (II), гидроксид бария, азотную кислоту.
1.4.4. Даны: кислород, натрий, сера, оксид магния, вода, соляная кислота.
Получить: хлорид магния, гидроксид магния, сульфит натрия.
1.4.5. Даны: гидроксид бария, вода, кислород, серная кислота, железо, оксид меди (II). Получить: гидроксид меди (II), сульфат железа (II), гидроксид железа (III).
1.4.6. Даны: карбонат меди (II), оксид азота (IV), вода, натрий. Получить: нитрат меди (II), гидроксид меди (II), карбонат натрия.
1.4.7. Даны: алюминий, кислород, сульфат меди (II), железо, соляная кислота.
Получить: хлорид меди (II), хлорид железа (II), сульфат алюминия.
1.4.8. Даны: хлорид железа (III), барий, вода, соляная кислота. Получить: железо, оксид железа (III), хлорид железа (II).
1.4.9. Даны: кислород, уголь, гидроксид кальция. Получить: оксид кальция,
карбонат кальция, гидрокарбонат кальция.
1.4.10. Даны: оксид серы (IV), вода, кислород, хлорид натрия, нитрат серебра.
Получить: хлорид серебра, серебро, соляную кислоту.
1.4.11. Даны: оксид кальция, уголь, хлорат калия, серная кислота. Получить:
карбонат кальция, оксид углерода (II), хлороводород.
1.4.12. Даны: магний, уголь, кислород, соляная кислота, гидроксид натрия.
Получить: оксид магния, гидроксид магния, карбонат магния.
1.4.13. Даны: железо, сера, вода, кислород, гидроксид натрия. Получить: серную кислоту, сульфат железа (II), гидроксид железа (III).
1.4.14. Даны: оксид меди (II), оксид серы (IV), кислород, натрий, соляная кислота. Получить: гидроксид меди (II), серную кислоту, сульфат меди (II).
1.4.15. Даны: водород, кислород, азот. Получить: азотную кислоту, нитрат
аммония, оксид азота (I).
1.4.16. Даны: хлорид алюминия, натрий, вода. Получить: алюминат натрия,
алюминий, оксид алюминия.
1.4.17. Даны: сульфид аммония, сульфит натрия, водород, хлор. Получить: сероводород, оксид серы (IV), серу.
1.4.18. Даны: гидроксид алюминия, гидроксид калия, фосфор, кислород, вода, оксид серы (IV). Получить: сульфит калия, дигидрофосфат калия, оксид алюминия.
1.4.19. Даны: оксид меди (II), сульфид натрия, соляная кислота, кислород.
Получить: сероводород, сульфат меди (II), сульфид меди (II).
1.4.20. Даны: натрий, кислород, вода, оксид железа (II), соляная кислота.
Получить: гидроксид натрия, хлорид железа (II), хлорид железа (III).
1.5. Изобразите структурные формулы следующих соединений:
| 1.5.1. Пероксид водорода 1.5.2. Борная кислота 1.5.3. Метафосфорная кислота 1.5.4. Серная кислота 1.5.5. Пирофосфорная кислота 1.5.6. Азотная кислота 1.5.7. Хлорноватистая кислота 1.5.8. Циановодородная кислота 1.5.9. Хлорноватая кислота 1.5.10. Ортофосфорная кислота | 1.5.11. Гидроксид меди (II) 1.5.12. Гидразин 1.5.13. Фосфористая кислота 1.5.14. Гидроксиламин 1.5.15. Угольная кислота 1.5.16. Хлорная кислота 1.5.17. Сернистая кислота 1.5.18. Азотистая кислота 1.5.19. Гидроксид кальция 1.5.20. Гидроксид железа (III) |
Основные законы химии
Закон Авогадро: равные объемы газов при нормальных условиях содержат одинаковое количество молекул.
Уравнение состояния идеального газа (Менделеева – Клапейрона):
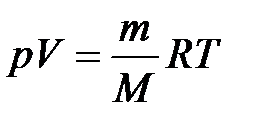 ,
,
где p – давление, Па; V – объем, м3; m – масса, г; M – молярная масса, г/моль;
R = 8,31 Дж/(моль×К) – универсальная газовая постоянная; T – температура, К.
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 моль атомов водорода или замещают его в соединении.
Эквивалентная масса элемента равна его атомной массе, деленной на его
валентность.
Эквивалентная масса кислоты/основания равна их молярной массе, деленной на его основность/кислотность.
Эквивалентная масса окислителя/восстановителя равна его молярной массе, деленной на число электронов, принимаемых/отдаваемых в ходе реакции.
2.1. Рассчитайте давление в сосуде:
2.1.1. объемом 5 л, содержащем 16 г кислорода и 28 г азота при 0ºС
2.1.2. объемом 20 л, содержащем 28 г этилена и 10 г аргона при 50ºС
2.1.3. объемом 10 л, содержащем 16 г метана и 42 г азота при -10ºС
2.1.4. объемом 20 л, содержащем 16 г кислорода и 28 г азота при 30ºС
2.1.5. объемом 20 л, содержащем 8 г метана и 4 г водорода при 25ºС
2.1.6. объемом 5 л, содержащем 18,25 г хлороводорода и 20,25 г бромоводорода при 80ºС
2.1.7. объемом 5 л, содержащем 1 г водорода и 2 г гелия при 20ºС
2.1.8. объемом 20 л, содержащем 16 г диоксида серы и 7 г азота при 15ºС
2.1.9. объемом 10 л, содержащем 14 г оксида углерода и 44 г диоксида углерода при 0ºС
2.1.10. объемом 50 л, содержащем 24 г метана и 4 г гелия при 0ºС
2.1.11. объемом 20 л, содержащем 8 г водорода и 30 г этана при 80ºС
2.1.12. объемом 20 л, содержащем 2 г гелия и 42 г азота при 20ºС
2.1.13. объемом 20 л, содержащем 8 г кислорода и 22 г диоксида углерода
при 125ºС
2.1.14. объемом 20 л, содержащем 32 г кислорода и 14 г азота при 45ºС
2.1.15. объемом 5 л, содержащем 4 г водорода и 8,5 г аммиака при 50ºС
2.1.16. объемом 10 л, содержащем 10 г аргона и 48 г кислорода при 0ºС
2.1.17. объемом 50 л, содержащем 20 г гелия и 8 г водорода при -100ºС
2.1.18. объемом 50 л, содержащем 17 г фосфина и 6 г водорода при 200ºС
2.1.19. объемом 10 л, содержащем 34 г аммиака и 14 г азота при 50ºС
2.1.20. объемом 10 л, содержащем 51 г аммиака и 7 г азота при 50ºС
2.2. Вычислите эквивалентную массу:
2.2.1. азота в оксидах N2O, NO, NO2
2.2.2. соляной кислоты в реакции 2HCl + Ni = NiCl2 + H2
2.2.3. металла, при сгорании 2 г которого образуется 2,76 г оксида
2.2.4. серы в фторидах SF4 и SF6
2.2.5. железа в оксидах FeO, Fe2O3
2.2.6. фосфорной кислоты в реакции H3PO4 + Mg(OH)2 = MgHPO4 + 2H2O
2.2.7. металла, при сгорании 5 г которого образуется 9,44 г оксида
2.2.8. серы в оксидах SO2 и SO3
2.2.9. мышьяковой кислоты в реакции H3AsO4 + NaOH = NaH2AsO4 + H2O
2.2.10. металла, 2 г которого вытесняют из соляной кислоты 1,85 л водорода (н.у.)
2.2.11. перманганата калия в реакции
2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + H2O + Na2SO4
2.2.12. углерода в оксидах CO и CO2
2.2.13. перманганата калия в реакции
2KMnO4 + 3H2SO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
2.2.14. титана в хлоридах TiCl2, TiCl3, TiCl4
2.2.15. перманганата калия в реакции
2KMnO4 + H2O + 3Na2SO3 = 2KOH + 2MnO2 + 3Na2SO4
2.2.16. хрома в оксидах CrO, Cr2O3, CrO3
2.2.17. гидроксида кальция в реакции Ca(OH)2 + 2CO2 = Ca(HCO3)2
2.2.18. основной соли в реакции Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl
2.2.19. основной соли в реакции Fe(OH)2Cl + 2HCl = FeCl3 + 2H2O
2.2.20. сульфита натрия в реакции
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + K2SO4 + Cr2(SO4)3 + 4H2O
2.3. Определите простейшую формулу вещества, если оно содержит
(по массе):
2.3.1. 18,28% лития, 71,09% алюминия и 10,62% водорода
2.3.2. 60,04% калия, 18,45 углерода и 21,51% азота
2.3.3. 72,36% железа и 27,64% кислорода
2.3.4. 1,40% водорода, 19,49% кремния и 79,11% фтора
2.3.5. 44,90% калия, 0,58% водорода, 17,78% фосфора и 36,74% кислорода
2.3.6. 19,15% натрия, 0,84% водорода, 26,74% серы и 53,31% кислорода
2.3.7. 35,00% азота, 5,04% водорода и 59,96% кислорода
2.3.8. 27,41% азота, 9,86% водорода и 62,73% серы
2.3.9. 52,14% углерода, 13,13% водорода и 34,73% кислорода
2.3.10. 57,48% меди, 0,91% водорода, 5,43% углерода и 36,18% кислорода
2.3.11. 69,19% серебра, 10,28% серы и 20,53% кислорода
2.3.12. 17,11% кальция, 0,86% водорода, 27,38% серы и 54,65% кислорода
2.3.13. 3,69% водорода, 37,77% фосфора и 58,54% кислорода
2.3.14. 39,67% калия, 27,87% марганца и 32,46% кислорода
2.3.15. 46,65% азота, 6,71% водорода, 20,00% углерода и 26,64% кислорода
2.3.16. 65,78% цинка, 2,03% водорода и 32,19% кислорода
2.3.17. 31,90% калия, 28,93% хлора и 39,17% кислорода
2.3.18. 26,95% серы, 13,45% кислорода и 59,60% хлора
2.3.19. 36,80% азота, 5,30% водорода, 15,78% углерода и 42,12% серы
2.3.20. 8,46% углерода, 2,13% водорода и 89,41% иода.
2.4. Расставьте стехиометрические коэффициенты в реакциях и рассчитайте, какую массу второго реагента необходимо взять на 1 г первого, чтобы
реакция прошла до конца:
2.4.1. H2O + P2O5 → H3PO4
2.4.2. NaH2PO4 + KOH → NaK2PO4 + H2O
2.4.3. (CuOH)2CO3 + H2SO4 → CuSO4 + CO2 + H2O
2.4.4. VO2 + HCl → VOCl2 + H2O
2.4.5. NaHSO4 + NaOH → Na2SO4 + H2O
2.4.6. NaOH + H2SO4 → Na2SO4 + H2O
2.4.7. Na2CO3 + HCl → NaCl + CO2 + H2O
2.4.8. Al2O3 + HNO3 → Al(NO3)3 + H2O
2.4.9. CuSO4 + KOH → (CuOH)2SO4 + K2SO4
2.4.10. K2SO3 + HCl → KCl + SO2 + H2O
2.4.11. K2Cr2O7 + KOH → K2CrO4 + H2O
2.4.12. Al2(SO4)3 + NaOH →Al(OH)SO4 + Na2SO4
2.4.13. FeCl3 + NaOH → Fe(OH)2Cl + NaCl
2.4.14. NaOH + Al(OH)3 → Na3[Al(OH)6]
2.4.15. Al2O3 + NaOH → NaAlO2 + H2O
2.4.16. Cr2O3 + H2SO4 → Cr2(SO4)3 + H2O
2.4.17. Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
2.4.18. Zn(OH)2 + KOH → K2[Zn(OH)4]
2.4.19. Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2.4.20. NaHCO3 + NaOH → Na2CO3 + H2O
2.5. Определите, какие продукты и в каком количестве (по массе) получатся при взаимодействии (обратите внимание на избыток одного из реагентов):
2.5.1. 500 г 1% раствора гидроксида кальция и 1 л углекислого газа (н.у.)
2.5.2. 2 г оксида кальция и 200 мл воды
2.5.3. 3 л хлора (Т = 353 К, p = 1,2×105 Па) и 8 г цинка
2.5.4. 200 г 30% раствора серной кислоты и 20 г карбоната кальция
2.5.5. 20 г 15% раствора соляной кислоты и 3 г алюминия
2.5.6. 300 г гидроксида калия и 40 л углекислого газа (н.у.)
2.5.7. 30 л аммиака (н.у.) и 200 г 15% раствора соляной кислоты
2.5.8. 0,5 г лития и 20 мл воды
2.5.9. 15 г магния и 20 л кислорода (t = 25°C, р = 800 мм рт. ст.)
2.5.10. 2 г серы и 8 г железа
2.5.11. 1 г магния и 3 г иода
2.5.12. 200 л хлора и 150 л водорода (н.у.)
2.5.13. 5 л водорода (н.у.) и 3 г оксида меди (II)
2.5.14. 100 г 5% раствора азотной кислоты и 100 г 5% раствора гидроксида натрия
2.5.15. 2,7 г алюминия и 3,2 г серы
2.5.16. 5 г натрия и 200 мл воды
2.5.17. 100 л водорода и 70 л кислорода (н.у.)
2.5.18. 3 г цинка и 200 г 10% раствора соляной кислоты
2.5.19. 5 г серы и 12 л кислорода (t = 0°C, p = 760 мм рт. ст.)
2.5.20. 50 г 3% раствора хлорида натрия и 10 г 7% раствора нитрата серебра.
Строение атома и химическая связь
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
| главное | n = 1, 2, 3, ... |
| орбитальное | l = 0, 1, ... , n – 1 |
| магнитное | m = –l, ... , –1, 0, 1, ... , l |
| спиновое | s = ±1/2 |
Заполнение электронных оболочек в многоэлектронных атомах происходит в соответствии со следующими закономерностями:
Принцип запрета Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Правило Гунда (Хунда): электроны располагаются по вырожденным орбиталям так, чтобы их суммарный спин был максимален.
Правило Клечковского: электроны заполняют подуровни по возрастанию суммы n + l, при равенстве сумм сначала заполняется подуровень с меньшим значением n.
Явление радиоактивности – процесс самопроизвольного распада ядер некоторых элементов. При a-распаде испускается a-частица (ядро 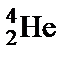 ), заряд ядра уменьшается на 2, массовое число – на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее.
), заряд ядра уменьшается на 2, массовое число – на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее.
При b+-распаде или К-захвате испускается позитрон или захватывается электрон с ближайшей к ядру оболочки соответственно, заряд ядра уменьшается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку левее.
Теоретическое рассмотрение химической связи возможно в рамках метода валентных связей (ВС) или метода молекулярных орбиталей (МО).
Метод ВС позволяет объяснить строение молекул многих химических соединений. Согласно этому методу химическая связь между атомами осуществляется обобществленными парами электронов с антипараллельными спинами на внешних подуровнях. Этот вид связи называется ковалентной связью (полярной и неполярной). Она характеризуется направленностью и насыщаемостью, что означает определенное расположение атомов в пространстве. Ионная связь возникает в результате электростатического взаимодействия противоположно заряженных ионов.
Метод МО предполагает, что электроны находятся на молекулярных орбиталях, охватывающих все ядра атомов в молекуле. Для двухатомных молекул элементов второго периода МО обозначаются (в порядке увеличения энергии):
2ss < 2ss* < 2py = 2pz < 2sx < 2py* = 2pz* < 2sx*.
Для элементов, находящихся в конце периода, начиная с кислорода, порядок следования МО несколько изменяется: ... < 2sx < 2py = 2pz < ...
3.1. Напишите электронные и электронно-ячеечные формулы валентных электронов атомов следующих элементов в основном и возбужденном
состояниях, определите высшую и низшую степени окисления, приведите
формулы оксидов в высшей степени окисления элемента:
3.1.1. p-элемент VI периода IV группы
3.1.2. p-элемент V периода V группы
3.1.3. p-элемент V периода VII группы
3.1.4. d-элемент IV периода IV группы
3.1.5. p-элемент III периода IV группы
3.1.6. p-элемент III периода VI группы
3.1.7. s-элемент V периода I группы
3.1.8. p-элемент IV периода V группы
3.1.9. p-элемент IV периода IV группы
3.1.10. d-элемент IV периода III группы
3.1.11. s-элемент III периода II группы
3.1.12. p-элемент IV периода VII группы
3.1.13. d-элемент VI периода V группы
3.1.14. s-элемент V периода II группы
3.1.15. p-элемент V периода IV группы
3.1.16. d-элемент V периода VI группы
3.1.17. p-элемент III периода VI группы
3.1.18. d-элемент IV периода VI группы
3.1.19. p-элемент III периода V группы
3.1.20. d-элемент V периода IV группы
3.2. Определите, относится ли данная электронно-ячеечная формула
к основному, возбужденному или невозможному состоянию атома, назовите химический элемент и укажите его порядковый номер:
| 3.2.1. |
| 3.2.10. | 
| |
| 3.2.2. |
| 3.2.11. | 
| |
| 3.2.3. |
| 3.2.12. | 
| |
| 3.2.4. |
| 3.2.13. | 
| |
| 3.2.5. |
| 3.2.14. | 
| |
| 3.2.6. |
| 3.2.15. | 
| |
| 3.2.7. |
| 3.2.16. | 
| |
| 3.2.8. |
| 3.2.17. | 
| |
| 3.2.9. |
| 3.2.18. | 
| |
| 3.2.19. | 
| 3.2.20. | 
| |
3.3. Напишите уравнения ядерных реакций:
3.3.1. 238U + 4He  3n + ... 3n + ...  ...
3.3.2. 225Th ...
3.3.2. 225Th 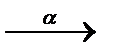 ... ... 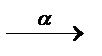 ...
3.3.3. 59Co+4He ...
3.3.3. 59Co+4He  n+... n+... 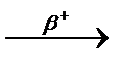 ...
3.3.4. 142Nd+p ...
3.3.4. 142Nd+p 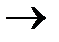 2n+ ... 2n+ ... 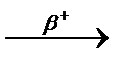 ...
3.3.5. 131Sn ...
3.3.5. 131Sn 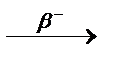 ... ... 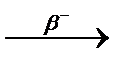 ...
3.3.6. 14N+12C ...
3.3.6. 14N+12C 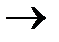 4He+... 4He+...  ...
3.3.7. 19F + p ...
3.3.7. 19F + p 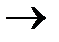 n + ... n + ...  ...
3.3.8. 16O + 14N ...
3.3.8. 16O + 14N 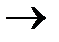 2p+... 2p+... 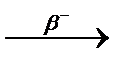 ...
3.3.9. 235U + n ...
3.3.9. 235U + n 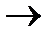 139Ba + 3n + ...
3.3.10. 213Bi 139Ba + 3n + ...
3.3.10. 213Bi 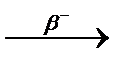 ... ... 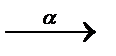 ... ...
| 3.3.11. 30Si+3He 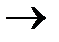 2p+... 2p+... 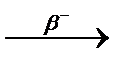 ...
3.3.12. 114Cd + n ...
3.3.12. 114Cd + n  p+... p+... 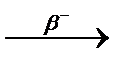 ...
3.3.13. 10B+4He ...
3.3.13. 10B+4He  n+.... n+.... 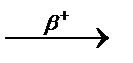 ...
3.3.14. 139Xe ...
3.3.14. 139Xe  ... ... 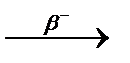 ...
3.3.15. 226Pa ...
3.3.15. 226Pa  ... ... 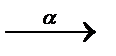 ...
3.3.16. 46Ti + 2H ...
3.3.16. 46Ti + 2H  n+... n+... 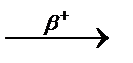 ...
3.3.17. 89Br ...
3.3.17. 89Br 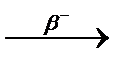 ... ... 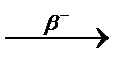 ...
3.3.18. 238U ...
3.3.18. 238U 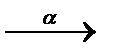 ... ... 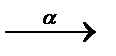 ...
3.3.19. 213Po ...
3.3.19. 213Po  ... ... 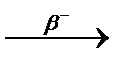 ...
3.3.20. 211Bi ...
3.3.20. 211Bi  ... ... 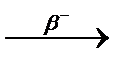 ... ...
|
3.4. Определите тип гибридизации и пространственное строение следующих молекул и ионов:
| 3.4.1. SiF4 3.4.2. NH3 3.4.3. CO2 3.4.4. BeF2 | 3.4.5. BF4– 3.4.6. CH4 3.4.7. PCl5 3.4.8. SiH4 | 3.4.9. NH4+ 3.4.10. BeH2 3.4.11. C2H4 3.4.12. BF3 | 3.4.13. SF6 3.4.14. H2O 3.4.15. C2H6 3.4.16. PCl3 | 3.4.17. SiF62– 3.4.18. SiCl4 3.4.19. C2H2 3.4.20. CCl4 |
3.5. Объясните с помощью метода молекулярных орбиталей возможность
образования следующих молекул и ионов, определите порядок связи,
установите, являются ли они диамагнитными или парамагнитными:
| 3.5.1. C2 3.5.2. Be2+ 3.5.3. N2+ 3.5.4. Ne2+ | 3.5.5. CO 3.5.6. Li2+ 3.5.7. B2 3.5.8. CO+ | 3.5.9. O2– 3.5.10. F2 3.5.11. B2+ 3.5.12. O2 | 3.5.13. C2+ 3.5.14. N2 3.5.15. O2+ 3.5.16. CN | 3.5.17. NO+ 3.5.18. CN– 3.5.19. Li2 3.5.20. NO |
Химическая термодинамика
Первое начало термодинамики:DU = Q – A, где U – внутренняя энергия;
Q – теплота; A – работа.
Закон Гесса: тепловой эффект химической реакции зависит только
от начального и конечного состояния, но не зависит от пути превращения.
Следствие из закона Гесса:
DH(реакции) = S DHf (продуктов) – S DHf (реагентов),
где H – энтальпия (DH = DU + pDV), DHf – энтальпия образования вещества.
Второе начало термодинамики: 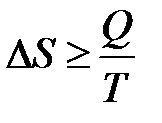 , где S – энтропия.
, где S – энтропия.
Для изолированных систем: DS ³ 0.
DS(реакции) = S S(продуктов) – S S(реагентов).
Свободная энергия Гиббса: DG = DH – TDS,
DG(реакции) = S DGf (продуктов) – S DGf (реагентов).
Для самопроизвольных реакций DG < 0.
4.1. Используя справочные данные вычислить тепловой эффект реакции:
4.1.1. 2SO2(г.) + O2(г.) = 2SO3(г.)
4.1.2. 4NH3(г.) + 3O2(г.) = 2N2(г.) + 6H2O(г.)
4.1.3. 2С2H2(г.) + 5O2(г.) = 4CO2(г.) + 2H2O(г.)
4.1.4. С2H5OH(ж.) + 3O2(г.) = 2CO2(г.) + 3H2O(ж.)
4.1.5. 2KClO3(тв.) = 2KCl(тв.) + 3O2(г.)
4.1.6. 4HCN(г.) + 5O2(г.) = 2H2O(ж.) + 4CO2(г.) + 2N2(г.)
4.1.7. CO2(г.) + C(графит) = 2CO(г.)
4.1.8. C2H4(г.) + 3O2(г.) = 2CO2(г.) + 2H2O(г.)
4.1.9. WO3(тв.) + 2Al(тв.) = Al2O3(тв.) + W(тв.)
4.1.10. TiO2(тв.) + 2Mg(тв.) = Ti(тв.) + 2MgO(тв.)
4.1.11. 2H2O2(ж.) = 2H2O(ж.) + O2(г.)
4.1.12. (CuOH)2CO3(тв.) = 2CuO(тв.) + CO2(г.) + H2O(г.)
4.1.13. Fe2O3(тв.) + 3СO(г.) = 2Fe(тв.) + 3СO2(г.)
4.1.14. CH4(г.) + 2O2(г.) = CO2(г.) + 2H2O(г.)
4.1.15. 2C2H6(г.) + 7O2(г.) = 4CO2(г.) + 6H2O(г.)
4.1.16. 6CO2(г.) + 6H2O(ж.) = C6H12O6(тв.) + 6O2(г.)
4.1.17. 2Fe2O3(тв.) + 3С(графит) = 4Fe(тв.) +3СO2(г.)
4.1.18. С6H12O6(тв.) = 2С2H5OH(ж.) + 2CO2(г.)
4.1.19. 2H2S(г.) + SO2(г.) = 3S(ромб.) + 2H2O(г.)
4.1.20. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.)
4.2. Не производя вычислений, определите знак изменения энтропии:
4.2.1. H2(г.) + I2(г.) = 2HI(г.)
4.2.2. 2H2(г.) + O2(г.) = 2H2O(ж.)
4.2.3. PCl3(ж.) + Cl2(г.) = PCl5(тв.)
4.2.4. 2NH3(г.) = N2(г.) + 3H2(г.)
4.2.5. 2SO2(г.) + O2(г.) = 2SO3(ж.)
4.2.6. 3C2H2(г.) = C6H6(ж.)
4.2.7. 2NO(г.) + O2(г.) = 2NO2(г.)
4.2.8. 2H2S(г.) + 3O2(г.) = 2H2O(ж.) + 2SO2(г.)
4.2.9. NH4NO2(тв.) = N2(г.) + 2H2O(ж.)
4.2.10. 2CH3OH(г.) + 3O2(г.) = 4H2O(ж.) + 2CO2(г.)
4.2.11. 2N2O(г.) = 2N2(г.) + O2(г.)
4.2.12. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.)
4.2.13. C(графит) + CO2(г.) = 2CO(г.)
4.2.14. 6Li(тв.) + N2(г.) = 2Li3N(тв.)
4.2.15. C(алмаз) = С(графит)
4.2.16. P2O5(тв.) + 3H2O(ж.) = 2H3PO4(тв.)
4.2.17. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(г.)
4.2.18. С(графит) + 2N2O(г.) = СO2(г.) + 2N2(г.)
4.2.19. Cu(OH)2(тв.) = CuO(тв.) + H2O(г.)
4.2.20. N2O4(г.) = 2NO2(г.)
4.3. Вычислите изменение свободной энергии Гиббса и определите возможность протекания реакции при стандартных условиях:
4.3.1. NaHCO3(тв.) = NaOH(тв.) + CO2(г.)
4.3.2. 2CH4(г.) + 2NH3(г.) + 3O2(г.) = 2HCN(г.) + 3H2O(ж.)
4.3.3. SiH4(г.) + 2O2(г.) = SiO2(тв.) + 2H2O(ж.)
4.3.4. H2S(г.) + 2O2(г.) = H2SO4(ж.)
4.3.5. 2Ag(тв.) + H2S(г.) = Ag2S(тв.) + H2(г.)
4.3.6. Ca3N2(тв.) + 6H2O(ж.) = 3Сa(OH)2(тв.) + 2NH3(г.)
4.3.7. C6H12O6(тв.) = 2C2H5OH(ж.) + 2CO2(г.)
4.3.8. 4Ag(тв.) + 2H2S(г.) + O2(г.) = 2Ag2S(тв.) + 2H2O(ж.)
4.3.9. NH4NO3(тв.) = N2O(г.) + 2H2O(ж.)
4.3.10. Mg3N2(тв.) = 3Mg(тв.) + N2(г.)
4.3.11. 2KCl(тв.) + 3O2(г.) = 2KClO3(тв.)
4.3.12. 3H2SO4(ж.) + Al2O3(тв.) = Al2(SO4)3(тв.) + 3H2O(ж.)
4.3.13. 4CuO(тв.) = 2Cu2O(тв.) + O2(г.)
4.3.14. PbO2(тв.) + Pb(тв.) = 2PbO(тв.)
4.3.15. 4NO2(г.) = 2N2O(г.) + 3O2(г.)
4.3.16. Al2O3(тв.) + 3H2(г.) = 2Al(тв.) + 3H2O(ж.)
4.3.17. 2Al2O3(тв.) + 3С(графит) = 4Al(тв.) + 3СO2(г.)
4.3.18. CH4(г.) + NH3(г.) = HCN(г.) + 3H2(г.)
4.3.19. 3C2H4(г.) = C6H6(ж.) + 3H2(г.)
4.3.20. SiCl4(ж.) + 2H2O(ж.) = SiO2(тв.) + 4HCl(г.)
4.4. Определите, как влияет повышение температуры на смещение равновесия и при какой температуре направление реакции сменится на противоположное (зависимостью DH и DS реакций от температуры пренебречь):
4.4.1. 2NaHCO3(тв.)  Na2CO3(тв.) + H2O(г.) + CO2(г.)
Na2CO3(тв.) + H2O(г.) + CO2(г.)
4.4.2. Mg(OH)2(тв.)  MgO(тв.) + H2O(г.)
MgO(тв.) + H2O(г.)
4.4.3. N2(г.) + 3H2(г.)  2NH3(г.)
2NH3(г.)
4.4.4. CaO(тв.)+ CO2(г.)  CaCO3(тв.)
CaCO3(тв.)
4.4.5. 3C2H2(г.)  C6H6(г.)
C6H6(г.)
4.4.6. C2H2(г.) + 2H2(г.)  C2H6(г.)
C2H6(г.)
4.4.7. 2PbO(тв.) + O2(г.)  2PbO2(тв.)
2PbO2(тв.)
4.4.8. CH4(г.)  C(графит) + 2H2(г.)
C(графит) + 2H2(г.)
4.4.9. ZnCO3(тв.)  ZnO(тв.) + CO2(г.)
ZnO(тв.) + CO2(г.)
4.4.10. 2NO(г.) + O2(г.)  2NO2(г.)
2NO2(г.)
4.4.11. 2H2(г.) + O2(г.)  2H2O(г.)
2H2O(г.)
4.4.12. CO2(г.) + H2(г.)  CO(г.) + H2O(г.)
CO(г.) + H2O(г.)
4.4.13. N2O4(г.)  2NO2(г.)
2NO2(г.)
4.4.14. 2SO2(г.) + O2(г.)  2SO3(г.)
2SO3(г.)
4.4.15. Fe2O3(тв.) + H2(г.)  2FeO(тв.) + H2O(г.)
2FeO(тв.) + H2O(г.)
4.4.16. CaO(тв.) + H2O(г.)  Ca(OH)2(тв.)
Ca(OH)2(тв.)
4.4.17. Fe3O4(тв.) + H2(г.)  3FeO(тв.) + H2O(г.)
3FeO(тв.) + H2O(г.)
4.4.18. CO2(г.) + C(графит)  2CO(г.)
2CO(г.)
4.4.19. C2H6(г.)  C2H4(г.) + H2(г.)
C2H4(г.) + H2(г.)
4.4.20. C2H4(г.) + H2O(ж.)  C2H5OH(ж.)
C2H5OH(ж.)
4.5. Определите энергетическую ценность следующих органических веществ – пищевых продуктов (продукт + nO2(г.) → xCO2(г.) + yH2O(ж.)), пользуясь приведенными значениями DHf°:
4.5.1. Ацетилсалициловая кислота (аспирин) CH3COOC6H4COOH (-1300 кДж/моль)
4.5.2. Лактоза (молочный сахар) С12H22O11·H2O (-1980 кДж/моль)
4.5.3. Сахароза C12H22O11 (-2221 кДж/моль)
4.5.4. Глюкоза C6H12O6 (-1273 кДж/моль)
4.5.5. Сорбит СH2OH(CHOH)4CH2OH (-1250 кДж/моль)
4.5.6. Щавелевая кислота (COOH)2 (-827 кДж/моль)
4.5.7. Янтарная кислота (CH2COOH)2 (-583 кДж/моль)
4.5.8. Яблочная кислота HOOCCH2CHOHCOOH (-630 кДж/моль)
4.5.9. Глицерин CHOH(CH2OH)2 (-659 кДж/моль)
4.5.10. Валериановая кислота C5H10O2 (548 кДж/моль)
4.5.11. Этилвалериат C4H7COOC2H5 (552 кДж/моль)
4.5.12. Этиловый спирт C2H5OH (-278 кДж/моль)
4.5.13. Этилацетат CH3COOC2H5 (-463 кДж/моль)
4.5.14. Этилизовалериат (CH3)2CHCH2COOC2H5 (569 кДж/моль)
4.5.15. Уксусная кислота CH3COOH (-487 кДж/моль)
4.5.16. Бензойная кислота C6H5COOH (50 кДж/моль)
4.5.17. Масляная кислота CH3(CH2)2COOH (556 кДж/моль)
4.5.18. Молочная кислота CH3CHOHCOOH (-550 кДж/моль)
4.5.19. Мальтоза C12H22O11·H2O (-1910 кДж/моль)
4.5.20. Фруктоза CH2OH(CHOH)3COCH2OH (-1260 кДж/моль)
Дата добавления: 2018-05-12; просмотров: 635; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!









