Факторы, влияющие на процесс осаждения и качество осажденных пленок
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Им. Н. Э. БАУМАНА
Факультет «Машиностроительные технологии»
Кафедра «Материаловедение»
Реферат на тему:
«Электрохимическое осаждение
Благородных металлов»
Студент: Гулай П.А.
Группа: МТ8-81
Преподаватель: Пахомова С.А.
Москва 2018
Оглавление
1. Введение 2
2. Основы электрохимического осаждения 2
3. Процесс осаждения 4
4. Факторы, влияющие на процесс осаждения и качество осажденных пленок 5
5. Методы создания покрытий способом электрохимического осаждения 11
6. Области применения 12
7. Список литературы 13
Введение
Благородные металлы — металлы, не подверженные коррозии и окислению, что отличает их от большинства «неблагородных» металлов. Все они являются также драгоценными металламиблагодаря их редкости. Основные благородные металлы — золото, серебро, а также платина и остальные 5 металлов платиновой группы— рутений, родий, палладий, осмий, иридий.
|
|
|
Название благородные металлыони получили благодаря высокой химической стойкости (практически не окисляются на воздухе) и блескув изделиях. Золото, серебро, чистая платина и палладий обладают высокой пластичностью, а остальные благородные металлы, к тому же— очень высокой тугоплавкостью.
Химические процессы, происходящие при протекании электрического тока через электролит, носят название электролиза, а выделение на электродах в результате этих процессов какого-либо вещества называется электролитическим осаждением или электроосаждением.
Основы электрохимического осаждения
Явление электролиза описывается двумя законами, сформулированными Фарадеем в 1833 г.:
1) масса выделившегося вещества прямо пропорциональна количеству электричества, прошедшего через электролит;
Так, если через электролит пропускать ток 10 А в течение 10 ч или 100 А в течение 1 ч, в обоих случаях количество электричества, прошедшее через электролит, будут равны 100 А×ч.
2) массы различных веществ, осажденных на электроде или удаленных вследствие их растворения при прохождении через электролит такого же количества электричества, прямо пропорциональны химическим эквивалентам этих веществ.
|
|
|
Грамм-эквивалент – вещества равен отношению атомной массы к валентности. Так, грамм-эквивалент двухвалентной меди равен 63,57:2=31,78 г, а шестивалентного хрома – 52,01:6=8,67 г.
E/F=k – электрохимический эквивалент
Объединенный закон электролиза математически можно представить в виде
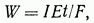
где W -масса (в граммах) осажденного вещества, I - ток (в амперах), E– грамм-эквивалент вещества (в граммах) и t - продолжительность процесса (в секундах). Величина F называемая числом Фарадея и равная 96485 Кл/моль (1 Фарадей = 96500 Кл/моль = заряд 1 моля электронов = заряд 6,022×1022электронов) представляет собой заряд, который необходимо пропустить через раствор, чтобы вызвать осаждение ионов какого-либо вещества, количество которого численно равно его электрохимическому эквиваленту.
Обычно на электродах выделяется меньше вещества, чем следует из законов Фарадея, что объясняется протеканием в электролитической ванне побочных реакций (например, реакций выделения водорода и кислорода). Отношение количества выделившегося на электроде вещества к теоретически возможному называют выходом по току электрохимического процесса (иногда, коэффициентом использования тока).
|
|
|
Так же, как и при электролитическом осаждении, в процессе химического осаждения происходит восстановление ионов металла с образованием осаждаемого вещества, однако в данном случае внешний источник энергии, генерирующий электроны, не применяется. Вместо этого для активации процесса осаждения используется каталитически активная поверхность, причем для дальнейшего протекания реакции необходимо, чтобы сам металл был катализатором. Наличие в растворе электронов, участвующих в реакции восстановления, обеспечивает восстановитель. Поскольку осаждаемые металлы должны обладать каталитической активностью, данный метод применим для получения пленок ограниченного числа металлов.
Достоинства метода химического осаждения состоят в следующем:
1) возможно осаждение очень однородных пленок без утолщений по краям и на выпуклых участках подложки;
2) получаемые пленки обладают меньшей пористостью, чем электроосажденные пленки;
3) возможно осаждение пленок на непроводящие подложки после предварительной обработки, придающей их поверхности каталитическую активность.
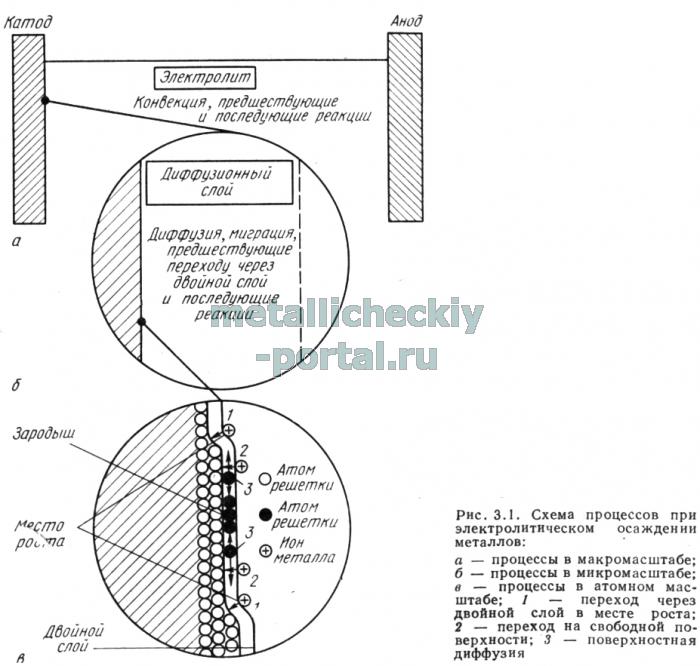
Электрохимическое осаждение металлов согласно современным представлениям происходит в четыре стадии:
|
|
|
1. электролитическая диссоциация соли в растворе;
2. перенос ионов из объема электролита к электроду;
3. переход ионов на границе фаз из объема электролита к металлу;
4. диффузия адсорбированных атомов по поверхности электрода к местам роста пленки и встраивание атомов в кристаллическую решетку.
При анодном растворении металлов эти процессы проходят в обратном порядке.
Процесс осаждения
При погружении металлического электрода в раствор содержащий ионы того же металла, устанавливается динамическое равновесие
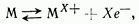
где символом  обозначен атом металла. Разность потенциалов, возникающая между электродом и электролитом при отсутствии внешнего напряжения, называется электродным потенциалом.
обозначен атом металла. Разность потенциалов, возникающая между электродом и электролитом при отсутствии внешнего напряжения, называется электродным потенциалом.
В условиях динамического равновесия электрод приобретает определенный заряд, который притягивает ионы с зарядом противоположного знака, а также молекулы воды и удерживает их на границе раздела электрода и электролита за счет электростатического взаимодействия. При этом образуется так называемый двойной электрический слой; его внутренняя часть состоит в основном из диполей, образованных ориентированными молекулами воды, и распределенных между ними избирательно адсорбированных ионов, в то время как его наружный слой содержит ионы с зарядом противоположного знака по отношению к электроду. В процессе осаждения вещества ионы достигают электрода, а затем, перемещаясь по его поверхности, занимают устойчивое положение, и если они имеют сольватную оболочку, то одновременно с этим происходит отделение лигандов (молекул воды или комплексообразующих агентов), в результате чего ионы приобретают свойственный им заряд. В этих условиях протекает заранее предусмотренная электрохимическая реакция. Быстрое уменьшение концентрации ионов в двойном слое при осаждении вещества компенсируется непрерывным поступлением новых ионов из объема электролита. Перенос ионов в обедненную область обусловлен следующими процессами:
1) диффузией, связанной с наличием градиента концентрации ионов;
2) дрейфом под действием приложенного электрического поля;
3) протеканием в электролите конвекционных токов.
Факторы, влияющие на процесс осаждения и качество осажденных пленок
Существует ряд параметров процесса осаждения, изменение которых значительно влияет на условия роста и свойства получаемых пленок.
1) Плотность тока. Эта величина, согласно определению, равная отношению общего тока к площади электрода, является одним из наиболее важных параметров, от которого зависят общие характеристики пленки, в том числе микроструктура, эффективность осаждения и скорость роста. Для каждого конкретного процесса осаждения оптимальный диапазон плотностей тока, обеспечивающих получение осадка с определенными свойствами, можно определить экспериментально.
2) Характеристики электролитической ванны. Важную роль в процессе осаждения играет состав ванны. Основным параметром, определяющим процесс осаждения пленок, является состав электролита, который служит источником ионов, имеющих простую форму или образующих комплексное соединение. В зависимости от характера процесса осаждения (он может протекать на катоде или на аноде) значительное влияние на структуру образующейся пленки оказывают свойства либо анионов, либо катионов, причем это влияние усиливается, если на поверхности раздела электрода и электролита существуют избирательно адсорбированные ионы, образующие часть внутренней области двойного слоя. Молекулы некоторых органических соединений, содержащиеся во внутренней части двойного слоя, играют такую же роль, как и адсорбированные ионы. В некоторых случаях в ванну добавляют поверхностно-активные вещества, улучшающие смачивание поверхности катода электролитом, благодаря чему с поверхности удаляются пузырьки водорода и предотвращается коррозия, которая происходит при выделении водорода в процессе катодного осаждения. Если электролит не обладает достаточно высокой электропроводностью, в него вводят кислоты, щелочи или соответствующие соли, которые имеют высокую ионизирующую способность и позволяют изменять электропроводность электролита, а также регулировать рН ванны. Значением рН определяется общая электропроводность электролита с введенными в него добавками. Однако необходимо выбрать оптимальное значение рН, поскольку при очень низких рН будет происходить лишь выделение водорода, а при чрезмерно высоких рН осажденное вещество может содержать включения гидроксида. Температура ванны влияет на диффузию ионов, конвекционные токи, состав и устойчивость комплексных соединений, а также на процесс разложения добавок (если они применяются).
3) Форма электрода. Распределение тока по поверхности электрода и, следовательно, степень однородности осаждаемой пленки зависят от формы активного электрода. Более высокая плотность тока по краям электрода, а также на выпуклых участках поверхности, и более низкая — на участках, содержащих трещины и углубления, приводит к тому, что толщина пленки увеличивается по направлению к краям.
4) Встречный электрод. Встречный электрод, обычно непосредственно не участвующий в осаждении пленки, необходим для получения замкнутой электрической цепи. Однако в некоторых случаях он может использоваться для пополнения электролита ионами осаждаемого вещества.
5) Перемешивание электролита. Создавая в ванне с помощью внешнего перемешивающего устройства конвекционные токи, можно уменьшить вероятность возникновения концентрационного перенапряжения.
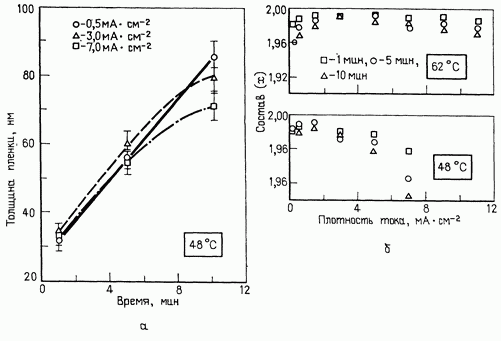
Особенности процесса роста (а) и зависимость состава пленок:  получаемых методом электроосаждения, от температуры и плотности тока при различной продолжительности процесса (б)
получаемых методом электроосаждения, от температуры и плотности тока при различной продолжительности процесса (б)
Факторы, оказывающие вторичное влияние на осаждение металлов:
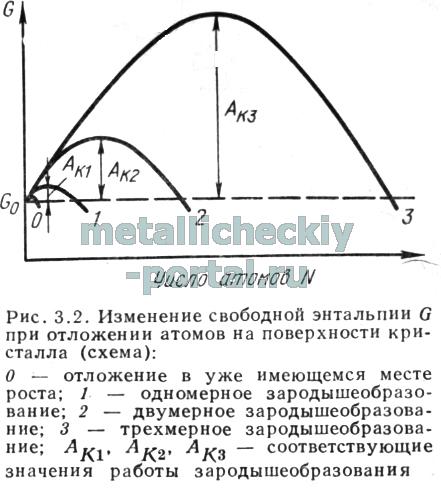
Существенное влияние на структуру и тем самым на свойства осаждающихся слоев оказывают процессы зародышеобразования. Агрегат адсорбированных атомов такого размера и формы, который в соответствии со своим расположением в пространстве способен увеличиваться, усваивая другие атомы (причем этот процесс сопровождается уменьшением свободной энтальпии), называется зародышем. На рис. 3.2 схематически показано изменение свободной энтальпии при увеличении размеров агрегатов частиц. Максимум функции, типичной для какого-либо вида зародышеобразования, соответствует энергии активации — работе зародышеобразования По форме и расположению можно различать три типа зародышей:
а. Трехмерные зародыши. Они представляют собой пространственные упорядоченные группы атомов, решетка которых не когерентна решетке подложки (например, зародыши с чужеродной ориентацией кристаллической решетки, образовавшиеся при высоких перенапряжениях, или зародыши на чужеродной подложке при отсутствии эпитаксических срастаний).
б. Двухмерные (плоские) зародыши. Эти зародыши представляют собой плоскостные агрегаты, структура которых когерентна подложке, например, при новообразовании одноатомного (моноатомарного) слоя роста на гладкой поверхности кристалла. Даже и при чужеродной подложке при определенной когерентности (при расхождении в величине постоянной решетки не более 15 %) может наблюдаться эпитаксия. Принудительная подгонка типа кристаллической решетки зародыша к типу решетки подложки (субстрата) называется топотаксией.
в. Одномерные (кромочные, линейные) зародыши. Они состоят из рядов атомов, отложившихся на моноатомарных ступеньках.
Формы роста слоя покрытия
Повторяющийся этап отложения атомов на местах роста кристаллов не оказывает никакого влияния на структуру осаждающегося металла; напротив, взаимодействие между различными видами зародышеобразования определяет получение крупнокристаллической или мелкокристаллической структуры и формы поверхности. Поэтому зародышеобразование можно рассматривать как управляющую величину, определяющую механизм роста покрытия. В свою очередь скорости зародышеобразования зависят от перенапряжения кристаллизации, так что в определенных диапазонах величины перенапряжения систематически проявляются типичные механизмы роста. В соответствии с феноменологической картиной роста Фишер предложил классификацию различных типов роста:
FI — выделение с ориентацией на поле;
BR — воспроизведение с ориентацией на основание (подложку);
Z — переход с помощью двойникования;
FT — текстура с ориентацией на поле;
UD — рассеяние без ориентации.
Попутное выделение водорода
Обратимый потенциал и плотность обменного тока частичной реакции, определяющие выделение водорода, обусловливают относительное положение его по отношению к осаждению металла на диаграмме плотность тока — потенциал. В простейшем случае попутное выделение водорода можно описать двумя суммарными реакциями:
1) Н2 ←→ 2Н + 2е-; (3.24)
2) Н2 + 2ОН- ←→ 2Н2О + 2е-, (3.25)
причем реакция 1 протекает преимущественно в кислой области, а реакция 2 — в щелочной. Типичный характер поляризационной кривой (плотность тока — потенциал) показан на рис.для случая электролиза раствора без осаждения металла. Соответствующие кривые могут служить для ориентировочной оценки хода процесса при осаждении металла в том же диапазоне потенциалов.
:

Обменная плотность тока водородной реакции, впрочем, очень сильно изменяется в зависимости от физического и химического состояния поверхности электрода. Кроме того, посторонние вещества, адсорбированные на поверхности, могут оказывать и каталитическое (например, соединения серы), и ингибирующее действия.
Скорость реакции превращения водорода ид при этом учитывает доставку водосодержащих веществ к двойному слою, в первую очередь ионов Н+, молекул Н20 и кислот, превращение этих веществ и удаление продуктов реакции от поверхности электрода. Уравнение баланса имеет вид:
υн= υ1+ υ2 = υно +υ3 + υ4 + υ5.
где υ1 — скорость подвода ионов Н+; υ2 — скорость подвода Н20 и кислот; υно — скорость изменения рН перед электродом; υ3 — скорость образования молекулярного водорода Н2; υ4 — скорость внедрения водорода в металл; υ5 — скорость образования других соединений с участием водорода. Если в превращении участвуют не чисто химические реакции, то величина vн соответствует суммарной плотности тока для всего комплекса электрохимических реакций с участием водорода.
Затрудненность доставки ионов Н+ из электролита или удаления ионов ОН-от электрода может иногда привести к повышению величины рН перед электродом во время электролиза. Это оказывает влияние на такие реакции осаждения металлов, в механизме которых участвуют ионы Н+ или ОН-, например, при осаждении железа, кобальта, никеля и др. Кроме того, может произойти выпадение из раствора труднорастворимых соединений, например, гидроокисей, которые тоже могут временно существовать в коллоидном состоянии в пространстве около электродов. При внедрении таких вторично образовавшихся веществ в слой металла происходит стойкое изменение его свойств, что нередко приводит к полной непригодности покрытия (охрупчиванию, окрашиванию). Для противодействия этому применяют буферные вещества, обычно многоосновные слабые кислоты.
Образование пузырьков водорода на поверхности электрода ведет сначала к локальному экранированию поверхности, а при длительной их задержке приводит к возникновению локальных углублений или пор. Для предотвращения этого эффекта в электролит добавляют смачивающие вещества.
Отрыв и всплывание пузырьков водорода сопровождается значительным нарушением гидродинамического поверхностного слоя, что влечет за собой уменьшение средней толщины диффузионного слоя пропорционально скорости выделения газа.
Дата добавления: 2018-05-12; просмотров: 1012; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
