Момент силы. Уравнение динамики вращательного движения твердого тела относительно неподвижной оси. Момент импульса. закон сохранения момента импульса.
 Моментом силы F относительно неподвижной точки О называется физическая величина, определяемая векторным произведением радиуса-вектора r, проведенного из точки О в точку А приложения силы, на силу F (рис. 1):
Моментом силы F относительно неподвижной точки О называется физическая величина, определяемая векторным произведением радиуса-вектора r, проведенного из точки О в точку А приложения силы, на силу F (рис. 1):

Здесь М - псевдовектор, направление которого совпадает с направлением поступательного движения правого винта при его вращении от r к F. Модуль момента силы
 (1)
(1)
где α - угол между r и F; rsinα=l - наименьшее расстояние между линией действия силы и точкой О - плечо силы.
Моментом силы относительно неподвижной оси z называется скалярная величина Mz , равная проекции на эту ось вектора М момента силы, определенного относительно произвольной точки О данной оси z (рис. 2).
Значение момента Мz не зависит от выбора положения точки О на оси z.
Если ось z совпадает с направлением вектора М, то момент силы представляется в виде вектора, совпадающего с осью:

работа при вращении тела-
работа равна произведению проекции силы на направление с мещения на величину смещения:
 (2)
(2)
Учитывая (1), можем записать

где Frsinα=Fl=Mz - момент силы относительно оси z. Значит, работа при вращении тела равна произведению момента действующей силы на угол поворота.
Работа при вращении тела идет на увеличение его кинетической энергии: dA=dT, но 

Учитывая, что  получаем
получаем
 (3)
(3)
Уравнение (3) представляет собой уравнение динамики вращательного движения твердого тела относительно неподвижной оси.
Можно показать, что если ось z совпадает с главной осью инерции, проходящей через центр масс, то имеет место векторное равенство
|
|
|

где J - главный момент инерции тела (момент инерции относительно главной оси).
| 12.Статистический и термодинамический методы исследования. Термодинамические параметры.Идеальный газ. Изопроцессы.Законы, описывающие поведение идеальных газов Молекулярная физика представляет собой раздел физики, изучающий строение и свойства вещества, исходя из так называемых молекулярно-кинетических представлений. Молекулы всякого вещества находятся в беспорядочном, хаотическом, не имеющем какого-либо преимущественного направления движении. Термодинамика— раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями термодинамической системой— совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами Основа термодинамического метода — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) —совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом. В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что: 1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Процесс при котором T= const называется –изотермическим, если сохраняется P=const- изобарный, и если V=const-изохорный. Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV=constпри T=const, m=const (7) Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно: V=V0(1+αt) при p=const, m=const (8) Здесь t - температура по шкале Цельсия, V0 - объем газа при 0 oС, α=(1/273) K-1 - температурный коэффициент объемного расширения газа. Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой: p=p0(1+αt) при p=const, m=const (9) Здесь t - температура по шкале Цельсия, p0 - давление газа при 0 oС, α=(1/273) K-1 - температурный коэффициент объемного расширения газа. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pn входящих в нее газов: p=p1+p2+....+pn Парциальное давление – давление, которое создавал бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре. Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. Так, при нормальных условиях один моль любого газа занимает объем 22,4 м-3. При одинаковых температуре и давлении любой газ содержит в единице объема одинаковое количество молекул. |
13. Уравнение состояния идеального газа
 Допустим, что в начальном состоянии (рис. 14, а) некоторая масса газа m имеет давление р1, объем V1 и температуру Т1. Оставив давление постоянным (рис. 14, б), нагреем газ до температуры Т2. Его объем увеличится и станет V' (промежуточное состояние). Переход газа из начального состояния в промежуточное произошел по закону Гей-Люссака:
Допустим, что в начальном состоянии (рис. 14, а) некоторая масса газа m имеет давление р1, объем V1 и температуру Т1. Оставив давление постоянным (рис. 14, б), нагреем газ до температуры Т2. Его объем увеличится и станет V' (промежуточное состояние). Переход газа из начального состояния в промежуточное произошел по закону Гей-Люссака:
 Оставив температуру газа без изменения, уменьшим его объем до V2 (рис. 14, в), при котором давление стало р2 (конечное состояние). Переход газа из промежуточного состояния в конечное произошел по закону Бойля-Мариотта:
Оставив температуру газа без изменения, уменьшим его объем до V2 (рис. 14, в), при котором давление стало р2 (конечное состояние). Переход газа из промежуточного состояния в конечное произошел по закону Бойля-Мариотта:
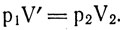 Выразив значения V' из первого и второго равенств:
Выразив значения V' из первого и второго равенств:
  и приравняв их:
и приравняв их:
 получим
получим
 Это уравнение состояния идеального газа, когда все его параметры меняются. Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная, как бы параметры состояния газа ни изменялись. В уравнении состояния идеального газа отношение
Это уравнение состояния идеального газа, когда все его параметры меняются. Для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная, как бы параметры состояния газа ни изменялись. В уравнении состояния идеального газа отношение  для различных масс газа имеет разное численное значение.
Уравнение состояния идеального газа или ура-иеКлапейрона- Менделеева
pV0 = RT.
R - универсальная газовая постоянная, она одинакова для всех газов. Выясним ее физический смысл: для различных масс газа имеет разное численное значение.
Уравнение состояния идеального газа или ура-иеКлапейрона- Менделеева
pV0 = RT.
R - универсальная газовая постоянная, она одинакова для всех газов. Выясним ее физический смысл:
 Из наименования видно, что универсальная газовая постоянная равна работе, которую может совершить 1 кмоль идеального газа при его изобарическом нагревании на 1°.
Если при нормальных условиях масса газа будет n кмолей, то ее объем V = V0n.
Тогда
Из наименования видно, что универсальная газовая постоянная равна работе, которую может совершить 1 кмоль идеального газа при его изобарическом нагревании на 1°.
Если при нормальных условиях масса газа будет n кмолей, то ее объем V = V0n.
Тогда
 или
pV = nRT.
или
pV = nRT.
|
14. Основное уравнение молекулярно-кинетической теории идеальных газов. Среднее число столкновений и средняя длина свободного пробега молекул.
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТвыражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n.
Сталкиваясь со стенками сосуда, одна молекула за одну секунду сообщает ей импульс
 Если газ содержит n-число молекул, движущихся с разными скоростями то целесообразно вводить среднюю скорость
Если газ содержит n-число молекул, движущихся с разными скоростями то целесообразно вводить среднюю скорость
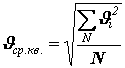 Тогда
Тогда
 , (11) где n , (11) где n  –концентрация молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Скорости, которые характеризуют состояние газа: 1) наиболее вероятная –концентрация молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Скорости, которые характеризуют состояние газа: 1) наиболее вероятная  2) средняя
2) средняя  3) средняя квадратичная
3) средняя квадратичная  длина пути между последовательными столкновениями различна, но так как мы имеем дело с очень большим числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул
длина пути между последовательными столкновениями различна, но так как мы имеем дело с очень большим числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул  Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d
Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d
Среднее число столкновений за 1 с равно числу молекул в объеме, так называемого ломаного цилиндра:  где n — концентрация молекул, V = πd2<v> ,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом,среднее число столкновений где n — концентрация молекул, V = πd2<v> ,где <v> — средняя скорость молекулы или путь, пройденным ею за 1 с). Таким образом,среднее число столкновений  Расчеты показывают, что при учете движения других молекул Расчеты показывают, что при учете движения других молекул  Тогда средняя длина свободного пробега Тогда средняя длина свободного пробега  т. е. <l> обратно пропорциональна концентрации n молекул. С другой стороны, p=nkt. Значит, т. е. <l> обратно пропорциональна концентрации n молекул. С другой стороны, p=nkt. Значит, 
|
14. 
|
|
|
|
|
|
|
|
|

Среднее число столкновений за 1 секунду = числу молекул в объеме
<Z>= 
15.  .
.
n=n0 
15.Барометрическая формула (без вывода).Частным случаем распределения Больцмана является барометрическая формула,к-т. выводится из распределения Больцмана
nh=n0 e-mgh/kT (1)
nh– концентрация молекул воздуха на высоте h
n0- концентрация молекул на высоте h=0
Умножим выр.(1) на kT, получим:
nhkT=n0 kT e-mgh/kT
Ph=P0 e-mgh/kT
Ph=P0 e-Mgh/RT
Из барометр. формулы следует, что давление газа с увелич. высоты уменьшается.
Распределение Больцмана. Распределение Максвелла получено в предположении, что внешнее силовое воздействие на молекулы газа отсутствует. БОЛЬЦМАН установил, что при наличии действия консервативных сил на молекулы газа, то молекулы газа распределяются по значениям их потенциальной энергии в соответствии с выражением
nW=n0 e-W/kT
где nW-число молекул, облад.потенц.энергией; n0-число молекул с minWп(общее число газовых молекул)
16. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии
Число степеней молекул- число независимой величины полностью определяющее положение системы в пространстве. Для одноатомного газа-=3 2-х атомного =5 остальные =6
Работа газа при изменении его обьемаdA=pdV
17. удельная теплоемкость- величина равная количеству теплоты необходимой для нагревания одного килограмма в-ва на 1К 
Удельная теплоемкость связана с молекулярной соотношениемCmdT=dUm+pdVm
теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:

|
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT[1]:
{\displaystyle C={\delta Q \over \delta T}.}
18.Изохорный процесс не совершаеться работа над внешними телами dA=pdV=odQ=dU
Для произвольной массы газа dQ=dU=m/MCvdT
При изобарном процессе A= 
Для произвольной массы газа A=m/MR(T2-T1) dQ=m/MCpdTdU=m/MCvdt
При изoтермическом процессе dQ=dA
Для произвольной массы газа Q=A=m/MRTLnp1/p2
Дата добавления: 2018-05-12; просмотров: 894; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
