Работа газа при изменении его объема
Министерство образования и науки РФ “Калмыцкий государственный университет имени Б.Б.Городовикова ”
Реферат
По Физики на тему: Внутренняя энергия термодинамической системы. Работа системы при изменении её объёма. Капиллярные явления. Поверхностное натяжение.
Выполнил: студент группы ПО-12 ШукуровАзизбек
Внутренняя энергия термодинамической системы
Внутренняя энергия термодинамической системы U – энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер) и энергия взаимодействия этих частиц.
К внешней энергии не относится кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Важнейшее свойство внутренней энергии: внутренняя энергия зависит только от температуры U = BT (В – коэффициент пропорциональности, который остается постоянным в весьма широком интервале температур).
Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в любом состоянии система обладает вполне определенной внутренней энергией, причем при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
Внутренняя энергия 1 моль идеального газа. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют, то внутренняя энергия 1 моль идеального газа равна сумме кинетических энергий  молекул). Внутренняя энергия 1 моль газа:
молекул). Внутренняя энергия 1 моль газа:
 .
.
Для произвольной массы газа:
 ,
,
где М – молярная масса; K – постоянная Больцмана; R – универсальная газовая постоянная;  - число Авогадро; i – число степеней свободы.
- число Авогадро; i – число степеней свободы.
Первое начало термодинамики
Рассмотрим термодинамическую систему. Внутренняя энергия системы может изменяться в результате: 1) совершения над системой работ (сжатие газа); 2) передача некоторого количества теплоты – теплообмен.
Таким образом, существует две формы передачи энергии от одних тел к другим: работа и теплота. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях выполняется закон сохранения и превращения энергий.
Первое начало термодинамики – закон сохранения и превращения энергии применительно к термодинамическим системам.
Пусть система находясь в состоянии 1 с внутренней энергией  . Получив некоторое количество теплотыQ, система перешла в состояние 2 с внутренней энергией
. Получив некоторое количество теплотыQ, система перешла в состояние 2 с внутренней энергией  и совершила работуА против внешних сил.
и совершила работуА против внешних сил.
В соответствии с законом сохранения энергии при любом переходе из состояния 1 в состояние 2, изменение внутренней энергии будет одинаковым равным разности между полученной теплотой Q и работой А против внешних сил:
 .
.
Первое начало термодинамики:
 .
.
Теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
В более корректной форме:
 ,
,
где  - бесконечно малое изменение внутренней энергии системы;
- бесконечно малое изменение внутренней энергии системы;  - бесконечно малое количество теплоты;
- бесконечно малое количество теплоты;  - элементарная работа.
- элементарная работа.
Вторая формулировка: вечный двигатель первого рода (двигатель, который совершил бы работу большую, чем сообщенная извне энергия) невозможен. Доказательство: если система периодически возвращается в исходное состояние, то  . Тогда
. Тогда  , следовательно, вечный двигатель первого рода невозможен.
, следовательно, вечный двигатель первого рода невозможен.
Работа газа при изменении его объема
Найдем в общем виде работу, совершаемую газом при изменении его объема:

Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде. Если газ расширяется, то он передвигает поршень на бесконечно малое расстояние dx и совершает над газом работу:
 ,
,
где S – площадь поршня;  - изменение объема системы.
- изменение объема системы.
Таким образом,  .
.
Полная работа, совершаемая газом при изменении его объема от  до
до  найдем интегрированием этого выражения:
найдем интегрированием этого выражения:
 .
.
Это выражение справедливо при любых изменениях объемов твердых, жидких и газообразных тел.
Графическое представление работы.

Равновесный процесс – процесс, в котором система проходит непрерывный ряд бесконечно близких термодинамически равновесных состояний (изменение термодинамических параметров за конечный промежуток времени бесконечно мало). Все реальные процессы неравновесны, но в ряде случаев неравновесностью реальных процессов можно пренебречь: чем медленнее процесс, тем он ближе к равновесному. Графически можно изображать только равновесные процессы. Изменение давления газа при его расширении задано на рисунке продольной кривой. При увеличении объема на dV совершаемая газом работа равна PdV, т.е. определяется площадью заштрихованной полоски. Полная работа, совершаемая газом при расширении от объема  до объема
до объема  , определяется площадью ограниченной осью абсцисс, кривой
, определяется площадью ограниченной осью абсцисс, кривой  и прямыми
и прямыми  и
и  .
.
Внутренняя энергия Вну́тренняяэне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:

где
-
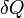 — подведённая к телу теплота, измеренная в джоулях
— подведённая к телу теплота, измеренная в джоулях -
 [1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
[1] — работа, совершаемая телом против внешних сил, измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:

где
-
 — температура, измеренная в кельвинах
— температура, измеренная в кельвинах -
 — энтропия, измеренная в джоулях/кельвин
— энтропия, измеренная в джоулях/кельвин -
 — давление, измеренное в паскалях
— давление, измеренное в паскалях -
 — химический потенциал
— химический потенциал -
 — количество частиц в системе
— количество частиц в системе
Идеальные газы
Согласно закону Джоуля, выведенному эмпирически, внутренняя энергия идеального газа не зависит от давления или объёма. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме,  . Так как внутренняя энергия идеального газа является функцией только от температуры, то
. Так как внутренняя энергия идеального газа является функцией только от температуры, то
 .
.
Эта же формула верна и для вычисления изменения внутренней энергии любого тела, но только в процессах при постоянном объёме (изохорных процессах); в общем случае CV(T,V) является функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
ΔU = νCVΔT,
где ν — количество вещества, ΔT — изменение температуры.
Капиллярные явления
Капиллярные явления, поверхностные явления на границе жидкости с др. средой, связанные с искривлением ее поверхности. Искривление поверхности жидкости на границе с газовой фазой происходит в результате действия поверхностного натяжения жидкости, которое стремится сократить поверхность раздела и придать ограниченному объему жидкости форму шара. Поскольку шар обладает минимальной поверхностью при данном объеме, такая форма отвечает минимуму поверхностной энергии жидкости, т.е. ее устойчивому равновесному состоянию. В случае достаточно больших масс жидкости действие поверхностного натяжения компенсируется силой тяжести, поэтому маловязкая жидкость быстро принимает форму сосуда, в который она налита, а ее своб. поверхность представляется практически плоской.
В отсутствие силы тяжести или в случае очень малых масс жидкость всегда принимает сферическую …
форму (капля), кривизна поверхности которой определяет мн. свойства вещества. Поэтому капиллярные явления ярко выражены и играют существенную роль в условиях невесомости, при дроблении жидкости в газовой среде (или распылении газа в жидкости) и образовании систем, состоящих из многих капель или пузырьков (эмульсий, аэрозолей,пен), при зарождении новой фазы капель жидкости при конденсации паров. пузырьков пара при вскипании, зародышей кристаллизации. При контакте жидкости с конденсированными телами (другой жидкостью или твердым телом) искривление поверхности раздела происходит в результате действия межфазного натяжения.
В случае смачивания, например, при соприкосновении жидкости с твердой стенкой сосуда, силы притяжения, действующие между молекулами твердого тела и жидкости, заставляют ее подниматься по стенке сосуда, вследствие чего примыкающий к стенке участок поверхности жидкости принимает вогнутую форму. В узких каналах, например, цилиндрических капиллярах, образуется вогнутый мениск — полностью искривленная поверхность жидкости (рис. 1).

Рис. 1. Капиллярное поднятие на высоту h жидкости, смачивающей стенки капилляра радиуса r; q — краевой угол смачивания.
Капиллярное давление. Так как силы поверхностного (межфазного) натяжения направлены по касательной к поверхности жидкости, искривление последней ведет к появлению составляющей, направленной внутрь объема жидкости. В результате возникает капиллярное давление, величина которого Dp связана со средним радиусом кривизны поверхности r0 уравнением Лапласа:
Dp = p1 — p2 = 2s12/r0, (1)
где p1 и p2— давления в жидкости 1 и соседней фазе 2 (газе или жидкости), s12 — поверхностное (межфазное) натяжение.
Если поверхность жидкости вогнута (r0<0), давление в ней оказывается пониженным по сравнению с давлением в соседней фазе p1 < р2 и Dp< 0. Для выпуклых поверхностей (r0 > 0) знак Dp изменяется на обратный. Отрицательное капиллярное давление, возникающее в случае смачивания жидкостью стенок капилляра, приводит к тому, что жидкость будет всасываться в капилляр до тех пор, пока вес столба жидкости высотой h не уравновесит перепад давления Dp. В состоянии равновесия высота капиллярного поднятия определяется формулой Жюрена:

где r1 и r2 — плотности жидкости 1 и среды 2, g — ускорение силы тяжести, r — радиус капилляра, q — краевой угол смачивания. Для несмачивающих стенки капилляра жидкостей cos q < 0, что приводит к опусканию жидкости в капилляре ниже уровня плоской поверхности (h < 0).
Из выражения (2) следует определение капиллярной постоянной жидкости а = [2s12/(r1 — r2)g]1/2. Она имеет размерность длины и характеризует линейный размер Z [ а, при котором становятся существенными капиллярные явления Так, для воды при 20 °С а = 0,38 см. При слабой гравитации (g : 0) значение а возрастает. На участке контакта частиц капиллярная конденсация приводит к стягиванию частиц под действием пониженного давления Dp< 0.
Уравнение Кельвина. Искривление поверхности жидкости приводит к изменению над ней равновесного давления пара рпо сравнению с давлением насыщенного пара ps над плоской поверхностью при той же температуре Т. Эти изменения описываются уравнением Кельвина:

где  — молярный объем жидкости, R — газовая постоянная. Понижение или повышение давления пара зависит от знака кривизны поверхности: над выпуклыми поверхностями (r0 > 0) p >ps; над вогнутыми (r0 < 0) р<рs. . Так, над каплями давление пара повышено; в пузырьках, наоборот, понижено.
— молярный объем жидкости, R — газовая постоянная. Понижение или повышение давления пара зависит от знака кривизны поверхности: над выпуклыми поверхностями (r0 > 0) p >ps; над вогнутыми (r0 < 0) р<рs. . Так, над каплями давление пара повышено; в пузырьках, наоборот, понижено.
На основании уравнения Кельвина рассчитывают заполнение капилляров или пористых тел при капиллярной конденсации.Так как значения р различны для частиц разных размеров или для участков поверхности, имеющей впадины и выступы, уравнение (3) определяет и направление переноса вещества в процессе перехода системы к состоянию равновесия. Это приводит, в частности, к тому, что относительно крупные капли или частицы растут за счет испарения (растворения) более мелких, а неровности поверхности некристаллические тела сглаживаются за счет растворения выступов и залечивания впадин. Заметные различия давления пара и растворимости имеют место лишь при достаточно малых r0 (для воды, например, при r0 [ 0,1 мкм). Поэтому уравнение Кельвина часто используется для характеристики состояния коллоидных систем и пористых тел и процессов в них.

Рис. 2. Перемещение жидкости на длину l в капилляре радиуса r; q — краевой угол.
Капиллярная пропитка. Понижение давления под вогнутыми менисками — одна из причин капиллярного перемещения жидкости в сторону менисков с меньшим радиусом кривизны. Частным случаем этого является пропитка пористых тел — самопроизвольное всасывание жидкостей в лиофильные поры и капилляры (рис. 2). Скорость v перемещения мениска в горизонтально расположенном капилляре (или в очень тонком вертикальном капилляре, когда влияние силы тяжести мало) определяется ур-ниемПуазёйля:

где l — длина участка впитавшейся жидкости, h — ее вязкость, Dp — перепад давления на участке l, равный капиллярному давлению мениска: Dp = — 2s12cos q/r. Если краевой угол q не зависит от скорости v, можно рассчитать количество впитавшейся жидкости за время t из соотношения:
l(t) = (rts12cos q/2h)l/2. (5)
Если q есть функция v, то l и v связаны более сложными зависимостями.
Уравнения (4) и (5) используют для расчетов скорости пропитки при обработке древесины антисептиками, крашении тканей, нанесении катализаторов на пористые носители, выщелачивании и диффузионном извлечении ценных компонентов горных пород и др. Для ускорения пропитки часто используют ПАВ, улучшающие смачивание за счет уменьшения краевого угла q. Один из вариантов капиллярной пропитки — вытеснение из пористой среды одной жидкости другой, не смешивающейся с первой и лучше смачивающей поверхность пор. На этом основаны, например, методы извлечения остаточной нефти из пластов водными растворами ПАВ, методы ртутной порометрии. Капиллярное впитывание в поры растворов и вытеснение из пор несмешивающихся жидкостей, сопровождающиеся адсорбцией и диффузией компонентов, рассматриваются физико-химической гидродинамикой.
Помимо описанных равновесных состояний жидкости и ее движения в порах и капиллярах, ккапиллярные явления относят также равновесные состояния очень малых объемов жидкости, в частности тонких слоев и пленок. Эти капиллярные явления часто называют капиллярные явления II рода. Для них характерны, например, зависимость поверхностного натяжения жидкости от радиуса капель и линейное натяжение. Капиллярные явления впервые исследованы Леонардо да Винчи (1561), Б. Паскалем (17 в.) и Дж. Жюреном (18 в.) в опытах с капиллярными трубками. Теория капиллярных явлений развита в работах П. Лапласа (1806), Т. Юнга (1804), А. Ю. Давыдова (1851), Дж. У. Гиббса (1876), И. С. Громеки (1879, 1886). Начало развития теории капиллярных явлений II рода положено трудами Б. В. Дерягина и Л. М. Щербакова.
Поверхностное натяжение
Жидкости, так же как и твердые тела, обладают большой объемной упругостью, т.е. сопротивляются изменению своего объема, но, как и газы, не обладают упругостью формы. Поверхность жидкости, соприкасающейся с другой средой, например с ее собственным паром, с какой-либо другой жидкостью или с твердым телом (в частности, со стенками сосуда, в котором она содержится), находится в особых условиях по сравнению с остальной массой жидкости.
Возникают эти особые условия потому, что молекулы пограничного слоя жидкости, в отличие от молекул в ее глубине, окружены молекулами той же жидкости не со всех сторон. Часть «соседей» поверхностных молекул - это частицы второй среды, с которой жидкость граничит. Она, эта среда, может отличаться от жидкости как природой, так и плотностью частиц. Имея же разных соседей, молекулы поверхностного слоя и взаимодействуют с ними различным образом. Поэтому силы, действующие на каждую молекулу в этом слое, оказываются неуравновешенными: существует некоторая равнодействующая сила, направленная либо в сторону объема жидкости, либо в сторону объема граничащей с ней среды. Вследствие этого перемещение молекулы из поверхностного слоя в глубь жидкости или в глубь среды, с которой она граничит, сопровождается совершением работы (внутри жидкости молекулы, со всех сторон окруженные точно такими же частицами, находятся в равновесии, и их перемещение истребует затраты работы Величина и знак этой работы зависят от соотношения между силами взаимодействия молекул поверхностного слоя со «своими» же молекулами и с молекулами второй среды.
В случае, если жидкость граничит со своим собственным паром (насыщенным), т. е. в случае, когда мы имеем дело с одним веществом, сила, испытываемая молекулами поверхностного слоя, направлена внутрь жидкости. Это объясняется тем, что плотность молекул в жидкости много больше, чем в насыщенном паре над жидкостью (вдали от критической температуры), и поэтому сила притяжения, испытываемая молекулой поверхностного слоя со стороны молекул жидкости, больше, чем со стороны молекул пара.
Отсюда следует, что, перемещаясь из поверхностного слоя внутрь жидкости, молекула совершает положительную работу. Наоборот, переход молекул из объема жидкости к поверхности сопровождается отрицательной работой, т. е. требует затраты внешней работы.
Представим себе, что по тем или иным причинам поверхность жидкости увеличивается (растягивается). Это значит, что некоторое количество молекул переходит из объема жидкости в поверхностный слой. Для этого, как мы только что видели, надо затратить внешнюю работу. Другими словами, увеличение поверхности жидкости сопровождается отрицательной работой. Наоборот, при сокращении поверхности совершается положительная работа.
Если при постоянной температуре обратимым путем изменить поверхность жидкости на бесконечно малую величину dS, то необходимая для этого работа
| (1) |

Знак минус указывает на то, что увеличение поверхности (dS > 0) сопровождается отрицательной работой.
Коэффициент  является основной величиной, характеризующей свойства поверхности жидкости, и называется коэффициентом поверхностного натяжения (
является основной величиной, характеризующей свойства поверхности жидкости, и называется коэффициентом поверхностного натяжения (  > 0). Следовательно, коэффициент поверхностного натяжения измеряется работой, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
> 0). Следовательно, коэффициент поверхностного натяжения измеряется работой, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
Очевидно, в системе СИ  имеет размерность
имеет размерность  .
.
Из сказанного ясно, что молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами, находящимися в объеме жидкости, потенциальной энергией. Обозначим ее  . Эта энергия, как всегда, измеряется работой, которую могут совершить молекулы поверхности, перемещаясь внутрь жидкости под действием сил притяжения со стороны молекул в объеме жидкости.
. Эта энергия, как всегда, измеряется работой, которую могут совершить молекулы поверхности, перемещаясь внутрь жидкости под действием сил притяжения со стороны молекул в объеме жидкости.
Поскольку энергия  обязана своим происхождением наличию поверхности жидкости, то она должна быть пропорциональна площади S поверхности жидкости:
обязана своим происхождением наличию поверхности жидкости, то она должна быть пропорциональна площади S поверхности жидкости:
| (2) |

Тогда изменение площади поверхности dS повлечет за. собой изменение потенциальной энергии
 ,
,
которое сопровождается работой

в полном соответствии с (1).
Если, как было указано, изменение поверхности S осуществляется при постоянной температуре, т. е. изотермически (и обратимо), то, как известно, потребная для этого работа равна изменению свободной энергии F поверхности:

| (3) |
(Если изменение поверхности жидкости произвести адиабатно, то ее температура изменится. Например, увеличение поверхности приведет к ее охлаждению.) Значит, избыточная потенциальная энергия поверхности жидкости, о которой говорилось выше, является свободной энергией поверхности и, следовательно,

т. е. коэффициент поверхностного натяжения жидкости можно определить как свободную энергию единицы площади этой поверхности.
Теперь ясно, в чем заключаются указанные выше особые условия, в которых находится поверхность жидкости. Они заключаются в том, что поверхность жидкости обладает избыточной по сравнению с остальной массой жидкости потенциальной (свободной) энергией. Посмотрим, к чему это приводит.
Известно, что всякая система при равновесии находится в том из возможных для нее состояний, при котором ее энергия имеет минимальное значение. Применительно к рассматриваемому случаю это означает, что жидкость в равновесии должна иметь минимально возможную поверхность. Это в свою очередь означает, что должны существовать силы, препятствующие увеличению поверхности жидкости, т. е. стремящиеся сократить эту поверхность.
Очевидно, что эти силы должны быть направлены вдоль самой поверхности, по касательной к ней. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения.
Нужно, однако, помнить, что первопричиной возникновения сил поверхностного натяжения являются силы, испытываемые молекулами поверхностного слоя, направленные внутрь жидкости, а в некоторых случаях внутрь той среды, с которой она граничит, т. е. перпендикулярно к поверхности.
Для разрыва, или, как говорят, для раздела поверхности необходимо приложить внешние силы, параллельные к поверхности и перпендикулярные к той линии, вдоль которой предполагается разрыв (раздел).
 Рис. 1
Рис. 1
|
Дата добавления: 2018-05-12; просмотров: 4762; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
