ПОСЛЕДОВАТЕЛЬНОЕ И ПАРАЛЛЕЛЬНОЕ СОЕДИНЕНИЯ ПРОВОДНИКОВ
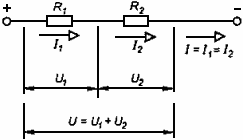 Для последовательного соединения проводников справедливы законы:
Для последовательного соединения проводников справедливы законы:
1. Сила тока во всех проводниках одинакова.
2. Напряжение на всём соединении равно сумме напряжений на отдельных проводниках.
3. Сопротивление всего соединения равно сумме сопротивлений отдельных проводников.
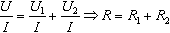 I=I1=I2, U=U1+U2,
I=I1=I2, U=U1+U2,
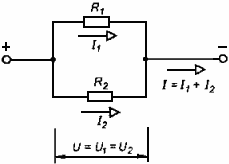 Для параллельного соединения справедливы законы:
Для параллельного соединения справедливы законы:
1. Напряжение на всех проводниках одинаково.
2. Сила тока в точке соединения проводников равна сумме токов в отдельных проводниках.
3. Сопротивление всего соединения равно величине, обратной от суммы величин, обратных сопротивлениям отдельных проводников.
I=I1+I2, U=U1=U2, 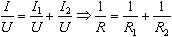
Закон Джоуля-Ленца
Если в цепи есть ток, провода, составляющие цепь, нагреваются. Трудно заметить нагревание провода 4 мм2, когда по нему проходит ток 5 А. Но попробуйте пропустить через такой провод ток 200 А – провод сильно нагреется. Если же взять провод сечением 120 мм2, то нагревание, при прохождении по нему тока 200 А, также будет незначительным. Но нагревание проводов, хотя и слабое, всё же обязательно сопутствует току. Чем больше ток в проводах, тем сильнее они греются. Нагревание проводов током служило предметом исследований академика Ленца в Петербурге в первой половине 19 века. Независимо от него такие же исследования в Англии проводил Джоуль. Открытый ими закон и получил название закона Джоуля-Ленца:
|
|
|
Q = 0,24·I·U·t ; [Дж] либоQ = 0,24·I2·R·t;
гдеQ –количество тепла, выделяемое в проводнике,
t – время прохождения тока.
Основы электрохимии. Электрический ток в электролитах.
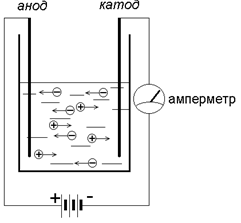 Электропроводность растворов или расплавов солей (электролитов) изучает наука – электрохимия.
Электропроводность растворов или расплавов солей (электролитов) изучает наука – электрохимия.
Если мы соберем прибор с электродами из графита, помещённых в раствор электролита CuSO4, то убедимся, что стрелка амперметра отклоняется – через раствор идет ток. Через электролит электроны «самостоятельно» почти не проходят, должен произойти разрыв цепи. Причиной электропроводности растворов некоторых веществ, являются ионы, которые образуются при растворении соли в воде. При растворении в воде молекула CuSO4 распадается (диссоциирует) на два разнозаряженных иона – Cu2+ и SO42-. Упрощенно происходящие процессы можно отразить следующей формулой:
CuSO4ÞCu2++SO42-
Положительно заряженный ион Cu2+ (катион) притягивается к отрицательно заряженному электроду – катоду, где получает недостающие электроны и восстанавливается до металлической меди – простого вещества. Если извлечь катод из прибора после прохождения через раствор тока, то нетрудно заметить красно-рыжий налет – это металлическая медь. Отрицательно заряженный ион SO42- (анион) притягивается к положительно заряженному электроду – аноду, где отдаёт свои лишние электроны. Таким образом, электроны как бы «перемещаются» с катода на анод – цепь замыкается.
|
|
|
Вещества, растворы или расплавы которых проводят электрический ток, называютсяэлектролитами.
Дата добавления: 2018-05-12; просмотров: 487; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
