Алканы (предельные УВ) вступают в реакции
Лабораторная работа №6.
Механизмы реакций предельных, непредельных, ароматических УВ и галогенпроизводных углеводородов.
Качественные реакции и способы обнаружения предельных, непредельных и ароматических УВ.
Цель работы: обобщить знания о механизмах реакций предельных, непредельных и ароматических УВ и галогенпроизводных УВ.
Выполнение эксперимента: не предусмотрено, ввиду высокого класса опасности используемых реактивов.
Задача 1. Повторите приведенные ниже понятия. Заполните недостоющие определения.
Химическая реакция–взаимодействие молекул, при котором в рассматриваемой системе происходит перераспределение атомов и атомных групп между молекулами, т. е. разрыв старых и образование новых связей.
Реакционным центром называют ____________ или ___________, участвующих в разрыве или образовании связей. Способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью характеризует его реакционную способность, которая всегда рассматривается по отношению к конкретному партнеру реакции.
В одном веществе могут одновременно находится несколько различных реакционных центров, вступающих в реакции, в зависимости от условий проведения реакции или наличия ______________________.
Исходные соединения в органических реакциях называют реагентами, а образующиеся вещества – продуктами. Для удобства принято одно из реагирующих веществ называть атакующим реагентом, а другое – субстратом.
|
|
|
Субстрат– одно из реагирующих веществ, имеющее, как правило, более __________ (сложное/простое) строение, которое рассматривается в качестве объекта превращения и содержит реакционный центр, чаще всего атом углерода. Как правило, субстратом обозначают ту молекулу, которая поставляет атом углерода для новой связи
Классификация реакционных центров в органической химии
1) ___________________, заряжен ______________ или _______________________________________________________________
(примеры: __________________________________________), в реакциях
атака этого реакционного центра происходит __________ реагентом.
2) ___________________, заряжен __________________ (примеры:
______________________________), в реакциях атака __________ __________________, атака __________ реагентом
3) В насыщенных УВ в качестве реакционного центра выступает ___________ гибридизованный атом углерода, в реакциях атака __________
Таблица 1
Классификация реагентов
| Радикалы R∙– частицы со свободными электронами: | Электрофилы ЕÅ– частицы с вакантной орбиталью: | Нуклеофилы Nu‾– частицы со свободными электронными парами: |
| 1. Атомы: F ·, Cl · , Br · , I ·, H ·. 2. Группы атомов (частицы) с неспаренным электроном: ·NO2 , ·CH3, ·OOR, ·OH, ·R др. | 1. Катионы: ClÅ , BrÅ , Å NO2 и др. 2. Нейтральные электрофилы: ðAlCl3,ðBF3, ðSnCl4,SO3 и др. | 1. Анионы:
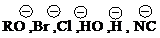 и др.
2. Нейтральные нуклеофилы: и др.
2. Нейтральные нуклеофилы:
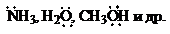 3. Доноры p-электронов:
3. Доноры p-электронов:
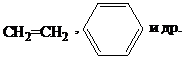
|
|
|
|
В реакциях, сопровождающихся гетеролитическим разрывом связи, реагент обычно или отдает электронную пару субстрату, или принимает ее. Реагенты, которые отдают электронную пару называют _________________, а их реакции – нуклеофильными. Электрофильные реагенты (электрофилы)– реагенты, которые __________________электронную пару для образования связи с субстратом. Их реакции называют электрофильными.
При расщеплении молекулы субстрата часть ее, не содержащую атома углерода, называют уходящей группой. Уходящую с электронной парой группу называют нуклеофугом, а группу, уходящую без электронной пары, – электрофугом.
При гомолитическом разрыве связи реагент предоставляет субстрату ___________________ (спаренный или неспаренный) электрон для образования связи, т. е. является радикалом или атомом.
По характеру разрыва связей реакции подразделяют на радикальные, ионные.
Гомолитическая (радикальная) реакция– реакция, протекающая с участием радикалов, которые образуются при гомолитическом разрыве связей. Свободный радикал (радикал)–частица, имеющая неспаренный валентный электрон.
|
|
|
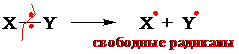
Гомолитические реакции характерны для неполярных реагентов, их протеканию способствует высокая температура, УФ облучение, присутствие перекисных соединений как инициаторов радикальных процессов.
Ионные реакции протекают при гетеролитическом разрыве связей. При этом образуются электрофильные и нуклеофильные частицы:

Ионнные реакции характерны для полярных соединений, их протеканию способствуют полярные апротонные и протонные растворители и катализаторы, в качестве которых зачастую выступают кислоты или основания.
По типу превращения субстрата реакции делят на следующие типы: реакции замещения (символ______ от англ. substitution)– реакции, в которых атом либо группа атомов в субстрате замещается на другой атом либо группу атомов. Замещение в зависимости от атакующего реагента может быть радикальное, электрофильное или нуклеофильное и обозначается, соответственно, символами SR, SE и SN.
Реакции присоединения (символ _________ от англ. addition)– реакции, в которых реагент присоединяется по месту разрыва кратной связи субстрата. Эти реакции также могут происходить по радикальному или ионному механизмам и обозначаются как AR, AE или AN.
|
|
|
Реакции отщепления или элиминирования (символ Е от англ. elimination)– реакции, в которых от субстрата отщепляется молекула или частица. По направлению обратны реакциям присоединения:
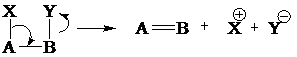
Эти реакции могут происходить либо по гетеролитическому, либо по согласованному механизму, а вот свободнорадикальное элиминирование наблюдается крайне редко. При гетеролитическом отщеплении группы Х и Y могут уходить как последовательно, так и одновременно, при этом возможно их объединение.
Окислительно-восстановительные реакции – это реакции, в ходе которых меняется степень окисления у реакционного центра. Окисление органического соединения сопровождается переходом электронов от него к реагенту, а восстановление, наоборот, переходом электронов к органическому субстрату.
Окисление органических соединений – это процесс удаления водорода с образованием кратной связи или связи с более электроотрицательным атомом. При восстановлении протекают обратные процессы. Окислительно-восстановительный переход от метана к диоксиду углерода отражает последовательность окисления атома углерода в органических соединениях:
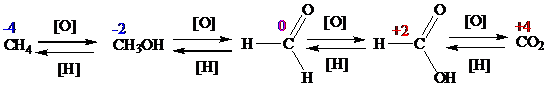
По типу активирования реакции разделяют на каталитические и некаталитические.
Некаталитические реакции протекают без катализатора. Эти реакции ускоряются при нагревании и их называют термическими.
Каталитические реакции требуют присутствия катализатора. Катализ– явление, состоящее в том, что присутствие в системе какого-либо вещества (катализатора) вызывает или ускоряет протекание химической реакции. Катализатор– вещество, которое участвует в химической реакции и увеличивает ее скорость, но при этом общее количество этого вещества не изменяется, т. е. катализатор остается в неизменном виде и количестве. Гетерогенный катализ– процесс, в котором реакция протекает на поверхности раздела фаз, образуемой катализатором и реагентом. Гомогенный катализ – процесс, в котором катализатор находится в молекулярно-дисперсном состоянии и равномерно распределен во всем объеме жидкой или газовой фазы. Если в качестве катализатора выступает кислота, говорят о кислотном катализе, а если основание – об основном катализе.
Фотохимические реакции – реакции, инициируемые облучением светом. Для обозначения фотохимической активации реакции применяют обозначение hv.
Задание 2. Заполните пропущенные определения. Напишите уравнения химических реакций. Укажите условия протекания реакций и необходимые катализаторы. Назовите продукты реакций по систематической номенклатуре.
Алканы (предельные УВ) вступают в реакции
I. _____________________ замещения на атом галогена или нитрогруппу.
1) ________________________ (название реакции; реагент – молекула галогена)
Уравнение химической реакции на примере изобутана:
2) ________________________ (название реакции; реагент – __________
Разбавленная/концентрированная
азотная кислота)
Уравнение химической реакции на примере неопентана:
_______________________________________________________________________
II. _____________________ окисления.
Каталитического/некаталитического
Уравнение химической реакции на примере бутана:
«Большие» циклоалканы (предельные УВ) вступают в реакции
I. _____________________ замещения на атом галогена или нитрогруппу.
1) ________________________ (название реакции; реагент – молекула галогена)
Уравнение химической реакции на примере гексана:
1) ________________________ (название реакции; реагент – азотная кислота __________ )
Уравнение химической реакции на примере пентана:
_______________________________________________________________________
II. _____________________ окисления.
Каталитического/некаталитического
Уравнение химической реакции на примере гексана:
«Малые» циклоалканы (предельные УВ) вступают в реакции
I. _____________________ присоединения галогена, водорода,
галогенводорода.
1) ________________________ (название реакции; реагент – молекула галогена)
Уравнение химической реакции на примере пропана:
2) ________________________ (название реакции; реагент – молекула водорода)
Уравнение химической реакции на примере метилциклопентана:
_______________________________________________________________________
3) ________________________ (название реакции; реагент – молекула галогенводорода)
Уравнение химической реакции на примере метилциклопропана:
_______________________________________________________________________
Дата добавления: 2018-05-02; просмотров: 438; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
