Тема 1. Строение атома и периодическая система элементов Д.И.Менделеева
Министерство общего и профессионального
Образования РФ
Камский политехнический институт
Х И М И Я
Методические указания и контрольные задания для студентов заочного отделения
г. Набережные Челны
2008 г.
УДК 54(7)
Химия: Методические указания и контрольные задания для студентов заочного отделения. /Составители: Г.В.Маврин. Набережные Челны: КамПИ, 2008.
Издание предназначено для студентов заочного отделения всех специальностей. В разработке приведены краткий теоретический материал по соответствующим темам, решение типовых задач и примеров, варианты контрольной работы по химии.
Табл. 6, библиогр. 6 назв.
Рецензент: кандидат химических наук, доцент И.Г.Газизов
Печатается по решению научно-методического совета Кам- ского политехнического института от «__»________2008 г.
Камский политехнический
институт, 2008 год
О Б Щ И Е У К А З А Н И Я
Выполнение контрольной работы является необходимым этапом самостоятельной работы студента при изучении химии. Зачтённая преподавателем контрольная работа служит основанием для допуска к сдаче экзамена.
При оформлении контрольной работы следует придерживаться следующих правил:
- все задачи должны строго соответствовать варианту и быть решены в последовательности, указанной в таблице вариантов;
|
|
|
- условия задач должны быть переписаны в тетрадь полностью;
- решения задач должны содержать краткие объяснения и комментарии к выполненным арифметическим действиям, ссылки на использованные при решении законы и правила;
- необходимо пользоваться современной научной химической номенклатурой;
- все величины должны быть выражены в единицах международной системы (СИ);
- на каждой странице необходимо оставлять поля (1/3 страницы) для замечаний рецензента.
Прежде чем приступать к решению той или иной задачи, следует изучить теоретические основы данного раздела и усвоить тот объём теоретического материала, который необходим для осознанного решения задачи. Полезно ознакомиться с решениями типовых задач и примеров, приведенными в настоящем пособии.
Выполненную контрольную работу следует направить на кафедру химии и экологии. Получив проверенную работу, в случае необходимости нужно исправить допущенные ошибки в той же тетради и сдать её на повторное рецензирование.
Таблица вариантов контрольного задания
| Вариант контрольной работы |
Номера задач по темам | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 | 1 21 41 61 81 101 121 141 161
2 22 42 62 82 102 122 142 162 3 23 43 63 83 103 123 143 163 4 24 44 64 84 104 124 144 164 5 25 45 65 85 105 125 145 165 6 26 46 66 86 106 126 146 166 7 27 47 67 87 107 127 147 167 8 28 48 68 88 108 128 148 168 9 29 49 69 89 109 129 149 169 10 30 50 70 90 110 130 150 170 11 31 51 71 91 111 131 151 171 12 32 52 72 92 112 132 152 172 13 33 53 73 93 113 133 153 173 14 34 54 74 94 114 134 154 174 15 35 55 75 95 115 135 155 175 16 36 56 76 96 116 136 156 176 17 37 57 77 97 117 137 157 177 18 38 58 78 98 118 138 158 178 19 39 59 79 99 119 139 159 179 20 40 60 80 100 120 140 160 180 1 22 43 63 85 106 127 148 161 2 23 44 64 86 107 128 149 162 3 24 45 65 87 108 129 150 163 4 25 46 66 88 109 130 151 164 5 26 47 67 89 110 131 152 165 6 27 48 68 90 111 132 153 166 7 28 49 69 91 112 133 154 167 | ||||||||||
Продолжение таблицы
| Вариант контр. работы |
Номера задач по темам | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 | 8 29 50 70 92 113 134 155 168 9 30 51 71 93 114 135 156 169 10 31 52 72 94 115 136 157 170 11 32 53 73 95 116 137 158 171 12 33 54 74 96 117 138 159 172 13 34 55 75 97 118 139 160 173 14 35 56 76 98 119 140 141 174 15 36 57 77 99 120 121 142 175 16 37 58 78 100 101 122 143 176 17 38 59 79 81 102 123 144 177
18 39 60 80 82 103 124 145 178 19 40 41 61 83 104 125 146 179 20 23 45 65 88 109 130 147 180 2 24 46 66 89 110 131 148 161 3 25 47 67 90 111 132 149 162 4 26 48 68 91 112 133 150 163 5 27 49 69 92 113 134 151 164 6 28 50 70 93 114 135 152 165 7 29 51 71 94 115 136 153 166 8 30 52 72 95 116 137 154 167 9 31 53 73 96 117 138 155 168 10 32 54 74 97 118 139 156 169 11 33 55 75 98 119 140 157 170 12 34 56 76 99 120 122 158 171 13 35 57 77 100 103 121 159 172 14 36 58 78 85 104 123 160 173 15 37 59 79 84 105 124 141 174 16 38 60 80 83 106 125 143 175 17 33 41 61 82 101 126 142 176 18 40 42 62 81 102 127 144 177 | ||||||||||
Продолжение таблицы
| Вариант контр. работы | Номера задач по темам | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 | 19 21 43 63 87 103 128 145 178 20 22 41 61 88 104 129 146 179 1 24 42 62 89 105 130 147 180 3 25 43 63 90 106 131 148 161 4 26 44 64 91 107 132 149 162 5 27 45 65 92 108 133 150 163 6 28 46 66 93 109 134 151 164 7 29 47 67 94 110 135 152 165 8 30 48 68 95 111 136 153 166 9 31 49 69 96 112 138 154 167 10 32 50 70 97 113 137 155 168 11 33 51 71 98 114 139 156 169 12 34 52 72 99 115 140 157 170 13 35 53 73 100 116 121 158 171 14 36 54 74 86 117 122 159 172 15 37 55 75 87 118 123 160 173 16 38 56 76 84 119 124 142 174 17 39 57 77 83 120 125 141 175 18 40 58 78 82 101 126 143 176 19 23 59 79 81 102 127 148 177 20 21 60 80 85 103 128 145 178
4 22 51 71 99 104 129 146 179 5 23 52 72 98 105 130 147 180 6 24 53 73 97 106 131 144 161 7 25 54 74 96 107 132 149 162 8 26 55 75 95 108 133 150 163 9 27 56 76 94 109 134 151 164 10 28 57 77 93 110 136 152 165 11 29 58 78 92 111 135 153 166 12 30 59 79 91 112 137 154 167 | ||||||||||
Продолжение таблицы
| Вариант контр. работы | Номера задач по темам | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 88 89 90 91 92 93 94 95 96 97 98 99 00 | 13 31 60 80 90 113 138 155 168 14 32 41 61 89 114 139 156 169 15 33 42 62 88 115 140 157 170 16 34 43 63 87 116 131 158 171 17 35 44 64 86 117 132 159 172 18 36 45 65 85 118 133 160 173 19 37 46 66 84 119 134 141 174 20 38 47 67 83 120 135 142 175 1 39 48 68 82 110 136 143 176 2 40 49 69 81 111 137 144 177 3 24 50 70 100 112 138 145 178 4 25 51 71 99 113 139 146 179 5 26 52 72 98 114 140 147 180 | ||||||||
Программа по дисциплине «ХИМИЯ»
Химия как часть естествознания. Предмет химии и её связь с другими науками. Значение химии в формировании мышления, в изучении природы и развитии техники. Химия и проблемы экологии.
Основные понятия химии (атом, молекула, химический элемент, изотопы). Стехиометрические законы. Законы сохранения.
Атом: ядро и электронная оболочка. Электрон, протон, нейтрон. Основные положения волновой механики. Волновые свойства электрона в атоме. Квантово-механическая орбиталь. Квантовые числа. Принципы формирования электронных оболочек атомов: принцип Паули, правило Хунда, принцип минимума энергии. Электронные формулы строения атомов и их графическое изображение.
Периодическая система элементов Д.И.Менделеева. Периодический закон. Изменение свойств химических элементов и их соединений.
Основные характеристики химической связи: длина, энергия, кратность. Типы химической связи (ковалентная полярная и неполярная связь, ионная, металлическая, водородная). Свойства веществ с различным типом связи. Метод валентных связей. s- и p-связи. Гибридизация атомных орбиталей и пространственное строение молекул.
Метод молекулярных орбиталей. Основные положения. Связывающие и разрыхляющие МО. Диаграммы образования молекул.
Межмолекулярные взаимодействия. Структура веществ в жидком и твердом состояниях. Газовое состояние. Комплексообразование.
Внутренняя энергия, энтальпия, теплота, работа. Первый закон термодинамики. Тепловые эффекты химических реакций. Стандартные энтальпии образования и сгорания веществ. Закон Гесса и следствия из него. Вычисление тепловых эффектов.
Второй закон термодинамики. Энтропия как мера вероятности. Стандартная энтропия вещества. Свободная энергия при постоянном давлении (энергия Гиббса) как критерий направления процесса. Энтальпийный и энтропийный факторы протекания процессов. Стандартная энергия Гиббса образования химических соединений и её использование в расчётах.
Гомо- и гетерогенные реакции. Обратимые химические реакции и химическое равновесие. Константа равновесия и способы её выражения. Смещение химического равновесия. Принцип Ле Шателье. Фазовые равновесия. Правило фаз Гиббса. Представление о диаграммах состояния.
Скорость гомо- и гетерогенных реакций. Закон действия масс и кинетические уравнения. Константа скорости. Влияние температуры и уравнение Аррениуса. Энергия активации. Стерический фактор. Неэлементарные реакции, примеры их механизмов. Колебательные реакции.
Методы регулирования скорости химических реакций. Влияние катализатора на энергию активации. Гомогенный катализ. Гетерогенный катализ. Ферментативный катализ.
Классификация дисперсных систем по степени дисперсности: истинные растворы, коллоидные растворы, грубодисперсные системы. Классификация коллоидных систем и их свойства.
Применение правила фаз к двухкомпонентным системам. Общая характеристика растворов. Способы выражения концентрации растворов. Законы идеальных растворов. Растворы неэлектролитов и электролитов. Активность и коэффициент активности. Термодинамические свойства растворов. Особенности воды как растворителя. Водородный показатель среды рН. Ионные реакции в растворах. Буферные растворы.
Окислительно-восстановительные свойства простых и сложных веществ. Типы окислительно-восстановительных реакций.
Двойной электрический слой и электродные потенциалы. Уравнение Нернста. Гальванический элемент и его электродвижущая сила. Стандартный водородный электрод и ряд напряжений. Химические источники тока. Типы гальванических элементов.
Электролиз. Последовательность электродных процессов. Электролиз с растворимыми и нерастворимыми электродами. Законы Фарадея. Применение электролиза.
Коррозия. Основные виды коррозии. Химическая коррозия. Электрохимическая коррозия. Методы защиты от коррозии: легирование, защитные покрытия, электрохимическая защита. Ингибиторы коррозии.
Неметаллы. Углерод и его аллотропные формы. Стеклоуглерод и углеволокно. Кремний и его соединения. Силикаты. Стекло. Стекловолокно. Стеклопластики.
Легкие и тяжёлые конструкционные металлы.
Основные классы органических соединений. Углеводороды, кислород- и азотсодержащие соединения. Олигомеры и полимеры.
Биохимические системы: углеводы, жиры, полипептиды и белки, нуклеозиды, нуклеотиды и нуклеиновые кислоты. Комплементарность.
Мембраны и мембранные технологии. Биохимические процессы. Биотехнология.
Вещество и его чистота. Аналитический сигнал и его виды. Химический анализ. Качественный анализ. Количественный анализ. Физико-химические и физические методы анализа.
Роль химии в решении экологических проблем. Продукты горения топлива и защита воздушного бассейна от загрязнений. Методы малоотходной технологии. Водородная энергетика. Охрана водного бассейна. Методы очистки сточных вод.
Перечень лабораторных работ
1. Основные классы неорганических соединений.
2. Строение атома.
3. Химическая термодинамика.
4. Окислительно-восстановительные реакции.
5. Гальванические элементы.
6. Электролиз.
7. Коррозия металлов.
Вопросы к экзамену
1. Квантовые числа: главное и орбитальное. Энергетические уровни и подуровни.
2. Квантовые числа: магнитное и спиновое. Энергетические уровни, подуровни и орбитали.
3. Формы s- и р-орбиталей.
4. Принципы формирования электронных оболочек атомов: принцип Паули, правило Хунда, принцип минимума энергии.
5. Максимальная заселённость электронами энергетических подуровней.
6. Электронные формулы строения атомов элементов. Графическое изображение электронного строения атомов.
7. Ковалентная неполярная химическая связь.
8. Ковалентная полярная химическая связь.
9. Ионная химическая связь.
10. Способы перекрывания электронных облаков: s-связи и p-связи
11. Гибридизация атомных орбиталей и строение молекул.
12. Первый закон термодинамики. Закон Гесса и следствие из него.
13. Расчёт изменения энтальпии реакции и теплового эффекта по стандартным энтальпиям вещества.
14. Расчёт изменения энтропии реакции. Энтропийно выгодные и невыгодные реакции.
15. Свободная энергия Гиббса и её изменение в ходе реакций.
16. Межмолекулярные окислительно-восстановительные реакции.
17. Внутримолекулярные окислительно-восстановительные реакции.
18. Реакции самоокисления-самовосстановления (диспропорционирования).
19. Окислительно-восстановительные реакции. Окислители и восстановители.
20. Электродные потенциалы. Уравнение Нернста.
21. Ряд напряжений металлов.
22. Гальванический элемент Вольта.
23. Электродвижущая сила гальванических элементов.
24. Гальванический элемент Якоби-Даниэля.
25. Концентрационный гальванический элемент.
26. Электрохимическая коррозия. Деполяризация.
27. Коррозия при контакте двух металлов.
28. Коррозия под каплей воды.
29. Защита металлов от коррозии.
30. Электролиз расплавов и растворов электролитов. Инертный и растворимый аноды.
31. Законы электролиза.
32. Скорость химической реакции. Кинетические уравнения. Уравнение Аррениуса. Колебательные реакции.
33. Гомогенный и гетерогенный катализ. Ферментативный катализ.
34. Химическое равновесие. Константа равновесия.
35. Смещение химического равновесия. Принцип Ле Шателье.
36. Фазовые равновесия. Правило фаз Гиббса. Диаграммы состояния.
37. Дисперсные системы: грубодисперсные системы, коллоидные растворы, истинные растворы. Свойства коллоидных растворов.
38. Концентрация растворов. Законы идеальных растворов.
39. Растворы электролитов. Вода как растворитель. РН среды.
40. Углерод. Алмаз, графит, карбин. Стеклоуглерод и углеволокно.
41. Кремний. Кремнезем. Силикаты. Стекло. Стекловолокно. Стеклопластики.
42. Легкие конструкционные металлы: Be, Mg, Al, Ti.
43. Тяжелые конструкционные металлы: Cr, Mn, Fe, Co, Ni, Cu.
44. Основные классы органических соединений.
45. Олигомеры и полимеры. Классификация, получение, свойства, применение.
46. Биохимические системы: углеводы, жиры, белки, нуклеиновые кислоты.
47. Мембраны и мембранные технологии.
48. Биотехнология. Достижения, основные направления и перспективы развития.
49. Химический анализ. Физико-химический и физический анализ.
50. Роль химии в решении экологических проблем.
Л И Т Е Р А Т У Р А
1. Коровин Н.В. Общая химия. – М.: Высш. школа. 2000.
2. Глинка Н.Л. Общая химия. - Л.: Химия, 1983 -1988 гг.
3. Ахметов Н.С. Общая и неорганическая химия. - М.: Высш. школа, 1985.
4. Фролов В.В. Химия. - М.: Высш. школа. 1979.
5. Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия, 1985.
6. Химия: Методические указания и контрольное задание. - Л.: СЗПИ, 1990.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Тема 1. Строение атома и периодическая система элементов Д.И.Менделеева
Литература: [1] c.17-34; [2] с. 47-102; [3] с.10-40.
Теоретические основы
Атом химического элемента состоит из положительного ядра и двигающихся в поле его действия отрицательно заряженных электронов. Сам атом является электронейтральной частицей. Ядро атома состоит из нуклонов: протонов (условный заряд +1; массовое число 1) и нейтронов (заряд 0; массовое число 1). Заряд ядра равен порядковому номеру элемента в периодической системе Менделеева и совпадает с числом протонов. Массовое число ядра (сумма количества протонов и нейтронов: А = Z + N) примерно определяет относительную массу атома по причине легкости электронов (электрон в 1840 раз легче протона).
Состояние электронов в атоме волновую природу и согласно квантовой (или волновой) механике описывается плотностью вероятности обнаружения электрона в данной области пространства относительно ядра. Граничная поверхность, внутри которой расположена область наибольшей вероятности обнаружения электрона, называется атомной орбиталью. Атомная орбиталь характеризуется параметрами, которые получили название квантовых чисел: n - главное квантовое число описывает энергию и размеры атомной орбитали; l - орбитальное квантовое число - форму орбитали; m - магнитное квантовое число - ее ориентацию в пространстве.
Условная запись, которая представляет распределение электронов по энергетическим уровням и подуровням (атомным орбиталям), называется электронной формулой атома. Для написания электронной формулы, в которой с помощью квантовых чисел зашифровано состояние каждого электрона необходимо знать:
- систему обозначений;
- последовательность заполнения подуровней электронами (принцип наименьшей энергии);
- максимальную ёмкость каждого подуровня (принцип Паули).
Система обозначений в общем виде выглядит так: nlx , где n - главное квантовое число, соответствующее номеру энергетического уровня; l - орбитальное квантовое число - подуровню, который обозначается буквами s, p, d или f; х - количество электронов в данном квантовом состоянии. Например, запись 3d5 (читается: три дэ пять) означает, что пять электронов находятся на d-подуровне третьего энергетического уровня.
Первый энергетический уровень (n = 1) состоит из одного s-подуровня, второй энергетический уровень (n = 2) - из s- и p-подуровней, при n = 3 имеем три подуровня: s-, p- и d -, а при n = 4 - четыре: s-, p-, d- и f-подуровни. Последовательность заполнения энергетических подуровней имеет вид: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 5d=4f, 6p, 7s, 6d=5f,...
Максимальная ёмкость энергетических подуровней: s - два электрона; p - шесть; d - десять; f - четырнадцать. Заполнение последующих энергетических подуровней происходит только после полной застройки предыдущих. Например, электронная формула углерода имеет вид:
С 1s22s22p2 .
Валентными электронами атома считаются электроны внешнего энергетического уровня, а также предпоследнего d-подуровня, если он заполнен частично. В атоме углерода валентными являются электроны второго энергетического уровня: С 2s22p2 . В атоме марганца (электронная формула Mn 1s22s22p63s23p63d54s2) к валентным относятся 7 электронов: два на подуровне 4s и пять на подуровне 3d.
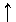


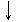 Электронное строение атома можно представить также в виде схемы, в которой электронная орбиталь символически представлена квантовой ячейкой, а собственный спиновый момент электрона - стрелкой, направление которой соответствует значению спинового квантового числа (стрелка вверх +1/2, стрелка вниз -1/2):
Электронное строение атома можно представить также в виде схемы, в которой электронная орбиталь символически представлена квантовой ячейкой, а собственный спиновый момент электрона - стрелкой, направление которой соответствует значению спинового квантового числа (стрелка вверх +1/2, стрелка вниз -1/2):
 При распределении электронов по квантовым ячейкам следует руководствоваться принципом Паули и правилом Хунда. В каждой ячейке может быть не более двух электронов с противоположными спинами:
При распределении электронов по квантовым ячейкам следует руководствоваться принципом Паули и правилом Хунда. В каждой ячейке может быть не более двух электронов с противоположными спинами:
¯
Такая пара электронов называется спаренной. Суммарное спиновое число электронов данного подуровня должно быть максимальным (сначала каждая ячейка заполняется по одному электрону с параллельными спинами, а затем производится парное размещение электронов со спинами, противоположными к уже имеющимся в ячейке электронам). Например, для валентных электронов атома углерода:
Дата добавления: 2018-04-15; просмотров: 432; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
