Распределение химических элементов в земной коре и геохимические ассоциации
Nbsp;
Геолого-промышленные типы месторождений полезных ископаемых
Лек. 2 ПРГ 31.01.2018
Раздел 1 ОБЩИЕ ЗАКОНОМЕРНОСТИ РАСПРЕДЕЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ЗЕМНОЙ КОРЕ
Распространенность химических элементов в земной коре
С позиций геохимии месторождение полезных ископаемых представляет собой геохимическую аномалию, концентрация химических элементов в которой пригодна для рентабельной разработки.
Величины концентраций элементов в месторождениях прямо зависят от содержаний химических элементов в земной коре (кларков). (табл. 1.1). Чем выше кларк элемента, тем выше его содержания в месторождениях.
Таблица 1.1
Распространенность химических элементов в верхней части
континентальной коры(по данным А.А. Ярошевского, 1990)
| Декада | Содержание в пределах декады, % мас. | Число элементов | Символы элементов(в скобках значения n) |
| I | n 101 | 2 | O (4.79), Si (2.95) (Сумма 77.4%) |
| II | n 100 | 6 | Al (8.14), Fe (4.37), Ca (2.71), K (2.4), Na (2.01), Mg (1.79) (Сумма 21,42%) (Сумма Iи II декад 98,82%) |
| III | n 10-1 | 4 | Ti (3.2), C (2.7), H (1.6), S (1.0) |
| IV | n 10-2 | 9+15TR | Mn (7.7), P (7.0), Ba (5.8), F (5.0), Sr (2.9), Cl (2.0), Zr (1.7), V (1.1), Rb (1.1), TR (1.1) |
| V | n 10-3 | 17 | Cr (9.9), Zn (7.6), Ni (5.8), Cu (4.6), Y (2.8), Li (2.7), Co (2.3), N (2.0), Ga (1.9), Sc (1.6), Nb (1.6), Pb (1.6), B (1.2), Th (1.2) |
| VI | n 10-4 | 19 | Hf (4.0), Cs (4.0), Be (3.5), Yb (3.0), U (3.0), Sn (2.5), Ta (2.5), Br (2.0), As (1.7), Ge (1.5), W (1.2), Mo (1.0) |
| VII | n 10-5 | 9 | Tl (7.0), I (5.0), Bi (3.0), Sb (2.0), In (1.0) |
| VIII | n 10-6 | 4 | Hg (8.0), Ag (7.0), Se (5.0), Pd (1.0) |
| IX | n 10-7 | 3 | Pt (n), Au (4.0), Te (1.0) |
| X | n 10-8 | 1 | Re (n) |
| XII | n 10-10 | 1 | Ra (1.0) |
|
|
|
От чего зависит распространенность химических элементов в земной коре?
В геохимии по этому вопросу существуют два эмпирических правила: правило симметрии и правило четности.
1. Правило симметрии: наиболее распространены атомы с одинаковым количеством протонов и нейтронов в ядре, т.е. элементы начала Периодической системы.
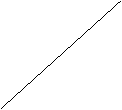
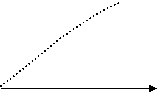
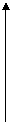 p
p
p = n
 |
n
Рис. 1.1. Диаграмма, иллюстрирующая постепенное преобладание количества нейтронов над количеством протонов с увеличением порядкового номера элемента
2. Правило четности: наиболее распространены атомы с четным количеством протонов и нейтронов.
Таблица 2
Соотношения количества протонов и нейтронов в атомах химических элементов
| №№ пп | Кларк, %мас. | Элемент | Количество | |
| протонов | нейтронов | |||
| 1 | 47,9 | 16О32 | 16 | 16 |
| 2 | 29,5 | 14Si28 | 14 | 14 |
| 3 | 8.14 | 13Al27 | 13 | 14 |
| 4 | 4.37 | 26Fe56 | 26 | 30 |
| 5 | 2.71 | 20Ca40 | 20 | 20 |
| 6 | 2.4 | 19K39 | 19 | 20 |
| 7 | 2.01 | 11Na23 | 11 | 12 |
| 8 | 1.79 | 12Mg24 | 12 | 12 |
| 9 | 0.32 | 22Ti48 | 22 | 26 |
| 10 | 0.27 | 6C12 | 6 | 6 |
| 11 | 0.16 | 1H1 | 1 | 0 |
| 12 | 0.10 | 16S32 | 16 | 16 |
| Сумма 99,67 | ||||
Эмпирические правила показывают, что распространенность химических элементов, в конечном счете, определяется строением ядер их атомов.
|
|
|
Кларком элемента определяются его запасы в месторождениях, содержания в рудах и цены на металлы (табл. 2.3.).
Таблица 2.3
Зависимость суммарных запасов, минимальных промышленных содержаний и цен на металлы от кларков химических элементов
| Декада | Кларк элемента, % | Запасы, тыс. т | Содержания в рудах, % | Цены на металлы, дол./т |
| 1 | n 100 (Al, Fe, Na, K) | n 107 | n 101 | n 100 |
| 2 | n 10-1 (Ti, Mn) | n 106 | n 100 | n 101 |
| 3 | n 10-3 (Zn, Cu, Pb) | n 105 | n 10-1 | n 102 |
| 4 | n 10-4 (Sn, Mo, W) | n 103 | n 10-2 | n 103 |
| 5 | n 10-6 (Hg, Ag) | n 102 | n 10-3 | n 104 |
| 6 | n 10-7 (Pt, Au) | n 101 | n 10-4 | n 106 |
Таким образом, геохимический параметр – кларк химического элемента – имеет не только теоретическое значение для наук о Земле, но и важное экономическое значение.
Величиной кларка определяется также распространенность месторождений химического элемента в земной коре.
Наиболее распространены в земной коре месторождения строительных материалов, вещество которых состоит из элементов с четным количеством протонов и нейтронов.
Менее распространены месторождения руд черных металлов, еще меньше месторождений руд цветных, редких и благородных металлов.
|
|
|
Распределение химических элементов в земной коре и геохимические ассоциации
В природе некоторые химические элементы концентрируются совместно, образуя естественные ассоциации (парагенезисы) элементов в месторождениях полезных ископаемых.
В чем причина образования геохимических ассоциаций элементов?
Очевидно, что она заключается в близости химических свойств элементов.
Химические свойства определяются строением внешних электронных оболочек их атомов.
Ассоциации элементов можно выделить и на Периодической системе Д.И. Менделеева, объединив близлежащие элементы по особенностям концентрации в земной коре (рис. 1.2).
Первичные концентрации элементов побочной подгруппы VIII-й группы (Fe, Co, Ni, Cu, Ru, Rh, Pd, Os, Ir, Pt), а также побочных подгрупп 4-го периода (от Sc до Cu) образуются в ходе магматических процессов (см. рис. 1.2).
Элементы побочных подгрупп III – VI групп 5-го и 6-го периодов (Y, Zr, Nb, Mo, Cs, TR, Hf, Ta, W) накапливаются в пегматитах и грейзенах.
Элементы, относящиеся к побочным подгруппам I и II групп и главным подгруппам III – VI групп (Cu, Zn, Ga, Ge, As, Se, Ag, Cd, In, Sn, Sb, Te, Au, Hg, Tl, Pb, Bi), накапливаются в продуктах гидротермальных процессов.
|
|
|
Большинство щелочных и щелочноземельных металлов, а также элементов 2-го и 3-го периодов концентрируется в экзогенных месторождениях.
Таблица 3.2
Дата добавления: 2018-05-02; просмотров: 868; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
