Направленность ковалентной связи
Nbsp; Теория валентных связей. Гибридизация Теория валентных связей исходит из того, что каждая пара атомов в молекуле удерживается вместе за счет одной или нескольких общих электронных пар. · ВАЛЕНТНОСТЬ – число химических связей, которые данный атом образует с другими атомами. Образование молекулы водорода из атомов можно изобразить следующим образом: Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, в образовании ковалентной связи могут принимать участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода: ВАЖНО: в образовании связей принимают участи только ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ. · Валентные электроны – это электроны внешнего уровня (для атомов главной подгруппы) и электроны внешнего уровня + электроны d-подуровня предвнешнего уровня (для атомов побочной подгруппы). В ряде случаев число неспаренных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом С в основном состоянии имеет два неспаренных электрона, а при возбуждении один из 2s-электронов переходит на пустую 2p-орбиталь, в результате чего число неспаренных электронов увеличивается до четырех: Вследствие этого валентность углерода меняется, и он способен соединяться уже с четырьмя другими атомами: Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяющейся при образовании новых связей C-F. Помимо образования ковалентной связи по обменному механизму, мы помним про донорно-акцепторный механизм образования той же ковалентной связи (см. файл «Химические связи»). А значит, валентные возможности элементов еще шире, чем говорилось ранее. Имея в виду оба описанные механизма образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы 2го периода и, следовательно, их валентные электроны находятся на орбиталях 2го уровня: одной 2s- и трех 2p-орбиталях: У бора и углерода при этом имеются свободные орбитали на втором уровне (2p-орбитали), на которые могут перейти электроны при возбуждении. Мы получаем новые электронные конфигурации! В соответствии с числом неспаренных электронов на внешнем энергетическом уровне атомы B, Cи Nмогут образовывать соответственно три, четыре и три ковалентные связи: Атом B имеет также свободную орбиталь на внешнем энергетическом уровне, поэтому в молекуле BH3 дефицит электронов. Атом N в молекуле NH3 имеет на внешнем энергетическом уровне неподеленную пару электронов. Таким образом, молекула BH3 может выступать как акцептор, а молекула NH3, наоборот, - как донор пары электронов. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму! Простейший донор электронной пары – гидрид-ион H-, присоединение отрицательного гидрид-иона к молекуле BH3приводит к образованию сложного (комплексного) иона BH4-: Простейший акцептор электронной пары – протон H+, его присоединение к молекуле NH3 тоже приводит к образованию комплексного иона NH4+, но уже с положительным зарядом: Из сопоставления структурных формул CH4 и комплексных ионов BH4-и NH4+ видно, что атомы бора, углерода и азота в них четырехвалентны. Следует отметить, что все четыре связи в этих структурах равноценны и неразличимы, а заряды распределены по всему комплексному иону. ВЫВОД: способность атомов образовывать ковалентные связи обуславливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей. ВАЖНО: у атомов элементов третьего периода электронная конфигурация внешнего энергетического уровня аналогична таковой у атомов элементов второго периода. Однако за счет 3d-орбиталей у них появляется возможность увеличения числа неспаренных электронов. Рассмотрим атомы серы и хлора:
|
|
|
|
|
|
Направленность ковалентной связи
|
|
|
Поскольку электронные облака имеют различную форму, их взаимное перекрывание может осуществляться различными способами. В зависимости от способа перекрывания различают σ-, π- и δ-связи.
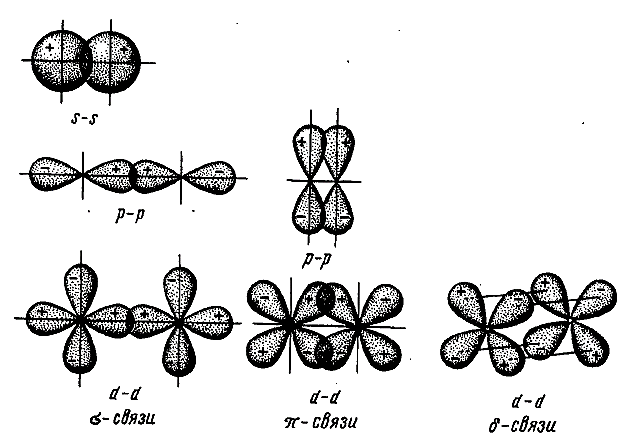
· Сигма-связь (σ-связь) осуществляется при перекрывании электронных облаков вдоль линии, соединяющей ядра атомов. Это одинарная ковалентная связь.
· Пи-связь (π-связь)возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов (перекрывание над и под плоскостью σ-связи).
· Дельта-связь (δ-связь)образуется за счет перекрывания всех четырех лопастей d-электронных облаков.
Мы будем использовать только σ- и π-связи.
σ-связь есть всегда!Это та самая связь, которая удерживает два атома вместе, π-связь может быть дополнительной.
Что же представляют из себя молекулы в трехмерном пространстве?
Пространственные формы молекул весьма разнообразны. Так, молекула CO2имеет линейное строение, молекула CH4–тетраэдрическое, молекула NH3–пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул имеется ряд теорий (моделей). Наиболее важная для нас – модель гибридизации орбиталей.
Дата добавления: 2018-04-15; просмотров: 702; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
