Опыт №1 Получение и свойства азота
Лабораторная работа 1 Кислород Опыт №1 Получение кислорода. Работа с газометром Для собирания и хранения газов применяют стеклянные газометры (рис.1). Умеренно растворимые в воде газы, в том числе и кислород, собирают и хранят в них над водой. Газометр состоит из двух частей: воронка 1, снабженной краном 2, и толстостенной склянки 3 с отверстием для выхода газа 4 и сливным отверстием 5 внизу для воды. Заполнение газометра водой. Снять воронку 1 и заполнить водой склянку 3. Перевернуть воронку 1 трубкой вверх, закрыть кран 2, заполнить водой трубку воронки, снова перевернуть воронку трубкой вниз, закрыв отверстие ее большим пальцем. Быстро погрузить воронку в склянку 3, наполненную доверху водой. Если в газометре остались пузырьки воздуха, то их следует удалить через кран 2, пользуясь металлической проволочкой или легким покачиванием газометра. Поставить заполненный водой газометр на край стола около водопроводной раковины. Закрыв все краны газометра, открыть нижнее его отверстие 5. Выливается ли вода из газометра? Заполнение газометра кислородом. Измерить объем газометра. Написать уравнение разложение перманганата калия. Рассчитать, сколько граммов соли следует взять, чтобы выделившийся при этом кислород заполнил газометр на 2/3. Взвесить нужное количество перманганата калия, перенести его в стеклянную пробирку для получения газа, снабженную резиновой трубкой, и укрепить пробирку в штативе. Нагреть пробирку с перманганатом калия и, подождав, пока вытисниться воздух из пробирки и газоотводной трубки, ввести газоотводную трубку в сливное отверстие газометра. Вытекающая вода должна сливаться в раковину. Заполнив газометр кислородом (на 2/3), вынуть газоотводную трубку и закрыть сливное отверстие пробкой. Следить за тем, чтобы воронка 1 была наполнена водой. После того, как газ охладиться до комнатной температуры, открыть на короткое время кран 2 (для чего?). Газометр может быть наполнен и из баллона с кислородом. В каких условиях можно получить кислород из пероксида бария и бертолетовой соли? Напишите уравнения реакций. Получение тока кислорода из газометра. Чтобы наполнить сосуд кислородом, необходимо налить в него до краев воду, закрыть пробкой, перевернуть и погрузить сосуд в кристаллизатор с водой. Опустить газоотводную трубку от газометра в кристаллизатор и, открыв краны 2 и 4, отрегулировать скорость подачи кислорода; она должна быть такой, чтобы можно было легко считать пузырьки газа. Подвести газоотводную трубку под отверстие колбы, заполненного водой. Когда колба будет почти наполнена кислородом, закрыть ее под водой пробкой и вынуть из воды. Для чего нужно оставить в колбе небольшое количество воды? Какие примеси содержит собранный кислород? Под каким давлением находиться газ в газометре? Опыт №2 Свойства кислорода 1. Положить в ложечку[1] для сжигания кусочек серы величиной с горошину, поджечь ее на пламени горелки (под тягой!). Обратить внимание на цвет и размер пламени горящей серы. Внести горящую серу в банку с кислородом. Какие изменения в горении серы наблюдаются? 2. Положить в ложечку для сжигания небольшой кусочек древесного угля, накалить и внести в банку с кислородом. Как изменяется интенсивность горения угля в кислороде? 3. Свернуть спиралью отрезок стальной проволоки и прикрепить его к концу ложечки для сжигания. Присоединить к проволоке кусочек корковой пробки. Поджечь пробку и быстро внести проволоку в банку с кислородом. Что происходит? Написать уравнение реакции в молекулярной и электронной формах. Какой вывод о свойствах кислорода можно сделать на основании проведенных опытов? Как влияет на интенсивность горения веществ замена воздуха кислородом? Чем это объясняется? Почему у кислорода низкие температуры плавления и кипения? Какое строение имеет молекула кислорода?
|
|
|
|
|
|
Озон
|
|
|
Получение озона действием концентрированной серной кислоты на персульфат аммония (калия).
В колбу Энглера (Вюрца) положить 15 г кристаллического персульфата аммония (или персульфата калия), соединить колбу с капельной воронкой, содержащей концентрированную серную кислоту. Подавая серную кислоту к персульфату аммония и нагревая реакционную смесь регулируют ток озона. Написать уравнения протекающих реакций. Чем загрязнен образующийся озон.
Свойства озона.
а) Растворить озон в воде, имеет ли раствор запах?
б) К полученному водному раствору озона прибавить 2-3 капли крахмального клейстера и такой же объем раствора йодида калия. Что наблюдается? Написать уравнение реакции.
в) Налить в стакан раствор индиго и, опустив в него конец газоотводной трубки озонатора, пропускать через работающий озонатор слабый ток кислорода. Что происходит? Какими свойствами обладает озон? Какое строение имеет молекула озона?
Водород
Работа с водородом требует большой осторожности! Водород горюч и в смеси с кислородом или воздухом образует взрывчатую смесь. Все опыты в атмосфере водорода разрешается проводить только в присутствии преподавателя! Надевать очки или маску.
|
|
|
Если водород необходимо нагревать в приборе или поджечь при выходе из него, следует до опыта вытеснить из прибора весь воздух, затем проверить водород на чистоту (в присутствии преподавателя!). Для этого приготовить 2 пробирки. Надеть на газоотводную трубку сухую пробирку, через 5-10с медленно снять ее, закрыв отверстие пробирки большим пальцем, и поставить на ее место вторую. Поднести заполненную водородом пробирку, перевернутую вверх дном, к пламени горелки. Отняв палец, поджечь водород. Производить, меняя пробирку, проверку чистоты выделяющегося водорода до тех пор, пока собранный газ не будет загораться почти без звука.
Только убедившись в чистоте выделяющегося водорода, можно поджечь его горящей лучинкой у отверстия прибора, из которого он выделяется, или начать нагревание прибора (в присутствии преподавателя!).
При проведении реакций в атмосфере водорода в нагреваемом приборе разрешается прекращать поступление тока водорода только тогда, когда нагреваемая реакционная часть прибора примет температуру, близкую к комнатной.
Опыт №1 Гремучая смесь
Заполнить водородом из аппарата Кипа* (с помощью газоотводной трубки) обычную консервную банку с отрезанным дном таким образом, чтобы водород вытеснил из банки весь воздух и начал снизу выходить в атмосферу. Поджигают водород у отверстия, которое пробито верхней частью банки. Водорода должно быть по объему не меньше 4%, но не больше 95%. Что наблюдается? Объяснить происходящее явление. Написать уравнение реакции.
Опыт №2 Получение водорода
Действие металла на кислоту. Поместить в пробирку 5-8 кусочков гранулированного цинка, прилить 5мл 10%-го раствора соляной кислоты и закрыть отверстие пробирки пробкой с газоотводной трубкой, оттянутой вверху. Проверить водород на чистоту.
Убедившись в чистоте выделяющегося водорода (в присутствии преподавателя), поджечь его горящей лучинкой у отверстия газоотводной трубки. Опрокинуть над пламенем водорода холодную стеклянную воронку. Что наблюдается? Написать уравнение реакции в молекулярной и электронно-ионной формах.
Действие алюминия на щелочь. (Опыт проводить в вытяжном шкафу, надеть очки!)
Положить в пробирку несколько кусочков алюминия, прилить к ним 2-3мл 20%-го раствора гидроксида натрия. Если реакция идет плохо, осторожно подогреть. Определить, какой газ выделяется.
Написать уравнение реакции в молекулярной и электронно-ионной формах.
Действие металла на воду.
1. Заполнить пробирку до краев водой. Закрыв отверстие большим пальцем, опрокинуть ее в кристаллизатор* с водой и в таком положении закрепить в лапке штатива*. Завернуть несколько кусочков металлического кальция в фильтровальную бумагу и быстро при помощи щипцов* подвести металл под пробирку. Определить, какой газ выделяется. Написать уравнение реакции в молекулярной и электронно-ионной формах.
2. Собрать прибор (рис.3). На дно сухой пробирки насыпать небольшое количество влажного речного песка, следя за тем, чтобы стенки пробирки оставались сухими. Закрепить пробирку в штативе так, чтобы дно было немного ниже отверстия. Сделав из узкой полоски бумаги желобок, насыпать порошок восстановленного железа в среднюю часть пробирки. Закрыть пробирку пробкой с газоотводной трубкой. Сильно нагреть пробирку пламенем горелки* в том месте, где лежит железо. Пламенем второй горелки осторожно нагреть влажный песок. Собрать выделяющийся газ над водой и испытать его воспламеняемость. Написать уравнение реакции в молекулярной и электронно-ионной формах.
Опыт №3 Пероксид водорода
Получение пероксида водорода. В колбу емкостью 50мл налить 20мл 5%-го раствора серной кислоты и охладить ее до 0°С. Взбалтывая содержимое колбы в течении 5-10мин, всыпать в нее небольшими порциями около 1г пероксида бария. Полученный раствор пероксида бария отфильтровать от осадка. Изучить свойства пероксида водорода.
Свойства пероксида водорода.
1. В пробирку с раствором с пероксидом водорода внести оксид марганца (IV). Какой газ выделяется? Какую роль играет оксид марганца (IV)? Написать уравнение реакции.
2. К раствору пероксида водорода прилить несколько капель раствора йодида калия. Что наблюдается? Разбавить раствор водой и внести в него 1-2 капли раствора крахмала. Что происходит? Написать уравнение реакции в молекулярной и электронно-ионной формах.
3. Получить осадок сульфида свинца взаимодействием растворов соли свинца и сульфида аммония. Небольшое количество осадка, промытого водой путем декантации, обработать раствором пероксида водорода. Почему изменился цвет осадка? Написать уравнения реакций. Какие свойства проявляет пероксид водорода в этой и предыдущей реакциях?
4. К раствору перманганата калия, подкисленному серной кислотой, прилить раствор пероксида водорода. Что наблюдается? Написать уравнение реакции в молекулярной и электронно-ионной формах. На какие свойства пероксида водорода указывает эта реакция?
Список реактивов
1. Перманганат калия кристаллический
2. Сера
3. Уголь древесный
4. Стальная проволока
5. Корковая пробка
6. Цинк гранулированный
7. 10%-ый раствор соляной кислоты
8. Алюминий гранулированный
9. 20%-ый раствор гидроксида натрия
10. Кальций металлический
11. Порошок восстановленного железа
12. 5%-ый раствор серной кислоты
13. Пероксид бария
14. Пероксид водорода 30%-ый раствор
15. Оксид марганца (IV)
16. Раствор йодида калия
17. Раствор крахмала
18. Сульфид аммония
19. Нитрат свинца кристаллический
20. Лучинка
Лабораторная работа №2 Галогены
Получение и свойства галогенов
Опыты с галогенами следует проводить под тягой. Необходимо работать в масках и перчатках. Все работы с галогенами, особенно бромом, можно проводить только с разрешения преподавателя.
Хлор
Хлор – ядовитый зеленовато-желтый газ. Вдыхание небольших количеств его вызывает кашель, при вдыхании больших количеств возможны тяжелые последствия, в том числе воспаление и отек легких.
При тяжелом отравлении хлором до прибытия врача необходим покой, вдыхание кислорода. Пострадавшему дают молоко, согревают конечности. При несильном отравлении пострадавшему дают молоко, выводят на свежий воздух до полного исчезновения симптомов отравления.
1.1 Получение хлора
1.1.1 Получение хлор из хлороводородной кислоты действием различных окислителей.
а) Насыпать в пробирку небольшое количество оксида марганца (IV) и облить его концентрированной хлороводородной кислотой. Осторожно понюхать, направляя к лицу струю хлора движением кисти руки. Написать уравнение реакции.
б) Опустить на дно пробирки немного тонко измельченного дихромата калия и облить его концентрированной хлороводородной кислотой. Смесь слегка подогреть. Что наблюдается? Написать уравнение реакции.
в) Положить в пробирку немного хлорной извести и облить ее 20% -м раствором хлороводородной кислоты. Написать уравнение реакции.
1.1.2 Получение хлора из хлорида натрия.
Поместить в пробирку немного смеси хлорида натрия с оксидом марганца (IV), осторожно прилить из пипетки несколько капель 96%-го раствора серной кислоты. Смесь слегка подогреть. Что наблюдается? Написать уравнение реакции.
В виде каких соединений встречается хлор в природе? Как получают хлор в промышленности?
1.1.3 Получение хлора окислением хлористоводородной кислоты перманганатом калия.
Собрать прибор (рис.1) и проверить его герметичность. В колбу Вюрца 1 поместить 10-15 г перманганата калия. В капельную воронку 2 налить 37%-й раствор хлороводородной кислоты (прежде чем наполнить капельную воронку хлороводородной кислотой, необходимо убедиться, что это действительно хлороводородная кислота. Следует помнить, что при взаимодействии концентрированной серной кислоты с перманганатом калия может произойти взрыв), в цилиндр 3 — насыщенный раствор хлорида натрия, в промывалку 4 — немного концентрированного раствора серной кислоты.
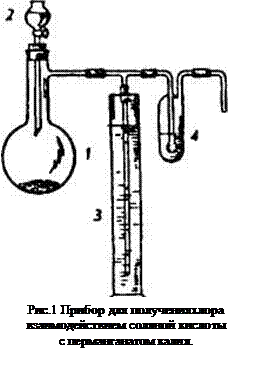 Каково назначение цилиндра с раствором хлорида натрия? Почему в данной установке не поставлена промывалка с водой? Загрязнен ли хлор хлоридом водорода?
Каково назначение цилиндра с раствором хлорида натрия? Почему в данной установке не поставлена промывалка с водой? Загрязнен ли хлор хлоридом водорода?
Наполнить хлором 5 коническую колбу емкостью 250 мл и покрыть стеклянными пластинками или пробками. На дно двух колб, предназначенных для сжигания в хлоре металлов, предварительно поместить слой песка (зачем?).
Во время заполнения хлором отверстия колб должны быть прикрыты стеклянными пластинками или пробками. Поставить белый экран (лист бумаги) для наблюдения окраски хлора. Испытать свойства хлора.
1.2 Химические свойства хлора.
1.2.1 Взаимодействие хлора с металлами.
а) Взять на листок бумаги немного порошка сурьмы, открыть одну из колб с хлором и постепенно всыпать в нее сурьму. Что происходит? Написать уравнение реакции.
б) Взять щипцами полоску медной фольги или пучок тонких медных проволочек, нагреть на пламени горелки и быстро внести колбу с хлором. Что наблюдается? Написать уравнение реакции.
1.2.2 Взаимодействие хлора с неметаллами.
а) Положить в ложечку для сжигания несколько крупинок красного фосфора, поджечь его и внести в колбу с хлором. Что происходит? Написать уравнение реакции.
В каких условиях при горении, фосфора (сурьмы) в хлоре, могут образоваться хлориды фосфора (III) и фосфора (IV) (сурьмы)? По каким признакам их можно отличить?
б) Взять две пробирки. Одну из них наполнить хлором, другую — водородом из аппарата Киппа. Пробирки обвернуть полотенцем. Предварительно закрыв отверстия пробирок пальцами, соединить их таким образом, чтобы пробирка с хлором находилась наверху. Разнять пробирки и быстро внести их отверстия в пламя. Что происходит? Написать уравнение реакции.
1.2.3 Взаимодействие хлора со сложными веществами.
а) Взять полоску фильтровальной бумаги, смочить ее несколькими каплями свежеперегнанного скипидара и при помощи щипцов внести в банку с хлором. Что наблюдается? Написать уравнение реакции.
б) Закрепить на ложечке для сжигания огарок свечи, зажечь свечу и осторожно внести ее в банку с хлором. Что наблюдается? Какие продукты образовались в результате реакции?
1.2.4 Хлорная вода и ее свойства.
а) Насытить 5-10 мл дистиллированной воды хлором. Отметить цвет и запах (осторожно!) полученного раствора. Какие вещества присутствуют в хлорной воде? Написать уравнение реакции и ее константу равновесия. Испытать действие полученной хлорной воды на раствор индиго и окрашенную ткань. Что наблюдается? Какое вещество производит белящее действие?
б) Налить в пробирку 2-3 мл хлорной воды и прибавить по каплям раствор гидроксида натрия. Как объяснить исчезновение окраски и запаха хлорной воды? Какое влияние оказывает щелочь на сдвиг равновесия в реакции между хлором и водой? Сформулировать принцип Ле Шателье.
Добавить в пробирку разбавленный раствор серной кислоты до кислой реакции. Изменился ли запах раствора? Написать уравнение реакции. Объяснить полученные результаты. Как можно получить хлорноватистую кислоту (в растворе)? Какие типы превращений характерны для хлорноватистой кислоты? Какие условия способствуют преобладанию того или иного вида превращений?
Бром
Бром — тяжелая жидкость, образующая темно-красные пары способные вызвать отравление, слезотечение, удушье и поражение дыхательных путей. На коже образуются труднозаживающие язвы.
Перегонку брома можно проводить только в стеклянных приборах из хорошо отожженного стекла с использованием водяной бани. Нагревание стеклянных сосудов с жидким бромом голым пламенем горелки опасно. Работать с бромом можно только под тягой в маске и резиновых перчатках. Наливать бром в пробирки и капельные воронки следует осторожно через воронку.
При попадании брома на кожу следует быстро промыть пораженное место спиртом, большим количеством воды, а затем многократно 2%-м раствором бикарбоната натрия. При случайном вдыхании паров брома необходимы покой, вдыхание паров разбавленного раствора аммиака (2%-й водный раствор), затем вдыхание кислорода.
2.1 Получение брома
2.1.1 Получение брома окислением бромоводородной кислоты.
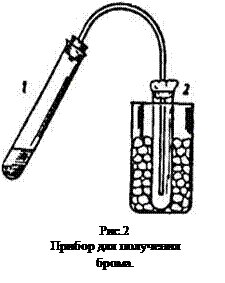 Собрать прибор (рис.2). В пробирку 1 насыпать около 1,5 г оксида марганца (IV) и прилить 5 мл концентрированного раствора бромоводородной кислоты. Закрыть пробирку 1 пробкой с газоотводной трубкой, конец которой опустить в сухую пробирку 2 охлаждаемую льдом. Отверстие пробирки 2 закрыть ватой и, слегка нагревая реакционную смесь, собрать выделяющийся бром. Написать уравнение реакций. Полученный бром использовать для последующих опытов.
Собрать прибор (рис.2). В пробирку 1 насыпать около 1,5 г оксида марганца (IV) и прилить 5 мл концентрированного раствора бромоводородной кислоты. Закрыть пробирку 1 пробкой с газоотводной трубкой, конец которой опустить в сухую пробирку 2 охлаждаемую льдом. Отверстие пробирки 2 закрыть ватой и, слегка нагревая реакционную смесь, собрать выделяющийся бром. Написать уравнение реакций. Полученный бром использовать для последующих опытов.
2.1.2 Получение брома вытеснением его из солей.
Налить в пробирку 2-3 мл насыщенного раствора бромида калия и пропустить через него сильный ток хлора. Что происходит? Полученный бром отогнать в пробирку-приемник. Написать уравнение реакции. Можно ли этим способом получить хлор и йод?
2.2 Свойства брома.
Опыты с жидким бромом студент проводит в присутствии преподавателя.
В вытяжной шкаф поставить штатив для пробирок с 5 сухими пробирками. Пользуясь маленькой воронкой, налить в каждую пробирку по 0,3-0,5 мл брома и проделать следующие опыты.
2.2.1 Одну пробирку с бромом поместить в стакан с охлаждающей смесью (лед и хлорид натрия), температура которой не должна быть выше -10°. Какова температура замерзания брома?
2.2.2 Взаимодействие с металлами и неметаллами.
а) Пробирку с бромом закрепить в лапку штатива и бросить в нее узкую полоску алюминиевой фольги. Если через минуту реакция не начнется, подвести под дно пробирки стакан с теплой водой (~40°). Что происходит? Написать уравнение реакции.
б) В пробирку с бромом, также закрепленную в лапку штатива, внести нагретую полоску медной фольги. Что наблюдается? Написать уравнение реакции.
в) В четвертую пробирку с бромом, находящуюся в штативе, внести шпателем несколько крупинок красного фосфора. Написать уравнение реакции.
2.2.3 Бромная вода и ее свойства.
а) В пробирку с бромом добавить 3-5 мл воды и перемешать стеклянной палочкой содержимое пробирки. Что наблюдается? Велика ли растворимость брома в воде? Что называется бромной водой? Прибавить к раствору несколько капель насыщенного раствора бромида калия. Объяснить происходящее явление.
б) Налить в пробирку 2-3 мл бромной воды и прилить раствор гидроксида натрия. Как можно объяснить изменение окраски раствора? Написать уравнение реакции.
в) Налить в пробирку несколько капель бромной воды, разбавить ее 5 мл дистиллированной воды и прибавить 5—10 капель хлороформа? Содержимое пробирки тщательно перемешать. Объяснить наблюдаемое явление. Проделать аналогичный опыт с другими органическими растворителями (гексан, бензол, тетрахлорид углерода).
Отметить изменение окраски органического слоя.
Йод
Пары йода, темно-фиолетового цвета, имеют неприятный запах, похожий на запах хлора, разъедающе действуют на слизистые оболочки. При отравлении следует вдыхать водяные пары с примесью аммиака, при поражении глаз промыть их 1%-м раствором тиосульфата натрия.
3.1 Получение йода
3.1.1 Получение йода.
а) Отвесить по 0,5 г йодида калия и оксида марганца (IV), пересыпать в тигель и перемешать стеклянной палочкой. Поставить тигель со смесью на фарфоровый треугольник, налить 3-4 капли концентрированного раствора серной кислоты и закрыть тигель маленькой колбой, наполненной холодной водой. Колбу закрепить в лапке штатива. Тигель слабо нагреть в течение нескольких минут. Что наблюдается? Написать уравнение реакции. Полученный йод собрать в бюкс и взвесить. Вычислить выход в процентах. Полученное вещество сдать лаборанту
б) Налить в пробирку 2 мл насыщенного раствора йодида калия. Пропустить через раствор ток хлора или добавить свежеприготовленной йодной воды. Какое вещество при этом выделяется? Полученное вещество отфильтровать на гладком фильтре и высушить на воздухе. Чем будет загрязнен полученный йод? Как можно его очистить?
3.2 Свойства йода.
3.2.1 В фарфоровую чашку или керамическую пластину поместить несколько кристаллов сухого йода и порошка алюминия и осторожно перемешать. (Опыт проводить под тягой) В приготовленную смесь внести каплю воды при помощи длинной трубки или палочки. Что наблюдается? Какую роль играет вода в данном опыте? Написать уравнение реакции.
3.2.2 Налить в две пробирки воду и опустить в них по одному кристаллу йода полученного в предыдущих опытах. Содержимое пробирок сильно взболтать. Каковы растворимость йода в воде? Какие молекулы и ионы содержатся в йодной воде? Написать уравнение реакции взаимодействия йода с водой.
Оставить одну пробирку для сравнения, во вторую пробирку прилить насыщенный раствор йодида калия и сильно взболтать. Что происходит? Образованием какого вещества объясняется увеличение растворимости йода? Написать уравнение реакции
3.2.3 К 2-3 мл йодной воды прилить по каплям 1 н. раствор щелочи до исчезновения окраски раствора. Полученный раствор подкислить серной кислотой. Что при этом наблюдается? Объяснить происходящие явления. Написать уравнения реакции.
3.2.4 Налить вряд пробирок по 2-З мл йодной воды и добавить в них по 2-3 капли органических растворителей (бензол, хлороформ, гексан, тетрахлорид углерода). Содержимое пробирок взболтать и отметить окраску слоя органического растворителя. В чем заключается сущность закона распределения?
Фтор
Каким способом получают фтор? Как реагирует фтор с водородными соединениями других элементов, например с водой, сероводородом, аммиаком? Как изменяется активность галогенов в ряду фтор-йод? Чем это можно объяснить?
Реактивы
1.Оксид марганца(IV), MnO2;
2.Дихромат калия, K2Cr2O7;
3.Хлорная известь, CaOCl2;
4.Хлорид натрия, NaCl;
5.Перманганат калия, KMnO4;
6.Порошок сурьмы, Sb;
7.Медная проволока, Cu;
8.Красный фосфор, P;
9.Скипидар (свежеперегнанный);
10.Концентрированый раствор серной кислоты, H2SO4 (96%);
11.Концентрированный раствор бромной воды, Br2;
12.Бромид калия, KBr;
13.Алюминиевая фольга, Al;
14.Органические растворители (хлороформ, бензол, гексан, тетрахлорид углерода);
15.Йодид калия, KI;
16.Сухой йод, I2;
17.Порошок алюминия, Al;
18.1.н. раствор гидроксида натрия, NaOH;
19.Соляная кислота (концентрированный раствор, 20%, 37% раствор,), HCl.
Лабораторная посуда
1.Пробирка,20шт;
2.Пипетка;
3.Колба Вюрца;
4.Капельная воронка;
5.Цилиндр;
6.Промывалка;
7.Колба (250мл), 5шт, колба (50мл),1шт;
8.Ложечка для сжигания;
9.Аппарат Киппа (взять у инженера перед лабораторной работой) ;
10.Химический стакан на 200 мл;
11.Газоотводная трубка;
12.Воронка;
13.Шпатель;
14.Стеклянная палочка;
15.Тигель;
16.Фарфоровый треугольник;
17.Бюкс;
18.Фарфоровая чашка.
ЛАБОРАТОРНАЯ РАБОТА № 3 Водородные и кислородные соединения галогенов.
1. Соединения галогенов с водородом
Опыты проводить под тягой!
Взаимодействие галогенидов металлов с кислотами.
1.1.1 Взаимодействие хлорида натрия , бромида натрия и йодида калия с концентрированной серной кислотой. Три пробирки поместить в штатив. В одну из них положить немного хлорида натрия, в другую — бромида натрия и в третью — йодида калия. В каждую из пробирок прилить несколько капель концентрированной серной кислоты (кислоту брать пипеткой!). Что наблюдается? Чем загрязнены бромид и йодид водорода, полученные этим способом? Написать уравнения реакций.
Какой из галогеноводородов является наиболее сильным восстановителем? Какие галогеноводороды можно получать действием концентрированного раствора серной кислоты на соответствующий галогенид?
1.1.2. Взаимодействие бромида натрия и йодида калия с концентрированным раствором ортофосфорной кислоты. В одну из пробирок поместить небольшое количество бромида натрия, в другую - йодида калия. В обе пробирки добавить 60%-й раствор ортофосфорной кислоты. Какие газы выделяются из пробирок? Написать уравнения реакций и объяснить наблюдаемые явления.
Свойства бромоводородной кислоты.
а) Испытать действие бромоводородной кислоты на магний , цинк и на карбонат кальция .
б) К 1 мл. раствора бромоводородной кислоты добавить 1 – 2 капли раствора нитрата серебра . Что наблюдается ? Написать уравнения реакций для всех процессов , протекающих в данном опыте .
1.3. Свойства йодоводородной кислоты.
а)раствор йодоводородной кислоты испытать на лакмус. Изучить его отношение к металлам (цинк, магний).
б) Налить в 3 пробирки раствор йодоводородной кислоты и добавить в первую пробирку растворы ацетата натрия и ацетата свинца, во вторую — нитрата серебра (1-2 капли), в третью — небольшой кусочек мрамора. Написать уравнения реакций для всех процессов, протекавших в данном опыте.
1.4Фторид водорода
Все работы с газообразным фторидом водорода, а также с плавиковой кислотой следует проводить в вытяжном шкафу! При наливании фтористоводородной кислоты необходимо надевать резиновые перчатки, очки или маску. Следить за тем, чтобы капли фтороводородной кислоты не попали на кожу.
При попадании капель плавиковой кислоты любой концентрации на кожу необходимо немедленно промыть пораженное место большим количеством воды, обработать его 10%-м, раствором хлорида кальция или насыщенным раствором сульфата магния. Затем нанёсти на пораженное место суспензию оксида магния в растворе сульфата магния или линимент синтомицина . В особо тяжелых случаях после оказания пострадавшему первой помощи его следует госпитализировать.
При попадании паров HF в дыхательные пути следует понюхать разбавленный водный раствор аммиака, а затем вдыхать кислород.
1.4.1 Свойства фтороводородной кислоты.
а) Испытать действие полученного раствора плавиковой кислоты на лакмус и цинк.
б).К 1 мл раствора фтороводородной кислоты прилить раствор хлорида кальция. Что наблюдается? Написать уравнения проведенных реакций.
Фториды каких металлов растворимы в воде? Чем объясняется низкая степень диссоциации фтороводородной кислоты? Каково процентное содержание фторида водорода в его азеотропной смеси с водой и в продажной плавиковой кислоте?
1.4. 2. Травление стекла фтороводородной кислотой. Покрыть стеклянную пластинку слоем парафина. Для этого ее следует опустить в расплавленный в фарфоровой чашке парафин и тотчас же вынуть. Концом перочинного ножа сделать на парафинированной поверхности надпись таким образом, чтобы открыть поверхность стекла. По краям надписи сделать из парафина небольшой барьер. Налить 10%-й раствор фтороводородной кислоты на парафинированную пластинку и оставить ее под тягой. Через 1-2 ч смыть раствор с пластинки и снять парафин. Что произошло со стеклом? Написать уравнения реакций.
2. Кислородные соединения галогенов
При выполнении экспериментов с хлоратами и некоторыми перхлоратами металлов (бертолетова соль, "ангидрон", перхлораты щелочных металлов и др.) следует иметь в виду, что их смеси с органическими веществами взрывоопасны, чувствительны к трению, удару и нагреванию. Особенно легко происходит взрыв хлоратов в смеси с серой, красным фосфором, сульфидами фосфора, сурьмой, углем, крахмалом, сажей, сахаром. Опасность взрыва повышается в присутствии бромата калия. При смешении хлоратов с солями аммония образуется продукт, взрывающийсяпри 100С, а при длительном хранении самовоспламеняющийся.
2.1. Белильная известь
2.1.1. Получение белильной извести. (Опыт проводить под тягой!)
а) К 2 г чистой гашеной извести (гидроксида кальция) добавить 10-15 мл воды и хорошо перемешать. Полученную смесь поместить в маленький стакан, охлаждаемый льдом (почему необходимо охлаждение?), и пропускать хлор, очищенный от хлорида водорода (как это сделать?), в течение 10-20 мин. Написать уравнение реакции.
б) К 5 г чистой гашеной извести добавить 2 мл воды и приготовить тонкую суспензию (фарфоровая ступка). Поместить последнюю в стеклянную трубку и пропускать через нее ток чистого хлора (необходимо охлаждение трубки; студенту предлагается разработать конструкцию прибора) до прекращения изменения массы (1-1,5 ч). Укажите условия хранения препарата.
2.1.1.Свойства белильной извести.
а)Часть полученного препарата обработать 10 мл воды и отфильтровать не растворившиеся вещества. Взять небольшое количество полученного раствора и испытать его
на индиго и окрашенную ткань. Объяснить наблюдаемое явление .
Может ли угольная кислота вытеснить хлорноватистую кислоту из раствора её солей ? Сравнить величины констант диссоциации угольной и хлорноватистой кислот .
б)К части полученного раствора белильной извести прилить раствор 1н.серной кислоты до кислой реакции и осторожно понюхать. Написать уравнения реакций. Что происходит с белильной известью при нагревание концентрированного раствора?
Как изменяется сила кислот в ряду: хлорноватистая – бромноватистая - йодноватистая кислота? Какие ионы находится в растворах этих кислот? Как изменяется в указанном ряду устойчивость и окислительное действие кислот? Объяснить наблюдаемые закономерности.
2.2. Бертолетова соль (хлорат калия )
2.2.1 Свойства бертолетовой соли. (Опыт проводить под тягой!)
а)В маленькую фарфоровую чашку положить несколько кристаллов бертолетовой соли и осторожно смочить их 3-4 каплями 96 %-го раствора серной кислоты. Что наблюдается? Проделать аналогичный опыт с концентрированной хлороводородной кислотой. Что наблюдается в этом случае? Написать уравнения реакций. Какие продукты образуются при взаимодействии бертолетовой соли с щавелевой кислотой?
б) Отвесить 0,5 г мелкокристаллической бертолетовой соли и смешать палочкой (осторожно!) с равным количеством сахарной пудры. Высыпать смесь на крышку от тигля и смочить ее 2-3 каплями концентрированной серной кислоты. Что происходит? На какие свойства бертолетовой соли указывают проделанные опыты?
2.3. Йодноватая кислота.
Приготовить раствор йодноватой кислоты путём растворения оксида йода (V) в воде и разлить его в 2 пробирки. В одну пробирку прилить раствор йодида калия. Какое вещество при этом выделяется? В другую пробирку прилить подкисленный серной кислотой раствор сульфата железа (II). Что наблюдается? Написать уравнения реакций. На какие свойства йодноватой кислоты указывают проведенные опыты? Написать формулы йодных кислот. Какие известны кислородные соединения йода? Как они получаются ?
2.4 .Сравнение окислительных свойств галогенов .
Приготовить немного раствора бромноватой кислоты. Для этого 2-3 капли насыщенного раствора бромата калия смешать с 1-2 мл разбавленного раствора серной кислоты. Бросить в раствор маленький кристаллик йода, несколько раз перемешать содержимое пробирки, декантировать раствор и прилить к нему несколько капель органического растворителя. Что наблюдается? Написать уравнения реакций. Будет ли бром вытеснять йод из йодноватой кислоты?
Расположить галогены в ряд по их способности вытеснять друг друга из растворов галогеноводородов и их солей, а также из кислородных соединений и объяснить это явление, исходя из величин стандартных окислительно-восстановительных потенциалов. Какой из галогенов имеет большее количество кислородных соединений? В чем заключается явление вторичной периодичности, наблюдаемое в группе галогенов?
Лабораторная работа 4 Сера. Селен. Теллур
Опыт №1 Сера и ее свойства
Ромбическая сера. В сухую пробирку налить 4-5мл хлороформа[2] (под тягой!) и небольшими порциями, встряхивая содержимое пробирки, присыпать порошок серы до образования насыщенного раствора. Полученный раствор профильтровать в фарфоровую чашку (не смачивать фильтр водой, почему?), покрыть ее стеклом и оставить в вытяжном шкафу для медленного испарения. Каплю раствора поместить на предметное стекло, закрыть покровным стеклом и наблюдать под микроскопом*, как растут кристаллы. Зарисовать кристаллы серы.
Моноклинная сера. Заполнить небольшой фарфоровый или шамотовый тигель серой и медленно расплавить ее. Расплав должен занимать не менее половины тигля. Охладить тигель, следя за образованием кристаллической корки. Когда кристаллы почти сомкнуться в центре, быстро вылить не успевшую застыть серу в стакан с водой. Рассмотреть под микроскопом и зарисовать образовавшиеся в тигле кристаллы.
Два-три полученных кристалла растворить в хлороформе на часовом стекле и после удаления растворителя рассмотреть форму вновь образовавшихся кристаллов. Какое строение молекул отвечает полученным модификациям серы?
Изменение серы при нагревании. Наполнить пробирку (1/3) кусочками серы и, держа ее в руке при помощи зажима, медленно обогревать в пламени горелки*. Наблюдать плавление и последующие изменения цвета и вязкости серы. Объяснить происходящие явления.
Получение пластической серы. Нагреть серу (~0,5г) до кипения и вылить ее тонкой струей в кристаллизатор* с холодной водой. Полученную массу вынуть из воды и высушить между листами фильтровальной бумаги. Испытать тягучесть серы и ее растворимость в хлороформе. Часть полученной массы сохранить до следующего занятия и снова изучить ее физические свойства. Из каких модификаций состоит пластическая сера?
Опыт №2 Соединения серы
№2.1 Сероводород
Сероводород ядовит! Все опыты с сероводородом следует проводить под тягой. Пострадавшего от сероводорода необходимо немедленно перенести из лаборатории на свежий воздух или дать вдыхнуть чистый кислород.
Получение сероводорода. Положить в пробирку 1-2г сульфида железа и налить 5-8мл 20%-го раствора хлороводородной кислоты. Закрыть пробирку пробкой с газоотводной оттянутой трубкой.
Свойства сероводорода.
1. Какой запах имеет выделяющийся газ? Поджечь лучинкой сероводород и, держа над пламенем мокрую лакмусовую бумажку, наблюдать изменение ее окраски. Написать уравнение реакции.
2. Внести в пламя сероводорода холодный тигель. Что появляется на поверхности тигля? Написать уравнение реакции.
3. Через бромную, хлорную воду*, а также через подкисленные растворы перманганата и дихромата калия, пропустить над смоченными полосками бумаги ток сероводорода. Что происходит? Написать уравнение реакции. На какое свойство сероводорода указывают происходящие явления?
Испытать водный раствор сероводорода на лакмус. Что наблюдается? Познакомиться по справочнику с константами диссоциации сероводородной кислоты.
Действие сероводорода на кровь. Пропустить ток сероводорода через разбавленную водой кровь*, предварительно выжатую из парного мяса. Что наблюдается? Объяснить происходящее явление.
№2.2 Сульфиды металлов
Получение сульфида аммония. Раствор сульфида аммония получают насыщением водного раствора аммиака* сероводородом. Определенный объем разбавленного водного аммиака (концентрацией не выше 8%) разделяют на две равные части. Одну часть насыщают в избытке сероводорода, после чего к раствору образующегося гидросульфида аммония прибавляют вторую часть раствора аммиака.
Хранить раствор сульфида аммония необходимо в плотно закрытой склянке, заполненной жидкостью до самой пробки (или в атмосфере азота).
Осаждение сульфидом аммония. В ряд пробирок налить по 2мл растворов солей железа (II), марганца (II), цинка, кадмия, свинца, сурьмы и меди. В каждую пробирку прибавить по 2мл раствора сульфида аммония. Отметить цвет образующихся осадков. Написать уравнения реакций и величины произведения растворимости сульфидов этих металлов. Объяснить, используя понятие «произведения растворимости», процесс осаждения сульфидов в этих условиях.
Испытать действие 3%-го раствора хлороводородной кислоты на полученные осадки, взяв небольшое количество их. Объяснить различное действие хлороводородной кислоты на сульфиды металлов.
Осаждение сероводородом. Испытать действие сероводорода на растворы тех же солей, используя для этого сероводородную воду или пропуская сероводород из аппарат Киппа* (газоотводную трубку следует тщательно промывать после каждого опыта).
Объяснить, почему осадки выпадают не из всех растворов. Какие вещества образуются при действии сероводорода на растворы соли железа (II)? Классифицировать исследованные сульфиды металлов по их растворимости в воде и кислотах.
Свойства сульфидов, растворимых в воде. Сульфид натрия растворить в воде. Разлить раствор в две пробирки. Испытать действие раствора сульфида натрия на индикаторы (фенолфталеин, лакмус). Как объяснить происходящее явление? Через раствор, находящийся во второй пробирке, пропустить ток оксида углерода (IV). Отметить запах выделяющегося газа. Написать уравнение реакции.
Что произойдет с сульфидом натрия, если его оставить в открытой банке? Объяснить процессы, протекающие в растворе гидроксида натрия при пропускании через него сероводорода.
№2.3 Диоксид серы (сернистый ангидрид)
(Опыты проводить под тягой!)
Получение диоксида серы.
1. Что образуется при горении серы на воздухе?
2. Положить в пробирку несколько кристаллов сульфита натрия и добавить 2-3 капли 70%-го раствора серной кислоты. Написать уравнение реакции и объяснить направление процесса на основании закона действующих масс.
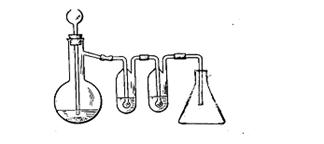
3.Собрать прибор, изображенный на рисунке. В промывной склянке должна находиться концентрированная серная кислота. В колбу Вюрца положить 3-5г медных стружек и залить их рассчитанным количеством 96%-го раствора серной кислоты. Сильно нагреть реакционную колбу на песчаной бане* до начала интенсивного выделения газа, после чего отставить горелку. Написать уравнение реакции.
Свойства диоксида серы.
1. Пропустим диоксид серы через 50-100мл дистиллированной воды. После его испарения закрыть отверстие склянки пробкой со стеклянной оттянутой трубкой. Перевернуть склянку с газом вверх дном и в таком положении погрузить ее в ванну с водой*. Объяснить происходящее явление. Написать уравнение реакции. Какие равновесия устанавливаются при растворении диоксида серы в воде?
2. Налить в пробирку 2мл раствора фуксина и пропустить через него ток диоксида серы. Что происходит? Прокипятить раствор. Что наблюдается? Чем объяснить происходящее явление?
Какие соли последовательно образуются при пропускании диоксида серы через раствор гидроксида натрия? Какие продукты образуются при прокаливании этих солей?
3. В две пробирки прилить по 4-6 капель хлорной и бромной воды соответственно, а также подкисленных серной кислотой растворов перманганата и бихромата калия и прилить раствор диоксида серы в воде. Что происходит? Написать уравнение происходящих реакций. Какие свойства проявляет при этом диоксид серы?
4. Налить в пробирку 1-2мл сероводородной воды и раствора сернистой кислоты. Что происходит? Написать уравнение реакции. Какие свойства в данном случае проявляет сернистая кислота? Какие вещества образуются при взаимодействии газообразных диоксида серы и сероводорода?
№2.4 Серная кислота и ее соли
(Опыты проводить под тягой!)
Отношение концентрированной серной кислоты к воде. Налить в стакан 10-15мл воды, измерить ее температуру и, не вынимая термометра, добавить 2мл 96%-го раствора серной кислоты. Записать показания термометра. В каком порядке следует приливать воду и концентрированную серную кислоту для приготовления растворов различной концентрации?
Действие серной кислоты на органические вещества.
1. В пробирку с небольшим количеством концентрированной серной кислоты опустить лучинку. Что происходит?
2. Приготовить 2-3мл раствора серной кислоты (1:1). Смочив конец стеклянной палочки этим раствором, сделать надпись на листе белой бумаги. Осторожно нагревая, высушить бумагу. Что происходит? На какие свойства серной кислоты указывают проделанные опыты?
3. В пробирку налить 2-3мл концентрированной серной кислоты. Поместить в нее 5г сахарной пудры, предварительно смоченной водой до состояния густой кашицы. Быстро перемешать массу стеклянной палочкой и наблюдать происходящие явления. Какие газообразные вещества при этом получаются?
Действие серной кислоты на неметаллы. В две пробирки налить 2-3мл 96%-го раствора серной кислоты*, внести в одну из них небольшой кусочек серы, в другую – угля и осторожно нагреть (под тягой!). Что происходит? Написать уравнение реакции.
Действие серной кислоты на металлы. Налить в пробирку 2-3мл концентрированного раствора серной кислоты и опустить в нее несколько кусочков железной проволоки. Что наблюдается? Осторожно нагреть пробирку. Происходит ли теперь какое-либо изменение? Какие свойства проявляет серная кислота в этом случае? В чем различие действия концентрированной и разбавленной серной кислоты на металлы? Чем объясняется большая сила и устойчивость серной кислоты по сравнению с сернистой кислотой?
Термическая устойчивость сульфатов.
1. В маленькую фарфоровую чашку или тигель поместить 1-2г гидросульфата натрия и сначала осторожно нагреть, а затем сильно прокалить. Какие соединения при этом образуются? Написать уравнение реакции.
2. На крышку фарфорового тигля положить несколько кристаллов сульфата железа (II), сначала нагреть их, затем сильно прокалить. Подержать над кристаллами универсальную индикаторную бумагу, смоченную водой. Что происходит. Написать уравнение реакции.
3. Проделать аналогичный опыт с гипсом и глауберовой солью. От чего зависит различная термическая устойчивость кислородосодержащих солей серы и соответствующих кислот?
№2.5 Свойства тиосульфата натрия
1. Растворить несколько кристаллов тиосульфата натрия в небольшом количестве воды и добавить 1-2мл раствора хлороводородной кислоты*. Что наблюдается? Написать уравнение реакции.
2. Положить на крышку тигля несколько кристаллов тиосульфата натрия и сначала осторожно, а затем сильно нагреть. Что наблюдается? Написать уравнение реакции. Доказать, какие вещества образовались при распаде тиосульфата натрия.
3. Налить в пробирку 3-4мл хлорной воды* и прибавлять по каплям раствор тиосульфата натрия до исчезновения запаха хлора. Написать уравнение реакции. Почему тиосульфат натрия называется «антихлором»?
4. Проделать аналогичный опыт с йодной водой. Написать уравнение реакции.
Почему при взаимодействии хлорной и йодной воды с тиосульфатом натрия получают различные продукты окисления серы? Что образуется при действии бромной воды на тиосульфат натрия? Какое техническое название имеет тиосульфат натрия?
Опыт №3 Оксиды селена (IV) и теллура(IV)
Соединения селена и теллура ядовиты! Опыт демонстрирует преподаватель!
Селен и его соединения являются сильнодействующими ядовитыми веществами (СДЯВ). Наиболее токсичны галогениды селена, селеноводород и растворимые в воде кислородные соединения селена. Симптомы отравления: неприятный запах от тела пострадавшего, раздражение дыхательных путей и глаз, затяжной насморк, головные боли.
По характеру действия на организм человека теллур и его соединения аналогичны неорганическим соединениям селена и мышьяка. Наиболее токсичен теллуроводород. Токсичны также оксиды теллура (IV), водные растворы солей теллуристой и теллуровой кислот. Только теллур («металлический») при попадание внутрь организма не вызывает токсического действия. Признаки отравления солями теллура: чесночный запах выдыхаемого воздуха, головная боль, учащение дыхания и пульса, ощущение усталости и головокружение.
Свойства оксида селена (IV).
1. Испытать отношение оксида селена (IV)* к воде, а также к растворам кислот и щелочей. Написать уравнение реакции.
2. К растворам селенистой кислоты в отдельных пробирках прибавить растворы хлорида олова (II), сернистой кислоты. Нагреть содержимое пробирок. Что наблюдается? На какие свойства селенистой кислоты указывает проведенные реакции? Написать уравнения реакций.
3. К раствору селенистой кислоты, подкисленному серной кислотой, в отдельных пробирках добавить растворы перманганата и бихромата калия. Нагреть содержимое пробирок. Что наблюдается? Написать уравнения реакций. Какие свойства проявляет селенистая кислота в этом случае?
Свойства оксида теллура(IV).
1. Испытать отношение диоксида теллура* к воде, а также к растворам гидроксида натрия* и соляной кислоты* при нагревании. Написать уравнение реакции.
2. К раствору оксида теллура (IV) в хлороводородной кислоте, разбавленному водой, прибавить растворы дихлорида олова и сернистой кислоты. Нагреть содержимое пробирок. Что наблюдается? Написать уравнение реакции. Какое свойство проявляют соли теллура (IV) в данных реакциях?
Сопоставить физические и химические свойства сернистой, селенистой и теллуристой кислот.
Список реактивов
1. Хлороформ
2. Порошок серы
3. Сульфид железа кристаллический
4. 20%-ый раствор соляной кислоты
5. Бромная вода
6. Хлорная вода
7. Йодная вода
8. Перманганат калия кристаллический
9. Дихромат калия кристаллический
10. Водный раствор аммиака (концентрация не выше 8%)
11. Соль Мора кристаллическая
12. Ацетат свинца кристаллический
13. Хлорид марганца (II) кристаллический
14. Сульфат цинка кристаллический
15. Сульфат меди (II) пентагидрат
16. Хлорид сурьмы кристаллический
17. 3%-ый раствор соляной кислоты
18. Сульфид натрия кристаллический
19. Фенолфталеин кристаллический
20. Лакмус кристаллический
21. Сульфит натрия кристаллический
22. 70%-ый раствор серной кислоты
23. Медные стружки
24. 96%-ый раствор серной кислоты
25. Фуксин кристаллический
26. Железная проволока
27. Гидросульфат натрия кристаллический
28. Гипс
29. Глауберова соль
30. Тиосульфат натрия кристаллический
31. Оксид селена (IV)
32. Оксид теллура(IV)
33. Селенистая кислота
34. Хлорид олова (II) кристаллический
35. Раствор гидроксида натрия
36. Уголь активированный
37. Сахарная пудра
38. Лучинка
Список приборов
1. Пробирки, 20 шт
2. Фарфоровая чашка
3. Предметное стекло
4. Покровное стекло
5. Часовое стекло
6. Химический стакан емкостью 100мл, 1 шт
7. Пробиркодержатель
8. Пробирка с пробкой с газоотводной оттянутой трубкой
9. Аппарат Киппа
10. Колба Вюрца
11. Промывная склянка
12. Колба коническая емкостью 250мл, 1 шт
13. Универсальная индикаторная бумага
14. Колба с пробкой с газоотводной оттянутой трубкой
15. Фарфоровый тигель, 4 шт
16. Химический стакан емкостью 400мл, 1 шт
17. Термометр(0-360°С)
18. Стеклянная палочка
19. Кристаллизатор
20. Микроскоп
21. Песчаная баня
22. Сухое горючее
23. Спички
Лабораторная работа №5 Азот
Опыт №1 Получение и свойства азота
Насыпать в пробирку 1-2 г измельченного нитрита натрия или калия, прилить по каплям 2-3 мл концентрированного раствора хлорида аммония, закрыть пробирку пробкой с газоотводной трубкой и осторожно (почему?) нагреть (см. рис.1). Собрать выделяющийся газ и проверить, поддерживает ли он горение. Написать уравнение реакции получения азота.
Рис.1 Прибор для получения азота
В пробирку или в колбу Вюрца (или Энглера) положить немного хлорной извести, в капельную воронку налить концентрированный раствор аммиака. Приливая к хлорной извести по каплям раствор аммиака, собрать выделяющийся азот в пробирку. Написать уравнение реакции. Проверить, поддерживает ли азот горение. Как отличить азот от диоксида углерода? Чем объясняется малая реакционная способность азота? Как получают азот в промышленности? Где применяется азот?
Дата добавления: 2018-04-15; просмотров: 1654; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
