Способы и средства экспериментирования
Для изучения функций организма используют различные способы исследования их деятельности. Они могут быть сведены в 4 большие группы методов:
1) подавление функции вплоть до ее выключения;
2) стимуляция функций;
3) регистрация электрической активности;
4) моделирование.
Подавление функции вплоть до ее полного выключения осуществляют во многих случаях путем хирургического удаления (экстирпации) органа или его частей. Таким способом определяли распределение зрительной, слуховой и других функций между областями коры головного мозга. Подавление функции может быть вызвано также химически – фармакологическими средствами избирательного действия. Так, атропиновая блокада импульсов от блуждающего нерва выявляет его роль в иннервации сердца. Используют и такие способы выключения деятельности органа, как его денервация, холодовое блокирование и другие средства.
Примером кратковременного выключения функции может служить прекращение деятельности коры головного мозга на несколько минут при прохождении волны подавления электрической активности (распространяющаяся депрессия Леао), вызванной химическим, электрическим или иным раздражением.
Стимуляция функций путем раздражения может осуществляться разными физическими и химическими раздражителями. Среди них особое место занимает электрический ток, получивший самое широкое распространение благодаря возможности точно дозировать его силу, время действия, место приложения, а также повторно применять, не повреждая ткани. Эти преимущества электрического раздражителя по сравнению с химическими, механическими, тепловыми и другими определяются его ионной природой и связанными с ней свойствами. Основой используемых в современном физиологическом эксперименте электрических стимуляторов служит электронный генератор, импульсы которого могут быть любой формы, длительности (от миллиардных долей секунды до практически постоянного тока) и частоты (от одиночных импульсов до десятков тысяч в секунду). Можно подавать импульс за импульсом в определенной последовательности, например, уменьшая интервал между ними для измерения времени восстановления возбудимости. Многоканальные стимуляторы позволяют одновременно или с заданным отставанием раздражать различные структуры изучаемых тканей и органов.
|
|
|
Регистрация электрических потенциалов (микроэлектродная техника, метод вызванных потенциалов, ЭЭГ)Методы регистрации электрических потенциалов оказываются практически единственным и потому незаменимым средством прямого наблюдения за быстрыми изменениями состояния отдельных нервных клеток, проведением импульсов по нервам, возбуждением нервных центров и т. п., поэтому в физиологии нервной системы эти методы занимают особое место.
|
|
|
К достоинствам метода регистрации электрических потенциалов относится возможность получить информацию о функционировании исследуемого органа без какого бы то ни было вмешательства и нарушения его деятельности.
Электрофизиологические методы исследования позволяют наблюдать течение физиологических процессов в диапазоне от долей миллисекунды до нескольких дней.
Пропустим значительный отрезок истории и обратимся к XIX столетию. К этому времени уже появились первые физические приборы (струнные гальванометры), которые позволяли исследовать слабые электрические потенциалы от биологических объектов. В Манчестере (Англия) Г. Катон впервые поместил электроды (металлические проволочки) на затылочные доли головного мозга собаки и зарегистрировал колебания электрического потенциала при освещении светом ее глаз. Подобные колебания электрического потенциала сейчас называют вызванными потенциалами и широко используют при исследовании мозга человека. Это открытие прославило имя Катона и дошло до нашего времени, но современники замечательного ученого глубоко чтили его как мэра Манчестера, а не как ученого.
|
|
|
В России подобные исследования проводил И. М. Сеченов: ему впервые удалось зарегистрировать биоэлектрические колебания от продолговатого мозга лягушки. Другой наш соотечественник, профессор Казанского университета И. Правдич-Неминский изучал биоэлектрические колебания мозга собаки при различных состояниях животного – в покое и при возбуждении. Собственно, это были первые электроэнцефалограммы. Однако мировое признание получили исследования, проведенные в начале XX века шведским исследователем Г. Бергером. Используя уже более совершенные приборы, он зарегистрировал биоэлектрические потенциалы головного мозга человека, которые теперь называют электроэнцефалограммой. В этих исследованиях впервые был зарегистрирован основной ритм биотоков мозга человека – синусоидальные колебания с частотой 8-12 в секунду, который получил название альфа-ритма. Это можно считать началом современной эры исследования физиологии головного мозга человека.
Современные методы клинической и экспериментальной электроэнцефалографии сделали значительный шаг вперед благодаря применению компьютеров. Обычно на поверхность скальпа при клиническом обследовании больного накладывают несколько десятков чашечковых электродов. Далее эти электроды соединяют с многоканальным усилителем. Современные усилители очень чувствительны и позволяют записывать электрические колебания от мозга амплитудой всего в несколько микровольт (1 мкВ =10-3В). Далее достаточно мощный компьютер обрабатывает ЭЭГ по каждому каналу. Психофизиолога или врача, в зависимости от того, исследуется мозг здорового человека или больного, интересуют многие характеристики ЭЭГ, которые отражают те или иные стороны деятельности мозга, например ритмы ЭЭГ (альфа, бета, тета и др.), характеризующие уровень активности мозга. Так, например, во время хирургической операции современные анестезиологи наблюдают за глубиной наркоза больного.
|
|
|
Многие исследования нейробиологи проводят на достаточно простых объектах: один из классических объектов современной нейрофизиологии – головоногий моллюск кальмар и нервное волокно (так называемый гигантский аксон), на котором были выполнены классические исследования по физиологии возбудимых мембран.
В последние годы для этих целей все шире применяют прижизненные срезы головного мозга новорожденных крысят и морских свинок и даже культуру нервной ткани, выращенную в лаборатории.
Электрофизиологические методы позволяют проводить исследование механизмов функционирования отдельных нервных клеток и их отростков. Например, у головоногих моллюсков (кальмара, каракатицы) имеются очень толстые, гигантские аксоны (диаметром 0,5-1 мм), по которым из головного ганглия передается возбуждение на мускулатуру мантии. Молекулярные механизмы возбуждения исследуются на этом объекте. У многих моллюсков в нервных ганглиях, заменяющих у них головной мозг, есть очень большие нейроны – диаметром до 1 мм. Эти нейроны являются излюбленными объектами при изучении работы ионных каналов, открытие и закрытие которых управляется химическими веществами. Ряд вопросов передачи возбуждения от одного нейрона другому исследуется на нервно-мышечном соединении – синапсе (синапс в переводе с греческого означает контакт). Эти синапсы по размерам в сотни раз больше подобных синапсов в головном мозге млекопитающих. Здесь протекают весьма сложные и до конца не изученные процессы.
Например, нервный импульс в синапсе приводит к выбросу химического вещества, вследствие действия которого возбуждение передается на другой нейрон. Исследование этих процессов и их понимание лежат в основе целой современной индустрии производства лекарственных средств и других препаратов. Список вопросов, которые может решать современная нейробиология, бесконечно велик. Некоторые примеры мы рассмотрим далее.
Для регистрации биоэлектрической активности нейронов и их отростков применяют специальные приемы, которые называютсямикроэлектродной техникой. Микроэлектродная техника в зависимости от задач исследования имеет много особенностей. Обычно применяют два типа микроэлектродов – металлические и стеклянные.
Рис.5. Микроэлектроды на фоне монеты
Металлические микроэлектроды часто изготавливают из вольфрамовой проволоки диаметром 0,3-1 мм. На первом этапе нарезают заготовки длиной по 10-20 см (это определяется глубиной, на которую будет погружен микроэлектрод в мозг исследуемого животного). Один конец заготовки электролитическим методом затачивают до диаметра 1-10 мкм. После тщательной промывки поверхности в специальных растворах ее покрывают лаком для электрической изоляции. Самый кончик электрода остается неизолированным (иногда через такой микроэлектрод пропускают слабый толчок тока, чтобы дополнительно разрушить изоляцию на самом кончике).
Для регистрации активности одиночных нейронов микроэлектрод закрепляют в специальном манипуляторе, который позволяет продвигать его в мозге животного с высокой точностью. В зависимости от задач исследования манипулятор может крепиться на черепе животного или отдельно. В первом случае это очень миниатюрные устройства, которые получили название микроманипуляторов. Характер регистрируемой биоэлектрической активности определяется диаметром кончика микроэлектрода. Например, при диаметре кончика микроэлектрода не более 5 мкм можно зарегистрировать потенциалы действия одиночных нейронов (в этих случаях кончик микроэлектрода должен приблизиться к исследуемому нейрону на расстояние около 100 мкм). При диаметре кончика микроэлектрода больше 10 мкм одновременно регистрируется активность десятков, а иногда сотен нейронов (мультиплай-активность).
Другой широко распространенный тип микроэлектродов изготавливают из стеклянных капилляров (трубочек). Для этой цели используются капилляры диаметром 1-3 мм. Далее на специальном устройстве, так называемой кузнице микроэлектродов, выполняют следующую операцию: капилляр в средней части разогревают до температуры плавления стекла и разрывают. В зависимости от параметров этой процедуры (температуры нагрева, величины зоны нагрева, скорости и силы разрыва и пр.) получают микропипетки с диаметром кончика до долей микрометра. На следующем этапе микропипетку заполняют специальным раствором соли и получают микроэлектрод. Кончик такого микроэлектрода можно вводить внутрь нейрона (в тело или даже в его отростки), не сильно повреждая его мембрану и сохраняя его жизнедеятельность.
Моделирование приобрело значение метода исследования физиологических функций в связи с развитием кибернетики. В широком смысле слова моделью функции может быть ее логическая модель, математическая модель и конструкция макета, воспроизводящего некоторые проявления моделируемой функции в своих действиях. Однако в моделях воспроизводятся лишь некоторые искусственно выделенные среди остальных свойства прототипа, а не весь он в своем многообразии свойств, поэтому моделирование неизбежно связано с некоторым упрощением задачи исследования сложной функции и при этом нуждается в четком определении граничных условий применимости модели.
Современные:
· Томография(магнитно-резонансная – послойно; позитронно-эмиссионная – имеет еще более высокое разрешение – в мозговой кровоток позитрон-излучающего изотопа – трехмерный образ). Но при томографии не улавливаются многие скоростные процессы в мозге, для которых подходят больше все же электрофизиологические методы.
Рис.6. Компьютерная томография
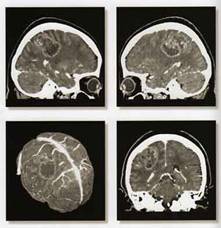
Рис.7. Томография головного мозга
Методы исследования головного мозга человека постоянно совершенствуются. Так, современные методы томографии позволяют увидеть строение головного мозга человека, не повреждая его. Головной мозг облучают электромагнитным полем, применяя для этого специальный магнит. Под действием магнитного поля диполи жидкостей мозга (например, молекулы воды) принимают его направление. После снятия внешнего магнитного поля диполи возвращаются в исходное состояние, при этом возникает магнитный сигнал, который улавливается специальными датчиками. Затем это эхо обрабатывается с помощью мощного компьютера и методами компьютерной графики отображается на экране монитора. Благодаря тому, что внешнее магнитное поле, создаваемое внешним магнитом, можно сделать плоским, таким полем как своеобразным «хирургическим ножом» можно «резать» головной мозг на отдельные слои. На экране монитора ученые наблюдают серию последовательных «срезов» головного мозга, не нанося ему никакого вреда. Этот метод позволяет исследовать, например, злокачественные образования головного мозга.
Еще более высоким разрешением обладает метод позитронно-эмиссионной томографии (ПЭТ). Исследование основано на введении в мозговой кровоток позитрон-излучающего короткоживущего изотопа. Данные о распределении радиоактивности в мозге собираются компьютером в течение определенного времени сканирования и затем реконструируются в трехмерный образ. Метод позволяет наблюдать в головном мозге очаги возбуждения, например, при продумывании отдельных слов, при их проговари-вании вслух, что свидетельствует о его высоких разрешающих возможностях.
Вместе с тем многие физиологические процессы в головном мозге человека протекают значительно быстрее тех возможностей, которыми обладает томографический метод. В исследованиях ученых немаловажное значение имеет финансовый фактор, т. е. стоимость исследования. К сожалению, томографические методы очень дороги: одно исследование мозга больного человека может стоить десятки тысяч рублей.
· Изучение мозгового кровотока
Метод Кети–Шмидта, позволяет количественно оценить в целом усредненный мозговой кровоток путем определения скорости насыщения ткани головного мозга инертным газом (обычно после вдыхания небольших количеств закиси азота).
Динамическая сцинтиграфия (метод функциональной визуализации, заключающийся во введении в организм радиоактивных изотопов и получении изображения путём определения испускаемого ими излучения) мозга основана на внутривенном введении радиофармпрепарата (99mTc) и немедленной регистрации прохождения максимальной массы радионуклида (болюса) по сосудам головного мозга. График прохождения болюса позволяет провести сравнительную оценку кровенаполнения полушария головного мозга и его отдельных областей. К динамической радионуклидной диагностике относится также изучение мозгового кровотока с помощью радиоактивного газа ксенона (133Хе) или газообразного водорода, которые вводят внутриартериально, внутривенно или ингаляционно. Метод позволяет определить объемный кровоток отдельно в сером и белом веществе по полушариям и различным областям головного мозга на основании кривых клиренса (скорости очищения).
Прямым (но не количественным) методом оценки мозгового кровотока является метод определения изменений объема крови в поверхностно расположенных сосудах головного мозга с помощью радионуклидов, которыми метят белки плазмы крови.
Радиоизотопные исследования с помощью 133Хе могут проводиться в комплексе с компьютерной томографией мозга, что дает возможность получать графическое изображение регионарного кровотока в мозге. Позитронная эмиссионная томография мозга позволяет оценивать не только регионарный мозговой кровоток, но и метаболические (окислительно-восстановительные) процессы в ткани мозга.
Реоэнцефалография является косвенным методом исследования мозгового кровотока, при котором по пульсовым колебаниям электрического сопротивления различных участков мозга определяют состояние эластико-тонических свойств сосудистой стенки, оценивают пульсовое кровенаполнение и в ряде случаев – состояние венозного кровообращения.
Транскраниальная ультразвуковая допплерография – метод, основанный на эффекте Допплера, позволяющий получать информацию о проходимости внутримозговых сосудов, линейной скорости и направлении кровотока в них.

Рис.8. Изучение мозгового кровотока с помощью реоэнцефалограммы
· Термография
Термография – метод регистрации инфракрасного излучения головного мозга в целях диагностики различных заболеваний.
· Методы нейропсихологии
Еще одно направление исследования головного мозга человека возникло в годы Второй мировой войны –это нейропсихология.Одним из основоположников этого подхода был профессор Московского университета Александр Романович Лурия. Метод представляет собой сочетание приемов психологического обследования с физиологическим исследованием человека с поврежденным головным мозгом.
Дата добавления: 2018-04-05; просмотров: 261; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
