Определение концентрации приготовленного раствора титрованием
Nbsp; Федеральное агентство по образованию Российской Федерации Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
Кафедра неорганической химии
Лабораторная работа №4
Тема: Приготовление раствора и определение его концентрации
По дисциплине: Химия
Выполнила: студентка гр. ГНГ ______________ /Иванов И.И/
ОЦЕНКА: _____________
Дата: __________________
ПРОВЕРИЛ: ______________ /Иванов И.И/
Санкт-Петербург
2012 год.
Цель работы: Ознакомиться с методами приготовления растворов заданной концентрации и анализом раствора при помощи титрования.
Общие сведения:Раствором называют однородную систему из двух или более компонентов, состав которой может изменяться непрерывно. В растворе выделяют растворитель – вещество, образующее непрерывную среду, в которой распределены частицы растворенного вещества. Концентрацией раствора называют соотношение между количествами растворенного вещества и растворителя. Концентрацию растворов выражают различными способами, наиболее распространенными из которых являются следующие:
|
|
|
1)Процентная концентрация – число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора,
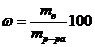 , %
, %
2)Концентрация, выраженная в граммах на литр,Сг/л- показывает ,какая масса растворенного вещества, выраженная в граммах,содержится в единице объема раствора:
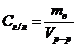 .
.
.3) Молярная концентрация Cмили простомолярность– число молей растворенного вещества в 1 л раствора,
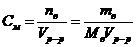 , моль/л.
, моль/л.
4) Моляльная концентрация Cm илиm – число молей растворенного вещества, приходящихся на 1 кг. Растворителя,
 , моль/кг.
, моль/кг.
5) Мольная доля– отношение числа молей растворенного вещества к общему числу молей компонентов раствора,
 .
.
6) Нормальная концентрация СN– число эквивалентов растворенного вещества в 1 л. раствора,
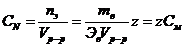 , экв/л или н.,
, экв/л или н.,
где z - число эквивалентов в моле вещества, определение которого описано во введении к работе 1.
Приём количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации, называют титрованием. Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическими уравнениями при отсутствии избытка реагента, называют точкой эквивалентности. Задача титрования – определить эквивалентный объём добавляемого реагента – титранта, необходимый для установления точки эквивалентности, так как в ней числа эквивалентов определяемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объём раствора. Следовательно:
|
|
|
СNxVx = CNtVt
Отобрав для титрования мерной пипеткой точный объём пробы Vx, зная нормальность титранта CNt и определив эквивалентный Vt, по формуле можно вычислить концентрацию пробы C Nx.
До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко изменяются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объём титрата.
Определение концентрации приготовленного раствора титрованием
|
|
|
1. В 2 конические колбы пипеткой Мора отобрала аликвотные объемы приготовленного раствора 5 мл, добавила немного дистиллированной воды (до толщины слоя жидкости около 5 мм) и 2−3 капли индикатора – фенолфталеина.
2. Бюретку на 25 мл наполнила титрованным раствором едкого натра.
Затем медленно, по каплям, добавила раствор щелочи из бюретки к аликвоте кислоты, непрерывно перемешивая раствор в конической колбе.
3. Эквивалентную точку определила по переходу окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с.
4. Титрование повторила 2−3 раза, измеренные эквивалентные объемы щелочи усреднила.
Протокол лабораторной работы
1. 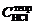 =0,23н- заданная преподавателем концентрация соляной кислоты.
=0,23н- заданная преподавателем концентрация соляной кислоты.
2. Расчитала объем соляной кислоты, необходимый для приготовления 100 мл раствора кислоты заданной концентрации
Cn=z*CM, Cм= Cn /z=0,23 моль/л,
n=CМ*Vр-р=0,23*0,1=0,023 моль,
m(HCl)=0,023*36,5=0,8395 г
 см3
см3
3. Объем аликвоты соляной кислоты, взятый для титрования, V2 =5 мл.
4. Концентрация раствора щелочи CNaOH = 0,21 экв/л.
5. Объем щелочи, пошедший на титрование пробы соляной кислоты:
VNaOH, 1 = 5,5мл;
VNaOH,2 = 5,7мл;
VNaOH,ср = 6 мл.
Дата добавления: 2018-04-05; просмотров: 2918; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
