ПЕРЕТРАВЛЕННЯ І ОБМІН ЛІПІДІВ
Амінокислота, яка містить ароматичну R-групу: а) тирозин б) аланін в) аспарагінова кислота г) метіонін Амінокислоти –органічні (карбонові) кислоти, які містять, як правило, одну або дві аміногрупи (-NH2). За характером структури А. поділяються на дві групи: ациклічні та циклічні, які підрозділяються на підгрупи. Загальна формула амінокислот: де R – карбоновий радикал. Залежно від положення аміногрупи у вуглецевому ланцюзі відносно карбоксилу розрізняють α-, β-, γ- і т.д. А. У природі розповсюджені α–А., які мають (крім гліцину) один або два асиметричних атоми Карбону і, в основному, L-конфігурацію. Ізоелектрична точка білків – це значення рН, за якого: а) білок стає найбільш іонізованим б) білок є електронейтральним в) молекула білка набуває позитивного заряду г) білок рухливий в електричному полі Ізоелектрична точка білка –значення рН, при якому частки білка не переміщуються в електричному полі ні до аноду, ні до катоду, а сумарний заряд їх дорівнює нулю. При такому рН речовина найменш рухлива в електричному полі, і цю властивість можна використовувати для очищення та розділення розчинних речовин шляхом електрофорезу. Реагенти, які викликають денатурацію: а) CuSO4, HNO3, HCl б) (NH4)2SO4, NaCl, (CH3COO)2Pb в) CuSO4, (CH3COO)2Pb, NaCl г) (CH3COO)2Pb, MgCl2, (NH4)2SO4 Денатурація – втрата природної (нативної) конфігурації молекулами білків, нуклеїнових кислот та ін біополімерів у результаті нагрівання, хімічної обробки і т.п. Обумовлена розривом нековалентних (слабких) зв’язків у молекулах біополімерів (слабкими зв’язками підтримується просторова структура біополімерів). Звичайно супроводжується втратою активності: ферментативної, гормональної та ін. Може бути повною і частковою, оборотною і необоротною Д., не порушує міцних ковалентних хімічних зв’язків, але розкривання глобулярної структури робить доступними для розчинів і хімічних реагентів радикали, що знаходяться всередині молекули. Зокрема, Д. полегшує дію протеолітичних ферментів, відкриваючи їм доступ до всіх частин молекули білка. Оборотну Д. нуклеїнових кислот використовують для їх молекулярної гібридизації. До дисахаридів відносяться: а) целюлоза, крохмаль б) фруктоза, глюкоза в) галактоза, мальтоза г) мальтоза, сахароза ДиСАХАРИДИ − складні вуглеводи, які складаються з двох залишків моноцукоридів. При їх утворенні дві молекули моноцукоридів втрачають частку води та з’єднуються між собою через кисень. Загальна формула дисахаридів − С12Н22О11. Дисахариди утворюються з двох молекул моносахаридів при взаємодії або глікозидного гідроксилу однієї гексози та спиртового гідроксилу іншої (мальтоза, лактоза, целобіоза), або двох глікозидних гідроксилів (сахароза) з виділенням молекули води (рис. 1). а б Рисунок 1 − Дисахариди: а − мальтоза; б − сахароза Сполучення молекул гексоз у дисахаридах відбувається за рахунок глікозидних зв’язків. Сполуки першого типу (мальтоза) мають одну карбонільну групу вільну, а тому дають усі реакції, характерні для моносахаридів. Сполуки другого типу (сахароза) не мають вільних карбонільних груп, унаслідок чого не дають реакцій, властивих моносахаридам (реакції відновлення металів, утворення озазонів тощо). Мальтоза володіє відновлювальними властивостями, оскільки має вільну гідроксильну групу; сахароза не володіє відновлювальними властивостями, тому що не має вільної гідроксильної групи. Найпоширенішим природним дисахаридом є сахароза. При кислотному або ферментативному гідролізі дисахариди розкладаються на моносахариди. Наприклад: С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6 сахароза глюкоза фруктоза До ненасичених вищих жирних кислот відносяться: а) олеїнова, лінолева, ліноленова б) пальмітинова, стеаринова, лінолева в) стеаринова, лінолева, ліноленова г) лінолева, арахідонова, пальмітинова Вища жирна кислота − кислота, яка має більше 4-х атомів Карбону в молекулі (R-COOH). У триацигліцеролів, восків переважають вищі жирні кислоти, що містять 16 атомів Карбону та більше. До вищих жирних кислот належать: − пальмітинова кислота − С15Н31СООН (С16:0); − стеаринова кислота − С17Н35СООН (С18:0); − олеїнова кислота − С17Н33СООН (С18:1, С9-10); − лінолева кислота − С17Н31СООН (С18:2, С9-10, С12-13); − ліноленова кислота − С17Н29СООН (С18:3, С9-10, С12-13, С15-16); − арахідонова кислота − С19Н31СООН (С20:4, С5-6, С8-9, С12-13, С15-16). Для вищих жирних кислот характерний числовий код. Наприклад, для пальмітинової кислоти − С16:0, де 16 означає загальну кількість атомів Карбону, 0 − відсутність подвійних зв’язків у структурі вищої жирної кислоти; для олеїнової кислоти − С18:1, С9-10. У цьому випадку 18 – загальна кількість атомів Карбону, 1 – кількість подвійних зв’язків, С9-10 − місце розташування подвійного зв’язку. Залежно від особливостей будови вищі жирні кислоти поділяються на: − насичені(немає подвійних зв’язків − пальмітинова, стеаринова); − ненасичені(є подвійні зв’язки – олеїнова, лінолева, ліноленова, арахідонова). Подвійні зв’язки в ненасичених вищих жирних кислотах мають цис-конфігурацію. Якщо до складу триацилгліцеролу входять залишки насичених вищих жирних кислот, триацигліцероли будуть твердими (тваринного походження). Тваринні жири − тверді речовини. Виняток становить риб’ячий жир, який є рідким. Якщо до складу триацигліцеролу входять залишки ненасичених вищих жирних кислот, триацигліцероли будуть рідкими (рослинного походження). Рослинні жири – це рідини (соняшникова, оливкова, обліпихова олія). Виняток становить кокосове масло, яке є твердим. Нейтральні жири під впливом кислот, лугів, ферментів (ліпаз) підлягають гідролізу з утворенням трьохатомного спирту − гліцеролу та вищих жирних кислот. Продуктами лужного гідролізу жирів є солі вищих жирних кислот – мила (процес омилення). Солі лужних металів розчинні у воді. Солі лужноземельних і важких металів – нерозчинні у воді. Формування вторинної структури ДНК відбувається за рахунок: а) гідрофобних взаємодій б) іонних зв’язків в) водневих зв’язків г) ковалентних зв’язків Вторинна структура ДНК – структура, що складається із двох антипаралельних полінуклеотидних ланцюгів, які утворюють подвійну спіраль (модель Уотсона та Кріка, 1953) (рис. 2). Рисунок 2 – Фрагмент вторинної структури ДНК Конфігурація подвійної спіралі утримується водневими зв’язками, що виникають між пуриновими й піримідиновими основами двох полінуклеотидних ланцюгів ДНК. Водневі зв’язки виникають між пуриновою та піримідиновою основами. Ці основи утворюють комплементарні пари. Між аденіном і тиміном утворюються два водневих зв’язки (рис. 3 а); між гуаніном і цитозином – три водневих зв’язки (рис. 3 б). а б Рисунок 3 − Комплементарні пари: між аденіном та тиміном (а), між гуаніном та цитозином (б)
|
|
|
|
|
|
|
|
|
|
|
|
Правила Чаргаффа
1. Вміст аденіну дорівнює вмісту тиміну, а вміст гуаніну − кількості цитозину:
А = Т, G = C
2. Кількість пуринових основ дорівнює кількості піримідинових основ:
А + G = Т + C
3. Кількість основ з 6 аміногруп дорівнює кількості основ з 6 кетогруп:
А + C = G + Т
Для кожного типу ДНК сумарний вміст гуаніну та цитозину не дорівнює сумарному вмісту аденіну й тиміну, тобто (G + C) / (A + T), як правило, відрізняється від 1 (може бути як > 1, так і < 1). За цією ознакою розрізняють два основних типи ДНК: АТ-тип з переважним вмістом аденіну й тиміну і GC-тип з переважним вмістом гуаніну та цитозину.
За допомогою біуретової реакції можна виявити в гідролізаті дріжджів:
а) рибозу і дезоксирибозу
б) білок
в) залишок фосфорної кислоти
г) пуринові основи
Дослід. Виявлення в гідролізаті дріжджів білка за допомогою біуретової реакції
Хід роботи.У пробірку до 5 крапель гідролізату дріжджів доливають
10 крапель 20%-го розчину натрій гідроксиду, потім 2 краплі 1%-го розчину купрум сульфату. Спостерігають появу рожевого або рожево-фіолетового забарвлення.
Ферменти, які приймають участь в розщепленні внутрішньо молекулярних зв’язків за участю води:
а) гідролази
б) лігази
в) ліази
г) ізомерази
Ферменти– специфічні органічні каталізатори, що синтезуються живими клітинами і прискорюють протікання біохімічних реакцій в організмі. Вони є білками (Дж. Самнер, 1926) з різними молекулярними масами: від 9 кДа (АОМ) до 1000 кДа. Кожен фермент каталізує певну хімічну реакцію.
Ферменти поділяються на 6 класів відповідно до типу реакції, яку вони каталізують (Комісія Міжнародного біохімічного союзу, 1961).
3-й клас. Гідролази − ферменти, які каталізують реакції гідролізу, тобто розкладання субстратів за участю молекули води. Гідролази здатні розщеплювати складноефірні, пептидні, глікозидні та інші зв’язки − естерази, пептидази та протеази, глікозидази.
До жиророзчинних вітамінів відносять:
а) А, D, В1, В2
б) В1, К, Е, В2
в) С, Н, РР, А
г) А, D, Е, К
Вітаміни –низькомолекулярні органічні сполуки, які виконують функції біологічних каталізаторів самостійно або в складі ферментів як кофактори. Основне джерело В. – рослини, у яких можуть міститися і так звані провітаміни (каротини та ін.), що перетворюються в В. у тваринному організмі. Важлива роль в утворенні В. належить мікроорганізмам (наприклад, мікрофлора рубця забезпечує жуйних В. групи В). Розрізняють водо- і жиророзчинні В. До водорозчинних В. відносяться: аскорбінова кислота (вітамін С), В. групи В – тіамін (вітамін В1), рибофлавін (вітамін В2), пантотенова кислота (вітамін В3), нікотинамід (ніацин, вітамін РР або В5), вітамін В6, вітамін В12 (кобаламін), біотин (вітамін Н), фолацин; до жиророзчинних: вітамін А, D (кальциферол), Е (токоферол) і К. Є група вітаміноподібних сполук – деякі флавоноїди (рутин), холін, інозит, ліпоєва, оротова, пангамова кислоти. На відміну від інших незамінних факторів харчування (амінокислоти, жирні кислоти та ін.), В. не є матеріалом для біосинтезів чи джерелом енергії. Однак вони беруть участь практично в усіх біохімічних і фізіологічних процесах, які складають сукупності обміну речовин.
В заданій долі гіпофізу секретується:
а) інсулін
б) вазопресин
в) глюкагон
г) тироксин
Гормони –біологічно активні речовини, що синтезуються в малих кількостях у спеціалізованих клітинах ендокринної системи і через циркулюючі рідини (наприклад, кров) доставляються до клітин-мішеней, де виконують свою регулюючу дію. Гормони, як і інші сигнальні молекули, володіють деякими загальними властивостями: утворюються з клітин, що виділяють їх у позаклітинний простір; не є структурними компонентами клітин і не використовуються як джерело енергії; здатні специфічно взаємодіяти з клітинами, що мають рецептори для даного гормону; мають дуже високу біологічну активність – ефективно діють на клітини в дуже низьких концентраціях (близько 10-6 - 10-11 моль/л).
Будова гормонів буває різною. За хімічною будовою гормони можна класифікувати за трьома класами:
1) білково-пептидні гормони (гормони гіпоталамуса і гіпофіза (у цих залозах синтезуються пептиди і деякі білки), а також гормони підшлункової і паращитовидної залоз і один з гормонів щитовидної залози);
2) похідні амінокислот (аміни, що синтезуються в мозковому шарі наднирників і в епіфізі, а також йодвмістні гормони щитовидної залози);
3) стероїдні гормони, що синтезуються в корі наднирників і в статевих залозах. По кількості вуглецевих атомів стероїди відрізняються один від одного: С21 − гормони кори наднирників і прогестерон; С19 − чоловічі статеві гормони – андрогени і тестостерон; С18 − жіночі статеві гормони − естрогени. Загальним для всіх стероїдів є наявність стеринового ядра –циклопентанпергідрофенантрену.
До пептидів належать багато біологічно активних речовин: глутатіон та деякі гормони (глюкагон, вазопресин, окситоцин та ін.).
Окислювальне фосфорилювання – це:
а) гідроліз АТФ до АДФ і фосфорної кислоти
б) перенесення залишку фосфорної кислоти від АТФ на іншу сполуку
в) синтез АТФ із АДФ і фосфорної кислоти
г) синтез АДФ із АТФ і фосфорної кислоти
Фосфорилювання – включення в молекулу залишку фосфатної кислоти. У живих клітинах здійснюється ферментами класу трансфераз (кіназами, фосфомутазами, фосфорилазами). Відіграє важливу роль в обмінних процесах, оскільки багаточисленні сполуки вступають у реакції обміну речовин лише у фосфорильованій (активованій) формі. Каталізоване протеїнкіназами Ф. білків (зокрема, ферментів) виконує регуляторну функцію. Важливе значення в енергетиці живої клітини має Ф. АДФ з утворенням АТФ, яке відбувається під впливом поліферментної системи за рахунок окиснення низькомолекулярних сполук киснем у дихальному ланцюзі (окиснювальне фосфорилювання) або в анаеробних умовах (наприклад, гліколітичне фосфорилювання). Енергія, акумульована у вигляді високоенергетичних зв’язків АТФ, використовується організмом для руху, синтезу необхідних речовин і т.п. У фотосинтезуючих організмів Ф. АДФ з утворенням АТФ може також відбуватися при фотосинтезі (фотофосфорилювання).
Який чистий вихід АТФ при гліколізі в анаеробних умовах на 1 молекулу глюкози?
а) 1 моль
б) 4 моль
в) 3 моль
г) 2 моль
Гліколізшлях Ембдена-Мейергофа-Парнаса – ферментативний анаеробний процес негідролітичного розпаду вуглеводів (головним чином глюкози) до молочної кислоти.
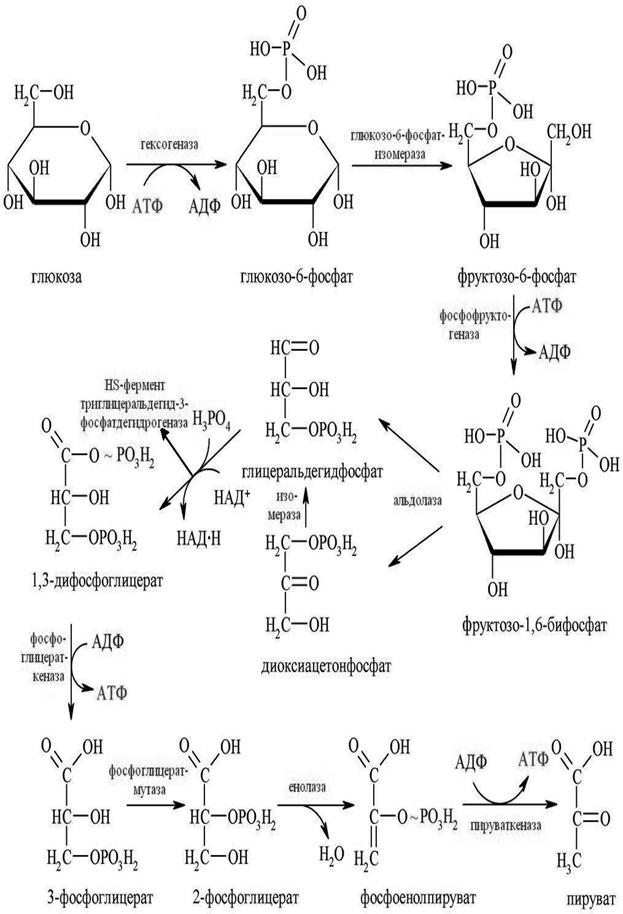
Рисунок 3 - Схема глiколiзу
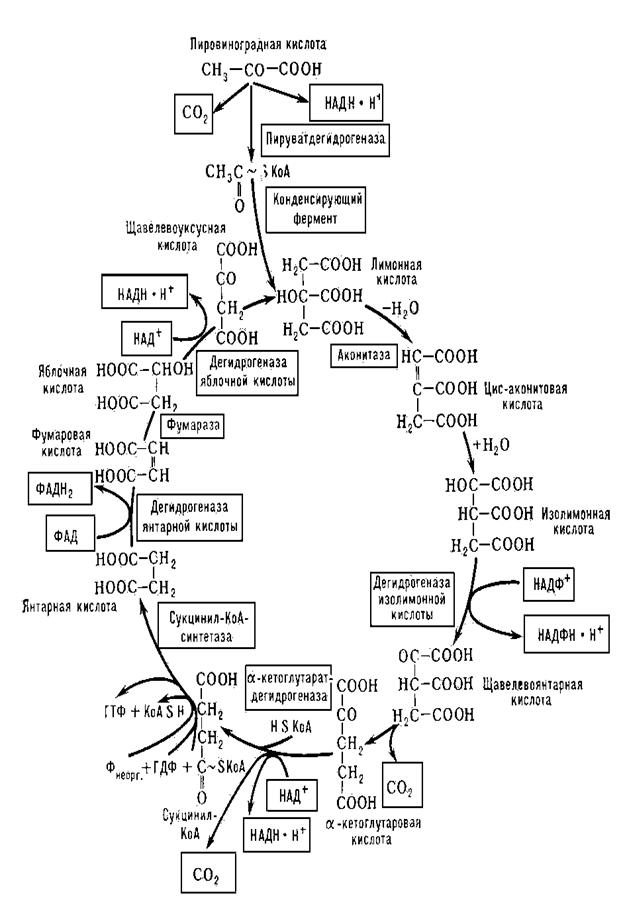
Ключова проміжна сполука, яка утворюється при окисненні вуглеводів, ліпідів та амінокислот?
а) оксалоацетат
б) ацетил-КоА
в) фосфоенолпіруват
г) малат
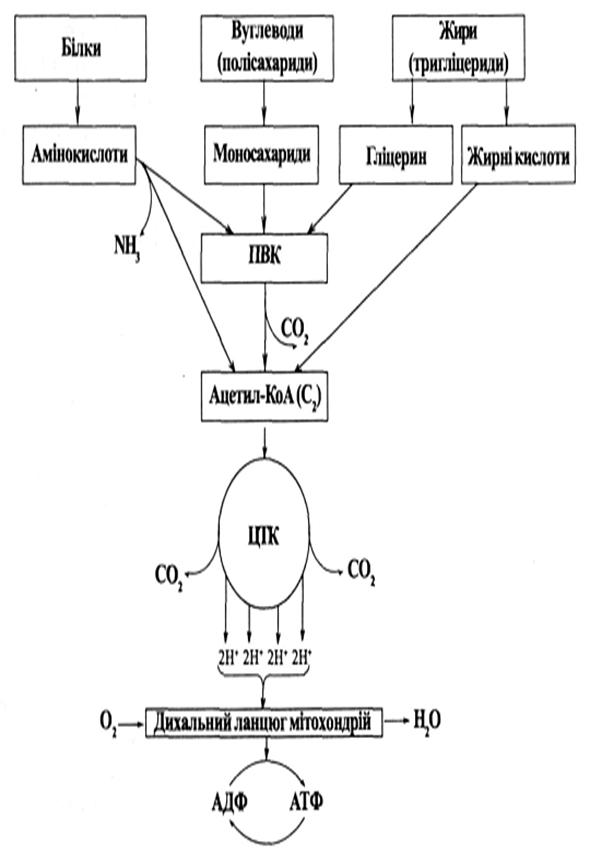
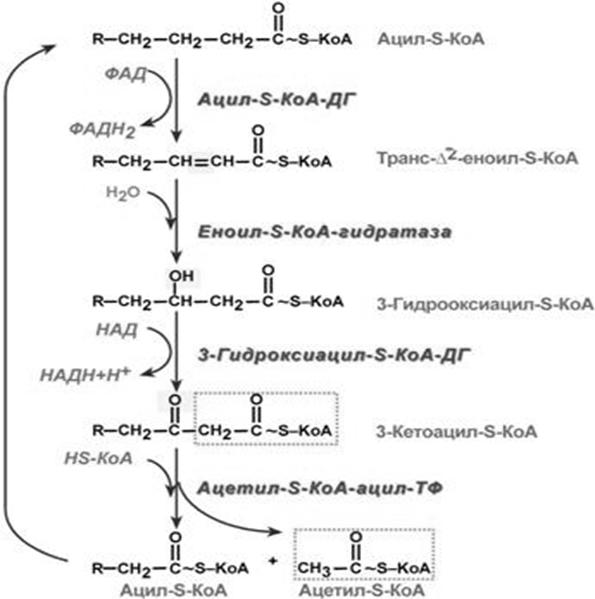
Рисунок 5 − Послідовність реакцій β-окислення жирних кислот
(загальна схема)
Фермент хімотрипсин виділяється:
а) підщлунковою залозою
б) щитовидною залозою
в) статевими залозами
г) корою наднирників
ПЕРЕТРАВЛЕННЯ І ОБМІН БІЛКІВ
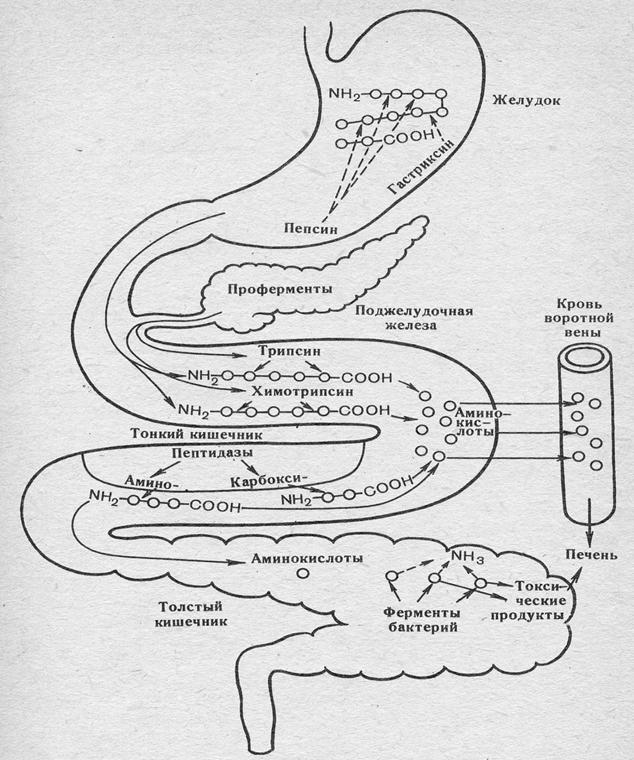
Рисунок 1 − Перетравлення та всмоктування білків їжі
у шлунково-кишковому тракті
Таблиця 1 − Протеолітичні ферменти шлунково-кишкового тракту
| Профермент | Місце синтезу | Місце активації та активатор | Розщеплюючі пептидні зв’язки |
| 1 | 2 | 3 | 4 |
| Пепсиноген | Слизова шлунку | Порожнина шлунка. Відщеплення N-кінцевого пептиду (42 амінокислоти) від пепсиногену під впливом HCl і самого пепсину (аутокаталіз). | -x-Тир- -x-Фен- |
| Трипсиноген | Підшлун-кова залоза | Порожнина тонкого кишківника. Відщеплення N-кінцевого гексапептида від трипсиногена за участю ентеропептідази, що виділяється клітинами кишківника, з подальшим аутокаталізом під впливом самого трипсину. | -Арг-x- -Лиз-x- |
| Хімо-трипсиноген | Підшлун-кова залоза | Порожнина тонкого кишківника. Під впливом трипсину. | -Тир-x- -Фен-x- -Три-x- |
Таблиця 2 – Протеолітичні ферменти шлунково-кишкового тракту
| Джерело | Фермент | Примітка |
| Шлунковий сік | Пепсин Ренін Гастріксін | Протеіназа (знайдений також в шлунковому соку птахів, рептилій і риб) Викликає згортання молока Пепсиноподібний фермент |
| Панкреатичний сік | Трипсин Хімотрипсин Колагеназа Карбоксипептидаза Еластаза | Протеіназа − //− − //− Пептидаза − //− |
| Кишковий сік | Амінопептидаза Лейцинамінопептидаза Аланінамінопептидаза Ентеропептидази Трипептидази Дипептидази Проліл-дипептидаза Пролін-дипептидаза | − //− − //− − //− Глікопротеїн Пептидази − //− − //− − //− |
Гідроліз ліпідів відбувається під дією:
а) амілази
б) пепсину
в) трипсину
г) ліпази
ПЕРЕТРАВЛЕННЯ І ОБМІН ЛІПІДІВ
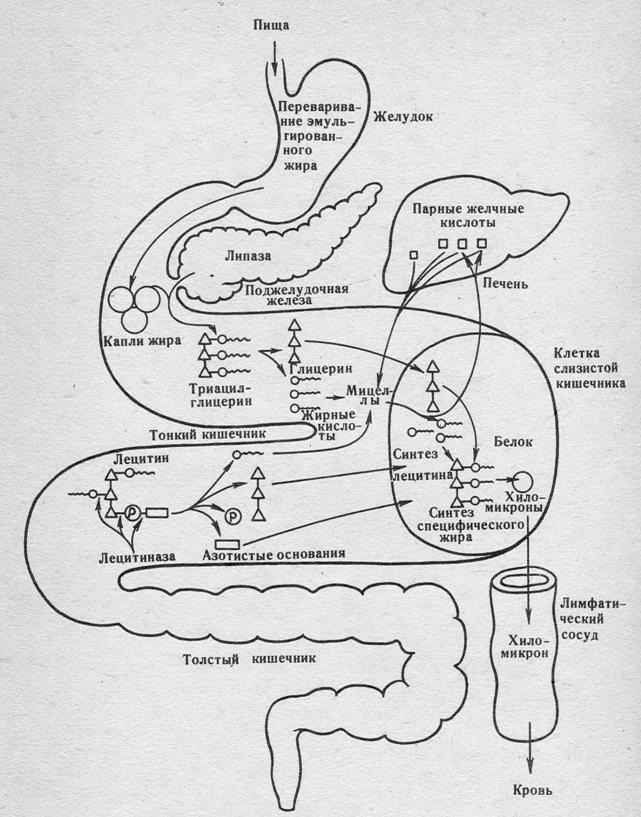
Рисунок 1 − Переварювання і всмоктування жирів (ліпідів)
у шлунково-кишковому тракті
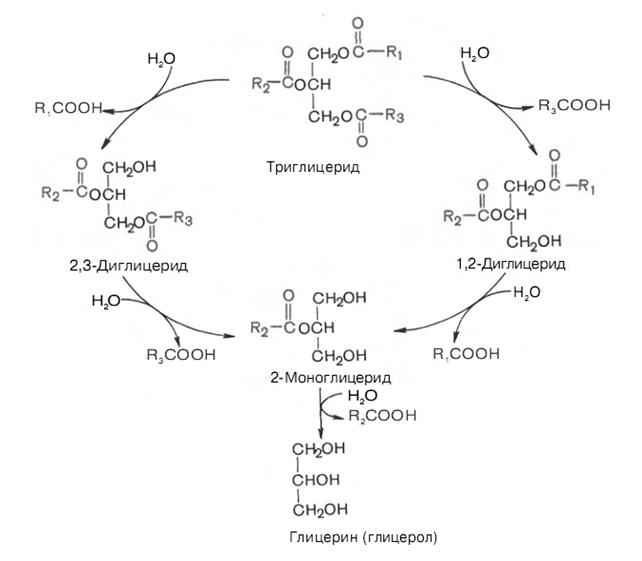
Рисунок 2 − Гідроліз триацилгцеролів (триацилгліцеридів)
за участю панкреатичної ліпази (схема)
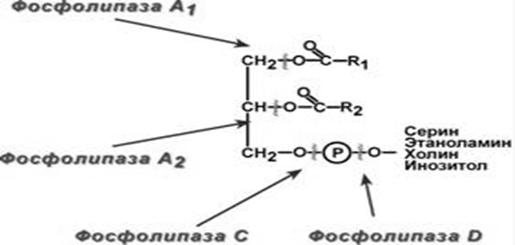
Рисунок 3 − Специфічність дії фосфоліпази А1, А2, С, D
Кінцевим продуктом β-окиснення вищих жирних кислот з парним числом карбону є:
а) стеарил-КоА
б) пропіоніл-КоА
в) пальмітил-КоА
г) ацетил-КоА

Рисунок 5 − Послідовність реакцій β-окислення жирних кислот
(загальна схема)
Який катіон викликає накопичення води в клітинах і тканинах:
а) К+
б) Са2+
в) Na+
г) Mg2+
Na знаходиться в міжклітинному просторі у вигляді іонів.
Роль елементу: іони натрію разом з іонами хлору забезпечують підтримку сталості осмотичного тиску та обміну фізіологічних рідин організму та затримку води організмом. Вміст цього хімічного елементу складає 0,15%.
Нестача Naвизиває порушення багатьох процесів, втрату апетиту, апатію, тахікардію.
Надлишок Na викликає порушення в серцево-судинній системі, порушення функцій нирок, підвищення тиску, набряки.
Вміст цього елементу регулюється гормонами наднирників і мінералокортикоїдами.
В тілі людини налічується:
а) більше 600 м’язів
б) більше 500 м’язів
в) більше 300 м’язів
г) більше 400 м’язів
Міозинові протофібрили мають головку. В основі головки міозину знаходиться фермент АТФаза, а на самій головці знаходяться легкі ланцюги
і молекули АТФ.
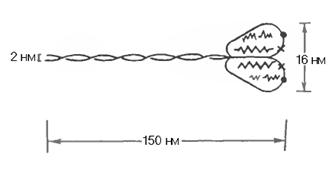
Молекула міозину
Актинові протофібрилимають активні центри (відстань між актином та міозином близько 40 нм).
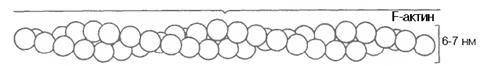
Молекула актину
Крім актину в клітиних протофібрилах є інші білки тропоміозін, тропонін, кальвомодулін (тропоніновий комплекс).
Багатокомпонентна система, до складу якої входять білки, фосфоліпіди, залишки клітиних мембран та іони кальцію – це:
а) система комплемента
б) система утворення тромбоциту
в) гомеостаз
г) система згортання крові
Фактори згортання крові
Фактор І–фібриноген – це білок, який утворюється в печінці, під впливом тромбіну переходить в фібрин. Приймає участь в агрегації тромбоцитів, необхідних для репарації тканин.
Фактор ІІ –протромбін – глікопротеїд, утворюється в печінці в присутності вітаміну К. Під впливом протромбінази переходить в тромбін.
Фактор ІІІ–тромбопластин – складається з білка апопротеїну та комплексу фосфоліпідів. Входить до складу мембран багатьох тканин. Є матрицею для розгортання реакцій, які направлені на утворення протромбінази по зовнішньому механізму.
Фактор ІV–іон Са2+ − приймає участь в утворенні комплексів, які входять до складу протромбінази, сприяє агрегації тромбоцитів. Цей фактор зв’язує гепарин, приймає участь в утворенні згустку і тромбоцитарної пробки, приймає участь в припиненні фібринолізу.
Фактор V–глобулін – утворюється в печінці, сприяє оптимальним умовам для взаємодії фактора Ха і фактору ІІ.
Фактор VІІ–проконвертин – глюкопротеїд, синтезується в печінці під впливом вітаміну К, активується факторами ХІІа, Ха, ІХа, також взаємодіє з тромбопластином.
Фактор VІІІ–антигемофільний глобулін – глюкопротеїд, синтезується в печінці та селезінці, лейкоцитах. Утворює комплекс молекули з фактором Віллебранда (FW) і специфічним антигеном, активується тромбіном.
Фактор ІХ–Крістмас фактор – антигемофільний фактор В, глюкопротеїд, синтезується в печінці під впливом вітаміну К, активується факторами ХІа, VІІа, ІІа, переводить фактор Х в Ха.
При його відсутності виникає захворювання гемофілія В.
Фактор Х–Стюарт-Прауер фактор – природа як і в попередніх факторів. Фактор Ха є протромбіназою, активується факторами ХІІа та ІХа. Переводить фактор ІІ в фактор ІІа.
Фактор ХІ–плазменний попередник тромбопластину– глюкопротеїд, синтезується в печінці, активується фактором ХІІа (калікреїн) разом з кіміногеном.
Фактор ХІІ–Хагемана фактор – білок, який утворюється ендотеліальними клітинами, лейкоцитами, макрофагами, активується адреналіном, калікреїном (ХІІа). Цей фактор запускає зовнішній та внутрішній механізми утворення протромбінази і фібрінолізу. Активує фактор ХІ і преколікреїн.
Фактор ХІІІ–фібриназа – глобулін, активується фібробластами і мегакаріоцитами. Стабілізує фібрин, необхідний для нормального протікання репаративних процесів.
Механізм згортання крові
Механізм згортання крові – проферментно-ферментний каскад, в якому проферменти переходять в активний стан, набувають здатності активувати інші фактори згортання крові (рис. 1, 2).
Дата добавления: 2018-04-05; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
