ФОСФАТ ШИКІЗАТТАРЫНА ТАЛДАУ ЖАСАУ
Nbsp;
Ф. 7.03- 03
ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Oңтүстік Қазақстан мемлекеттік университеті
«Бейорганикалық заттардың химиялық технологиясы» кафедрасы
«Бейорганикалық заттардың химиясы мен технологиясы»
пәні бойынша зертханалық жұмыстар орындауға арналған
ЛАБОРАТОРИЯЛЫҚ ПРАКТИКУМ
5В072000 -«Бейорганикалық заттардың химиялық технологиясы »
мамандығының студенттеріне арналған
Оқу түрі : күндізгі және сыртқы
Шымкент-2015 ж.
 |
УДК 622.346.1
Құрастырғандар:аға оқытушы Жұлдызбаева С.Е., т.ғ.д.,профессор Бестереков Ү.Б., доценттер Тлеуова С.Т., А.А.Кадирбаева
5В072000 мамандығы бойынша оқитын студенттерге арналған «Бейорганикалық заттардың химиясы мен технологиясы» пәні бойынша зертханалық жұмыстарға арналған лабораториялық практикум. Шымкент қаласы. М.Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университеті, 2015 ж, 84 бет.
Лабораториялық практикум 5В072000 -БЗХТ мамандығының мемлекеттік стандарты,оқу жоспары және мамандық бағдарламасы бойынша құрастырылған және барлық зертханалық жұмыстарды орындауға қажетті мәліметтер енгізілген.
|
|
|
Рецензенттер:
Қыстаубаев Е.И. АӘИУ доценті, т.ғ.к.
Ақылов Т.Қ. Химия кафедрасының доценті, х.ғ.к.
БЗХТ кафедрасының мәжілісінде (хаттама № 6 14.01.2015.) және «Химиялық инженерия және биотехнология» жоғары мектебінің оқытудың инновациялық технологиясы және әдістемелік қамтамасыз ету комитетінде (хаттама № 6 15.01.15 ж.) қаралып, баспаға ұсынылған.
Әдістемелік нұсқау М. Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университетінің ОӘБ Кеңесімен бекітілген (№___ хаттама “____” ________ 2015 ж.).
© М. Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университеті, 2015
Баспаға жауапты Жұлдызбаева С.Е.
МАЗМҰНЫ Беті.
Кіріспе................................................................................................................5
Зертханалық жұмыс №1
Күкіртқышқылды әдіспен тұз қышқылын алу..............................................
Зертханалық жұмыс №2
Cульфид шикізатын күйдіру процесін оқып үйрену....................................
|
|
|
Зертханалық жұмыс № 3
Техникалық күкірт қышқылын алу.................................................................
Зертханалық жұмыс № 4
Экстракциялық фосфор қышқылын алу..................................................
Зертханалық жұмыс №5
Химиялық әдіспен күйдіргіш натр алу...................................................
Зертханалық жұмыс №6
Қақталған соданы аммиак әдісімен алынуы............................................
Зертханалық жұмыс № 7
Натрий үшфосфатын алу....................................................... ..........................
Зертханалық жұмыс № 8
Фосфат шикізатына талдау...............................................................................
Зертханалық жұмыс № 9
Жай суперфосфатты алу...................................................................................
Зертханалық жұмыс № 10
Қос суперфосфатты алу...................................................................................
Зертханалық жұмыс № 11
Препицитатты алу............................................................................................
Зертханалық жұмыс № 12
Аммофосты алу және сапасын тексеру
Зертханалық жұмыс № 13
Аммиак селитрасын алу...................................................................................
Техника қауіпсіздігі
Әдебиеттер
Кіріспе
«Бейорганикалық заттардың химиясы мен технологиясы» пәні 5В072000 – Бейорганикалық заттардың химиялық технологиясы мамандығының оқу жоспарына сәйкес күндізгі және сырттай оқу бөлімдері студенттеріне оқытылады.
|
|
|
«Бейорганикалық заттардың химиясы мен технологиясы» пәні негізгі мамандандыру пәндерінің бірі болып саналады және оқулық сабақтарды лекциялар мен лабораториялық жұмыстар түрінде өткізуді қарастырады.
«Бейорганикалық заттардың химиясы мен технологиясы» пәнінен зертханалық жұмыстарға әдістемелік нұсқаулар пән бағдарламасына сәйкес және ол студенттерді бейорганикалық қышқылдар мен негіздерді алуға және технологиялық талаптардың режимдері туралы сұрақтары бойынша іс-тәжірибелікке дайындауға арналған.
Әдістемелік нұсқаулардың құрамында фосфор, күкірт, азот қышқылдарын, минералды тыңайтқыштар алуға мүмкіндік беретін зертханалық іс-тәжірибеліктер келтірілген.
Бұл әдістемелік нұсқауда 6 зертханалық жұмыс келтірілген. Әрбір зертханалық жұмыс жұмыс мақсатынан, тапсырмадан, техникалық құрылғылар мен қондырғылардан, үрдістің жүргізу әдісі мен талдау әдістерінен, үрдістің технологиялық көрсеткіштерінен және бақылау сұрақтарынан тұрады.
|
|
|
Зертханалық жұмыстарды жасау барысында студент өздігінен әртүрлі химиялық және физика-химиялық әдістерді пайдаланып жұмысты орындайды.
«Бейорганикалық заттардың химиясы мен технологиясы» курсы келешек маманға бейорганикалық заттардың түпнегізін және бағалылығын, сондай-ақ өндірістерде және ғылыми-ізденушілік жұмыста кездесетін алу тәсілдері мен талдау әдістерін терең түсінуге көмектеседі.
«Бейорганикалық заттардың химиясы мен технологиясы» пәні аудиториялық және сырттай аудиториялық түрде оқытылады. Аудиториялық оқыту дәрістерде, зертханалық сабақтарда өтіледі. Өзіндік жұмыс дәрістік материалдарды сырттай аудиториялық оқуды қарастырады.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №1
КҮКІРТҚЫШҚЫЛДЫ ӘДІСПЕН
ТҰЗ ҚЫШҚЫЛЫН АЛУ
Жұмыстың мақсаты мен міндеті: Тұз қышқылын күкірт қышқылдық әдіспен алудың үрдісін үйрену.
Қысқаша теориялық бөлім.
Хлорлы сутегінің суда ерігіштігі өте жоғары және газ қоспаларында НСl-ң ерігіштігі температурамен парциал қысымға өте тәуелді. НСl сумен әрекеттесіп құрамы қайнау температура мен қысымға тәуелді азеотропты қоспа түзеді. 105Па қысымдағы 110ºС температурадағы қайнайтын азеотропты қоспада 20,24 масса пайыз НСl,75,92°С 22,15%, 19,09ºС 24,6%.
Тұз қышқылының тығыздығы 22,01% массалық НСl 1100кг/м3-қа тең, 35,38% массалық НСl 1180кг/м3, 20°С-ғы НСl-ң тұтқырлығы 20% массалық НСl 1360кг/м3; 1,95% массалық НСl 1779 кг/м3. Өнеркәсіпте техникалық, синтетикалық реактивте аса таза абгазды НСl шығарады. Хлорлы органикалық өндірістерде абгаздардан тұз қышқылының келесі маркалары мен сорттарын шығарады:
А маркасы тамақ өнеркәсібі үшін. Б маркасы жоғары және 1-ші сортты абгазды тұз қышқылы тазаланады. 2-ші сорттар тазаланбаған абгазды қышқылдар.
Тұз қышқылының барлық сорттарында техникадан бастап айрықша тазасына дейін НСl-ң, Н2SО4-ң, сонымен қатар темірдің және мышьяктың мазмұнымен анықталады. Абгазды тұз қышқылдарына қойылатын талап А маркасы үшін НСl 35,5%-дан кем емес, темір-0,003% артық емес, мышьяк-0,015% артық емес. Б маркасы үшін жоғары сорты 31,5% кем емес, темір-0,5%, мышьяк-0,05%-дан артық емес. 1 сорт үшін НСl 30% кем емес, темір-0,015, мышьяк-0,1%-дан артық емес. 2 сорт үшін НСl-27,5% кем емес, темір-0,02% артық емес, мышьяк анықталынбайды.
Хлорлы сутек және тұз қышқылы халық шаруашылығында, соның ішінде түрлі салаларда хлор алу үшін құрамдас шикізат ретінде әртүрлі органикалық және бейорганикалық өнімдер алынған кезде реагент ретінде техникалық үрдістің катализаторлары ретінде пайдаланылады.
1.Хлорлы сутектің сульфат әдісімен алынуы. Сульфат әдісі хлорлы сутекті алудың ең көне әдісі (1934). Ол сульфат натрийға немесе калийға сұраныс болған кезде және табиғи сульфаттың болмағанда ғана қолданылады. Сульфат әдісі NaCl шоғырлы күкірт қышқы-лымен әрекеттесумен негізделген:
NaCl + H2SO4 = NaHSO4 + HCl
NaCl + NaHSO4 = Na2SO4 + HCl
немесе 2NaCl + H2SO4 = Na2SO4 + HCl – 40,25 кДж
Реакция эндотермиялық , сондықтан процеске жылу қажет. Температураға тәуелділікке байланысты пайда болған реакцияның салмақ түгелімен сұйық күйде қалуы немесе біртіндеп кристалдана бастауы мүмкін. Яғни қышқыл тұздарға: 2Na2SO4 · 9H2SO4 ; Na2SO4·H2SO4; Na2SO4·2H2SO4;3Na2SO4·H2SO4.
Реакция салмағы жылдам қатаймауы үшін температура өте жоғары болуы керек. Температура 500-550ºС КСl-мен әрекеттескен кезде 700-750ºС температура қажет. Бұл үрдісті механикалық пеште жүргізеді. Ал 50-65%-ға НСl бар хлорлы сутек газы 700-800ºС-тан пештен шығады. Құрамында күкірт қышқылының сульфат шаңы, шикізаттың құрамына байланысты басқа да заттар болуы мүмкін. Бұдан басқа Жапонияда горизонталь пеші ойлап табылады. Бұл пештің ерекшелігі горизонталь цилиндр тәрізді реактор пайдаланылады.
Хлор сутекті алу үшін H2SO4 орнына SO2, O2 қоспасын пайдалануға болады.
Хлорсутектің суда еру процессі – тұз қышқылының жоғары температурада түзілуімен түсіндіріледі.Температура жоғарылауымен қатар, тұз қышқылының буының қысымы да жоғарылайды. Хлорсутек пен судан тұратын будың жалпы қысымы атмосфералық қысымға тең болғанда, қышқыл қайнап, судың қарқынды булануы басталады.Адиабаттық жағдайда судың булануына кеткен жылу шығыны, НС1 еру жылымен орын басады, қышқылдың концентрациясы үздіксіз жоғарылап, қайнаған қышқылдың температурасы алғашқыда 1100С-та 20,24% НС1 (қысымы 101325 н/м2 немесе 760 мм.рт.ст.) жоғарылап, одан соң төмендейді.
Хлорсутекті қайнаған суға жібергенде, алғашқы сәтте абсорберде шыққан газда бу түзіп, қышқылдың концентрациясы жоғарылаған сайын шыққан газда НС1 құрамы жоғарылайды.Сондықтан концентрлі қышқылды алғанда, хлорсутектің аз ғана бөлігі абсорцияланбаған болып ыдыста (абсорберде) қалады. Сондықтан НС1 толық жұтылу үшін, газды кері бағытта сұйықтықты бірнеше абсорберден жіберіп немесе тарелкесі , насадкасы бар кері бағыттағы мұнарадан өткізеді.Бұл жағдайда жүйеден шыққан газ көлемі жүйеден шыққан су буынан тұрады.
Қондырғылар, техникалық құрал жабдықтар:
Хлор сутек алатын және абсорбция жүргізетін қондырғы
Титрлеуге арналған қондырғы
Химиялық ыдыстар
Аналитикалық ыдыстар
Электр плитасы
ҚОНДЫРҒЫНЫҢ СИПАТТАМАСЫ
2- суретте Хлор сутек алатын және абсорбция жүргізетін зертханалық қондырғы көрсетілген. 1 колбаға ас тұзын салып, 2 бөлгіш сүзгі арқылы 92%-тік күкірт қышқылын құяды. Колбаны торға газды жанқыштың үстіне орнатады. Қыздырғанда түзілген хлорсутекті тамшыаулағыш 4 арқылы 5 абсорберге 6 барботер арқылы жіберіді.
Колбаны торға газды жанғыштың үстіне орнатады.Қыздырғанда бөлінетін хлорсутек 4 тамшыаулағыш арқылы 5 абсорберге барботер арқылы беріледі.
Абсорберге алдын-ала суды құйып, 7 термостатқа ағынды сумен абсорбция үрдісін термостаттау үшін орнатады. 8 мұздатқыш абсорбер ауланбаған су буын хлорсутекпен конденсациялауға арналған. 9 стаканда конденсат жиналады. Абсорбцияланбаған хлорсутекті бейтараптандыру үшін 10 конусты колбаға күйдіргіш натрдың ерітіндісі құйылады. Бұл колбаны қондырғышқа 11 резеңке шланг жоғарыдан белгілі бұрыш ретінде орналасып, мұздатқыштан конденсат 9 стаканға 10 колбаға төгілмей құйылу керек. Қондырғы желдеткіш шкафта орналасу керек.
8- сурет. Хлорсутек абсорбциясына және алуына арналған қондырғы сызбасы.
1-колба; 2-сүзгіш; 3-резеңке муфталар; 4-тамшыаулағыш; 5-реактор (абсорбер); 7- сумен суытқыш термостат ; 8-мұздатқыш; 9-стакан; 10- NaOH ерітіндісі бар колба; 11-резеңке шлангі; 12-термометр; 13-кран.
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Тұз қышқылының шоғырын ареометрмен анықау
Цилиндрге қышқылды ареометр және термометрді салғанда, тасып кетпейтін мөлшерде құяды. Қышқылдың температурасын анықтаған соң, цилиндрдің қабырғасына тимейтіндей етіп,ареометрді салады.Менисканың жоғарғы жағынан санау жүргізіледі.
Ареометр қышқылдың тығыздығын көрсетеді.Сол өлшем бойынша кестеден, талданған заттың белгілі температурадағы құрамын анықтайды
НС1 қышқылдық құрамын анықтау
Конустық колбадағы тұз қышқылының құрамын натрий гидроксидінің метилқызыл индикаторы қатысында, қызыл түрден сары түске енгенше немесе метилоранж қатысында , қызғылт сары түске енгенше титрлеуге негізделген.
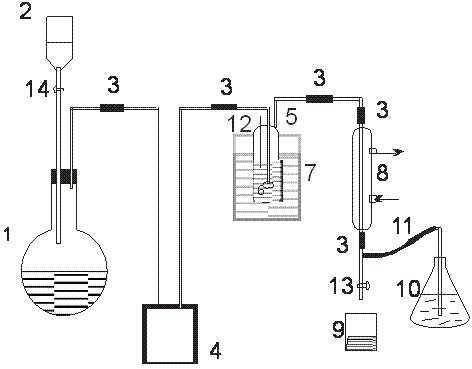
НСI құрамы %-пен мына формула бойынша есептелінеді:
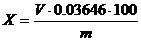 (7.1)
(7.1)
Мұнда V – 1н натрий гидроксидінің титрлеуге кеткен мөлшері, мл;
m – қышқыл сынамасы, г;
0,03646 – 1мл 1н NaOH ерітіндісіне нақты сәйкес НСI массасы, г.
H2SO4 (SO3 санағанда) құрамынын анықтау
Ерітінділер
Ацетон
Буфер ерітіндісі
Аскорбин қышқылы а.т.
BaCI2 – 0,01 н сулы ерітіндісі.
Ортанилді К – индикаторы.
Күкірт қышқылын барий сульфатына өткізіп, тұзды титрлеу немесе нефелометрлік әдіспен талдайды.
Титриметрлік әдіс
Тұз қышқылының сынамасын (30 г) фарфор ыдысқа салып, 20 мл қалғанша буландырады.250 мл колбаға құйып, белгісіне дейін дистиденген су құйып, одан 6 мл ерітіндісін конустық колбаға құяды,оған 5 мл буфер ерітіндісін және ацетон құяды, одан соң аскорбин қышқылын (4-5 мг) салып, индикатормен (ортанилды К) және 0,01н ВаС12 ерітіндісімен күлгін түстен таза көк түске енгенше титрлейді.
H2SO4 құрамы SO3 (%) есептегенде мына формула бойынша есептейді:
H2SO4= 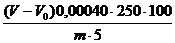
Мұнда V – талданатын сынаманы титрлеуге кеткен 0,01н ВаС12 ерітіндісінің мөлшері, мл;
V0 –0,01н ВаС12 ерітіндісінің бақылау титрлеуге мөлшері, мл;
0,00040 –1 мл 0,01н ВаС12,ерітіндісіне сәйкес SO3 мөлшері ,г;
m - тұз қышқылының сынамасы, г.
Жалпы хлор-ион құрамын анықтау
Қышқылда хлор-ионның құрамын екі әдіспен: аргенометриялық және меркуметриялық әдіспен анықтайды.
Хлор-ионды аргенометриялық әдіспен анықтау
Әдістің мәні. Күміс нитратының артық мөлшерімен хлоридтерді тұндырады. Үш валентті темірді индикатор ретінде, аммоний роданиді ерітіндісімен титрлеп, күміс нитратының артық мөлшерімен хлоридтерді тұндырады.Ерітіндінің қышқыл ортасы фосфаттарды күміс нитраты ерітіндісімен фосфаттарды тұндыруға кедергі жасайды.
Реактивтер.
0.1 немесе 001н аммоний немесе калий роданидінің ерітіндісі
Азот қышқылының (1:9) 6н ерітіндісі
0.1н күміс нитратының ерітіндісі
Теміраммонийлі квасцтар, (ЖАК) ерітіндісі. Теміраммонийлі квасцтартардың суықта қаныққан ерітіндісіне тамшылап ерітіндінің қоңыр түсі өзгергенше азот қышқылын қосады.
Төртхлорлы көміртек.
Калий роданиді мен күміс нитраты ерітнділерінің титрін орнатуАлғашқыда күміс нитраты мен калий нитраты (немесе аммонийдің). ерітінділерінің концентрация қатынасын табады.Бұл үшін конустық колбаға күміс нитратының (0.1н немесе 0.01н) ерітіндісінің 10 мл, 5 мл азот қышқылын және 1 мл темір-аммонийлі квасцтарды құяды Алынған ерітіндіні 0.1н немесе 0.01н роданид ерітіндісімен араласқанда жоқ болып кетпейтіндей ащық қызғылт түс пайда болғанша титрлейді.Концентрация қатынасын(d) 10-ды титрлеуге кеткен роданид ерітіндісінің кеткен милилитр көлеміне бөліп табамыз.Одан соң бюреткамен конустық колбаға10 мл натрий хлориді ерітіндісін (0.1н немесе 0.01н), 5 мл азот қышқылын, бюреткамен анық өлшенген концентрациясы (0.1н немесе 0.01н), мысалы, 10 мл, 1-2 мл ЖАК ерітіндісін құйып және 0.1н немесе 0.01н роданид ерітіндісімен араласқанда 30 мин жоқ болып кетпейтіндей ащық қызғылт түс пайда болғанша титрлейді
К1 түзетудіңкүміс нитраты концентрациясын 0,1 н келтіру (немесе 0.01н)
К1 = а / в – cd (7.4)
К2 түзетуді роданид ерітіндісі концентрациясын 0.1 н. келтіру (немесе 0.01 н.)
K2 = K1d = ad/ в – cd (7.5)
Мұнда а – алынған хлорид ерітіндісінің көлемі, мл.
b – күміс нитраты ерітіндісінің қосылған көлемі, мл.
c - титрлеуге қолданылған роданид ерітіндісінің көлемі, мл
d - AgNO3 және KNCS немесе NH4CNS ерітінділер концентрациясының қатынасы
Талдау әдісі.Сыйымдылығы250 мл конустық колбаға талданатын ерітіндінің аликвотты бөлігін құйып, оған 50 мл дистилденген су, 5 мл азот қышқылы, пипеткамен нақты 10 мл 0,1 н күміс нитратының ерітіндісін, тұнбаны коагуляциялау үшін 2-3 мл төртхлорлы көміртек, теміраммонийлі квасцтар ерітіндісі құйылады.0,1 н күміс нитратының артық мөлшерімен ашық қызыл түске тұрақты 1 мин. жоғалмайтындай болғанша титрлейді.
Сонымен қатар , жоғарыдағы барлық реактивтерді қолданып, бос сынаманы талдайды.
Сонымен бірге жоғарыдағы реактивтерді қосып бос сынаманың талдауын жасайды.
Есеп. Хлоридтердің құрамын % мына формула бойынша есептейді:
Мұнда Vx – бос сынаманы титрлеуге кеткен 0,1 н аммоний роданидінің ерітіндісі, мл;
V – Талданатын сынаманы титрлеуге кеткен аммоний роданидінің ерітіндісі, мл;
К – 0.1 н аммоний роданидінің нормаль коэффициенті;
3.546 – хлор мөлшерінің күміс нитратына 1мл 0,1 н AgNO3 мл/мг анық эквивалентті құрамы;
m – сынаманың массасы г;
а – талданатын ерітіндінің аликвотты бөлігі, мл.
Бақылау сұрақтары
1. Хлорсутектің физика-химиялық қасиеттері.
2. Хлорсутекті алу жолдары.
3. Салқындатусыз абсорбция әдісімен хлорсутекті алу жолдары.
4. Жұмыс істеу әдістемесі.
5. Талдау әдістемелері.
6. Тұз қышқылын алудың күкіртқышқылды әдісінің мәні.
Тапсырма. Тұз қышқылын күкіртқышқылды әдіспен алу.Химиялық талдау жасау. Алынған нәтижелерді өңдеу.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №2
CУЛЬФИД ШИКІЗАТЫН КҮЙДІРУ ПРОЦЕСІН ОҚЫП ҮЙРЕНУ
Жұмыстың мақсаты мен міндеті: Сульфид шикізатын күйдіру процесін үйренумен қатар колчедандағы күкіртті және күкірт тотығы газдарына талдаулар жасауды үйрету.
Қысқаша теориялық бөлім.
Техникада күкіртті газ деп құрамында күкірт қос тотығы бар газды қоспаларды атайды. Күкіртті газдардың құрамдастары: SО2, О2, N2 т.б. Шоғырлы бастапқы шикізаттың құрамы мен оны күйдіру әдістеріне байланысты. Колчеданды күйдіру арқылы күкіртті газды алуға болады. Осы әдіс арқылы көбінше күкірт қышқылын алуда пайдаланады. Колчеданды күйдіру кезінде бірнеше реакциялар түзіледі. Алдымен FeS түзіліп және күкірт буларының бөлінуімен өтетін темір қос сульфидінің термиялық ыдырауы жүреді:
FeS2→2FeS+S2-Q
Күкірттің бөлінуі 500оС-та басталып, температура артқан сайын жылдамдайды. Сонан соң күкірт буы қос тотық түзілуімен жанады.
S(газ) +О2(газ) = SО2(газ) + Q
Мұндай реакция элементті күкіртті жаққанда да жүреді. FeS2 жануы бірнеше жуық үлгісі ұсынылады. Кейбіреулері FeS2 тотығуының бірінші сатысы болып FeSО4, содан соң темір тотығына дейін ыдырайды. Басқа үлгілері бойынша FeS2 тікелей темірге тотығады.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q
3FeS2 + 8O2 = Fe3O4 + 6SO2 + Q
Оттегінің мөлшеріне байланысты 2 реакция жүреді. Fe3О4 түзілуіне қолайлы жағдай болып жоғары температурада газдағы SО2 жоғары мөлшерімен күймеген колчеданнан салыстырмалы көп мөлшері саналады. Колчедандағы түрлі-түсті металдар сульфиді күйдіру жағдайына байланысты (температура, газдағы оттегі мөл-шері т.б.) тотықтар немесе сульфаттар түзіледі. Металл карбонаттарын күйдіргенде көмір қос тотығы бөлінеді және сәйкес металдар тотығы түзіледі. Кейін олар сульфаттарға айналады. Көмірлі колчеданды күйдіргенде күкіртпен бірге ондағы көміртегі келесі реакция бойынша жүреді:
С + О2 = СО2 + Q
Осының салдарынан күйдіру газындағы оттегі мөлшері азайып, катализаторлардағы SО2 тотығу үрдісінің жылдамдығы төмендейді. Колчеданды балқындымен тотықтырғанда 800оС шамасында жоғары шоғырлы SО2 алады:
FeS2 + 16Fe2O3 = 11Fe3O4 + 2SO2 – Q
Колчедандағы металдардың реакциясын былай жазуға болады:
2ZnS + 3O2 = ZnO + 2SO2
Гипсті қыздырғанда алдымен кристаллизациялық су бөлінеді, содан соң:
CaSO4 = CO + SO2 + 1/2O2
Оның толық ыдырауы 1500оС өтеді. Ыдырау температурасын көміртегі қатысуымен төмендетуге болады:
2CaSO4 + C = 2CaO+ 2SO2 + CO2
Күкіртті сутек (H2S) затын жаққанда SO2 су булары түзіледі:
H2S + 3/2O2 = SO2 + H2O
Колчедан жанғанда келесі үрдістер жүреді:
1.FeS2 ыдырауы. 2FeS2→2FeS + S2 – 103,9кДж
2.O2 газды фазадан колчедан түйіршік бетіне жеткізу.
3.S+O2=SO2+362,4кДж күкірттің тотығуы.
4.FeS2, SO2 және Fe2O3 п.б. тотығуы.
5.Тотығу кезінде бөлінетін жылудың колчедан түйіршіктерінен газға өтуі.
6.SO2 газының реакция аймағынан газды фазаға өту.
Колчеданның жану жылдамдығы оның химиялық және минералогиялық құрамына және күйдіру жағдайына (температура, түйіршіктер өлшемі, газ ағымының жылдамдығы) байланысты.
Катализатор қатысуымен күкірт қос тотығын SO3 газына айналдыру жүзеге асырылады:
SO2 + 1/2O2 = SO3
Сумен қосылып күкірт ІV валентті оксиді күкірт қышқылы п.б.
SO3 + H2O = H2SO4
1.Флотацияланған колчеданды күйдіру және күйдірінді газ алу.
2.Пайдалану қазанында газды салқындату.
3.Газды шаңнан тазалау.
4.Газды шаю және кептіру.
5.Газды қыздыру.
6.Катализаторда SO2 – SO3-ке тотықтыру.
7.Күкірт қышқылы п.б. арқылы SO3-ті абсорбциялау.
ХТП1- SO2 газын алу.
ХТП2- SO2 газын SO3 газына айналдыру.
ХТП3-Н2SO4 өнімін алу.
SO3 газын алу платина катализаторын қолдану арқылы жүзеге асырылады. Бұдан басқа ванадийлі катализаторды қолдануға бола-ды. SO3 газын алуда реакция жылдамдығын өзгеру дәрежесін, тепе-теңдік тұрақтысын, реакциядағы температурасын, алынған SO3 өні-мін реакцияның массадан шығарылуы. Катализатор активтілігін және т.б. техникалық параметрлерді анықтап, есептеп, SO3 алу үрдісінің оптималды параметрлер табады. Бұл кезде SO2 газы SO3 затына айналу немесе тотығу дәрежесін мақсатты анықтайды. SO2 газы түйісу әдісі арқылы SO3 газына айналу, қайнау қабаты бар аппараттарда жүзеге асады. Тотығуға дейін газ түрлі тазаланудан өтіп (ылғалды, электрлі тазалау т.б.) 400-420о келіп түседі. Жоғары температурада SO2 газы SO3-ке айналып, өзгеру дәрежесі 0,995-0,997 мәніне дейін жетеді. SO3 сумен абсорбцияланып күкірт қышқылын береді.
SO3 + Н2О →Н2SO4
SO3 және су қатынасының мөлшеріне байланысты әртүрлі шоғырлы күкірт қышқылын алуға болады.
Қондырғылар, техникалық құрал жабдықтар:
Түтікті пеш
Химиялық ыдыстар
Аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Өртелген газының құрамы оның алғашқы шикі заттың құрамына және өртеу әдісіне байланысты болады. Пиритті /колчеданды/ ақырын өртегенде пештегі температура 170 - 260 0С жеткеннен бастап, SО2 газы бөлініп шыға бастайды. Егерде, күкірт колчеданы майда ұнталған болса, оның жану температурасы сонша төмен болады. Колчеданды өртегенде, онда бірнеше реакциялар жүреді. Бастапқы уақытта дисульфид темірі FeS2 ыдырап, сульфат темірі мен күкірт буына айналады.
2 FeS2 → 2 FeS + S2 (1)
Күкірт буы жанып күкірт ll валеннті тотығына айналады
S(газ) + O2(газ) = SO2(газ) + 362,4 кДж (2)
Сульфид темірі де FeS тотығады:
4FeS + 7 O2 = 2Fe2O3 + 4SO2 (3)
Бірақ бұл процестердің байыбы әлі күнге дейін анықталмаған. Колчеданды өртеу процесін төмендегідей қорыту реакциясымен жазуға болады.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3415,7кДж (4)
Немесе
3FeS2 + 8O2 = Fe3O4 + 6SO2 + 2438,1 кДж (5)
Fe3O4 Темір тотығының пайда болуына, пештегі температураның, газдың құрамындағы диоксид күкірттің, өртенбей қалған колчеданның сандарының жоғары болғаны көп әсер етеді. Іс жүзінде колчеданды өртеу процесін 750-8500С температурада болады.
 |
2- сурет- Колчеданды өртеу қондырғысының үлгісі.
1. Түтіктелінген пеш
2. Хромельалюмель термапара
3. Милливольтметр
4. Терморегулятор
5. Реакциялық фарфор түтігі
6. Қайықша
7. Сіңіру шынысы
8. Үш мойынды колба
9. Су екпінімен газ тартатын насос
Колчеданды өртеу қондырғысы температураны10000С – қа дейін көтеруге болатын түтікті электропештен/1/, температураны бақылайтын хромель алюмель термопарасынан /2/, милливольтметрден /3/, берілген температураны ұстап тұратын жылылық реле МКУ-2 /4/, пеш ішіндегі реакция жүретін фарфор түтігінен /5/, оған орналасқан нақты мөлшердегі колчеданды бар қайықшадан /6/ тұрады. Түтіктің бір жағы ауа кіру үшін ашық болады, ал екінші жағы пеште пайда болған газдарды сіңіру ыдыстарынан / 7; 8/ арқылы өткізу үшін , су екпінімен тартатын насоспен /10/ қосылады. Бірінші үш мойынды колбадағы ерітіндіні сіліті ерітіндісімен бюретка /9/ арқылы титрлеу керек , ал екінші шыны /8/ сіңіру процесін бақылауға қойылған. Сіңру колбасына /7/ - 100, склянкаға /8/ - 50 мл, 5...10%- тік метилоранж индикаторымен бейтарапталған пероксид сутегі ерітіндісін құю керек.
Cульфидті күкірттің құрамын анықтау
Колчедандағы күкірттің құрамының іс-жүзіндегі мөлшерін оқытушы береді немесе эксперимент жүзінде анықтайды.
0,2г колчеданды аналитикалық таразыда дәлірек 0,0002г дейін өлшеп, және қайықшаның ұзындығына жұқа қабатпен салады. Пештің ортасына қойып, ауа ағынында 700-800°С температурада 30-60минут күйдіреді.Шыққан газдарды жылдамдықпен 2-3 көпіршікпен сутек пероксиді (10%) ерітіндісімен өткізіп, түзілген H2SО4 0,1M NaОН ерітіндісімен метилоранж қатысында қызғылт түстен сары түске енгенше титрлейді. Сульфидті күкірттің құрамын мына формуламен есептейді:
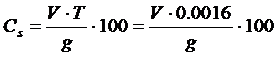 (20)
(20)
Мұнда V – натр сілтісінің титрлеуге кеткен көлемі, мл;
Т - Натр сілтісінің ерітіндісінің күкірт грамымен көрсетілген титры;
g– күкіртті колчеданның навеска массы (огарка), г.
Күйдірудің жылдамдығы мен өртеу дәрежесін анықтау
Күйдіру процесінің жылдамдығын берілген температурада бөлінген газының мөлшерлі санымен г/мин, (г- мол/мин) анықталады. Ол үшін сіңіру ыдысындағы /7/ ерітіндіні тіжирибе жүргізілген уақыт аралығында үздіксіз титрлеп тұру керек / 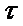 =1,3,5,7,10,15,30 т.с.с.минут/. Берілген уақытта табылған SO2-нің мөлшерін, уақыттың санына бөліп, өртеу процесінің орташа жылдамдығын табамыз.
=1,3,5,7,10,15,30 т.с.с.минут/. Берілген уақытта табылған SO2-нің мөлшерін, уақыттың санына бөліп, өртеу процесінің орташа жылдамдығын табамыз.
3-кесте
| №эксперимент | Колчедан массасы,m1,г | Күкірт құрамы, % | Н 2О2 Мөлшері, мл | Күйдірілген күкірт | Теориялық SO2 мөлшері, гр | Күйдіру дәрежесі,% | Күйдірілген колчеданның қалдығы, m2 , гр | |
| Уақыт, мин. | SO2, гр | |||||||
Өртеу дәрежесін табу үшін белгілі уақытта бөлінген SO2 – нің санын, теориялық SO2 – нің санына қатынасы арқылы табады:


Бұл жерде: g - тәжрибе жүргізу үшін алынған колчеданның массасы, г.
CS(теор) – колчедандағы күкірттің стехиометриялық мөлшері, %.
Титрлеу графигі
| τ | |||||
| SO2 немесе S % |
Күйдіру кинетикасы

Колчеданды күйдіру дәрежесі Массалық үлесі
3-сурет
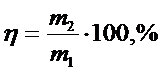
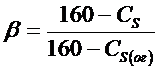
Бақылау сұрақтары
1.Колчеданның өртеу процесінің химизмі.
2.Өртеу дәрежесіне және жылдамдығына әсер ететін факторлар.
3.Өртеу дәрежесіне мен жылдамдығын анықтау.
4.Тәжирибені алып бару және талдау методикалары.
Тапсырма. Берілген температурамен уақытта күйдіру процесін жүргізу. Қышқылдың шоғырын анықтау және қорытындыны өңдеу.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №3
ТЕХНИКАЛЫҚ КҮКІРТ ҚЫШҚЫЛЫН АЛУ
Жұмыстың мақсаты мен міндеті: Техникалық күкірт қышқылының талдау және өнімнің сапасын анықтау.
Қысқаша теориялық бөлім.
Техникалық күкірт қышқылы деп купоросты май мұнаралық қышқылын және нитрлеу процесінде қайтадан регенирациялап алынған қышқылды, сұйытылған азот қышқылын шоғырландыру кезінде алынған қышқылдарды атайды.
Күкірт қышқылының жеке сыртының айырмашылығы ондағы сусыз қышқылдың құрамында (моногидрат), бос күкірт ангидридінде (өлшемде), азоттың тотығында (N2O3-ге есептеу), ерімейтін қоспаларда, темір мен нитроқосылыстарында (регенерацияланған қышқылда).
Өндірістік жағдайда олеум, моногидрат, кептірілген және жуылған қышқылдар концентрацияларын бақылау үшін кондуктометрлік принципте жұмыс істейтін (электроөткізгіштігіне байланысты) автоматты концентратомер КСО 3 типі қолданылады. Приборлардың өзіне сай шегі болады : 15-25% SO3 бос; 93-97% H2SO4; 95-99% H2SO4; 70-75% H2SO4.
Суперфосфат өндірісінде сұйытылған қүкірт қышқылының концентрациясы («спиропки») автоматтық тығыздық өлшеуішімен (ПМ) байқалады.
Кейбір жағдайда H2SO4 құрамын анықтамалықтарда берілгендер бойынша сұйық қышқылдар концентрациясының тығыздығына байланысты анықтайды.
Егер тығыздық 20°С – та өлшенсе, онда 20°С – та келтірілген таблицалық берілгендерде температураға өзгеріс енгізу керек.
Бұл үшін таблицадағы келтірілген қышқылдың тығыздық мәндері оның концентрациясына байланысты тек таза химияалық қышқылға ғана жанасады. Бірмәнді тығыздықтар мен концентрациялар құрамы 94,6-ке дейінгі H2SO4 сұйықтары үшін байқалады.
Ал одан жоғары шоғырланған сұйықтар үшін бірмәнді тығыздықтар мен концентрациялар өзгереді. Мысалыға 1,8 г/см³ тығыздық 95,6 және 98,72% концентрацияға сай.
Сондықтан H2SO4 құрамын сілтілік ерітіндімен титрлеу арқылы анықтайды. Дегенмен техникалық күкірт қышқылы сортында кездесетін бос қышқылдар да титрленеді. SO4² барий сульфатын тұнбаға түсіру әдісін пайдаланса, онда басқа бос қышқылдардың әсері болмайды. Бірақта, бұл әдіспен анықтау ұзағырақ созылады да, және қышқылдың барлық SO4² ион (бос және байланыстағы) тұнбаға түседі.
Қондырғылар, техникалық құрал жабдықтар:
Түтікті пеш
Химиялық ыдыстар
Аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
0,5 – 1 г колчеданды 0,001 г дәлдікке өлшеп қайықшаға алып, берілген температурадағы пешке орналастырады. Сонан соң газ тартатын су екпінді насосты /10/ жұмысқа қосу керек . Сонан соң өртеу процесін белгілі уақыт аралығында алып бару керек.
Пайда болған SO2 газы пероксид сутегі ерітіндісі бар колбадан өткенде, ол күкірт қышқылына айналады:
SO2 + H2O2 ↔ H2SO4 (6)
алынған күкірт қышықылын 0,1 ; 0,2 немесе 1М ерітіндісімен метилоранж индикаторымен титрлеу керек . Титрлеуді ерітіндінің реңі қызғылт түрінен сары түрге айналғанда қояды.
Берілген уақыт ішінде колчеданды күйдіргенде пайда болған SO2- нің мөлшерін мына формуламен анықтайды:
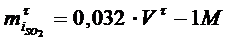
NaOH ерітіндісімен титрлегенде 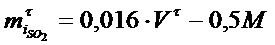
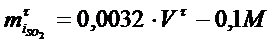
Бұл жерде V τ - берілген уақытта колчеданды күйдіруден пайда болған Н2SO4 қышқылын NaOH ерітіндісімен титрлегенде кеткен көлемі, мл.
Колчедан толық жанғанда пайда болған SO2:
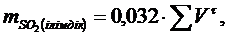 грамм.
грамм.
Күкірт қышқылының сапасын талдау
Аниондардың классификациясы бойыншабарий Ва2+ иондарымен SО42- сульфат-ионы суда ерімейтін тұздар түзетін 1 топқа жатады, Топтық реагент ретінде 2н ВаСl2 ерітіндісі жатады..
1. Сульфат иондарын анықтайтын реакциялар. Сульфат ерітіндісіне 2-3 тамшы НС1 қышқылдық реакцияға дейін және 2-3 тамшы ВаС12 ерітіндісін тамызамыз. Сонда ақ түсті тұнба түзіледі
.
SО42-+ВаС12=ВаSО4↓+2С1- (23)
Түзілген барий сульфатының тұнбасы минералды қышқылдарда(НС1, HNO3, HF және т.б.). ерімейді.
Күкірт қышқылының құрамын анықтау.
5г жуық қышқылды бюкста дәлірек 0,0002г дейін өлшеп және оны сыйымдылығы 250 мл алдын-ала 150мл су құйылған колбаға құю керек. Ерітіндіні 20°С-қа дейін суытып ерітінді көлемін колбаның белгіленген өлшеміне дейін сумен толықтырып, жақсылап араластыру керек.
Колбадан пипеткамен 50мл ерітіндіні алып, 250мл колбаға құйып, метилді қызғылт индикаторының қатысуымен 0,5н NaOH ерітіндісімен қызғылт түстің сары түске ауысуына дейін титрлеу керек.
Моногидраттың құрамы Х (%) мына формула бойынша табады:
V ·0,02452·250
X=---------------------- · 100
g·50
мұнда V-0.5н NaOH ертіндісінің титрлеуге кеткен өлшемі,мл
g- қышқылдың алынған массасы, г.
0,02452-H2SO4 салмағы, NaOH эквиваленттік масса 0,5н NaOH ерітіндідегі құрамы.
Күкірт ангидрінің жалпы құрамыSO3(%)мына формула бойынша табады:
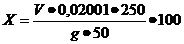 (25)
(25)
мұнда V-0.5н NaOH ертіндісінің титрлеуге кеткен өлшемі,мл
g- қышқылдың алынған массасы, г.
0,02001 –SO3 салмағы, NaOH эквиваленттік масса 0,5н NaOH ерітіндідегі құрамы
Тапсырма. Берілген температурамен уақытта күйдіру процесін жүргізу. Қышқылдың шоғырын анықтау және қорытындыны өңдеу.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №4
ЭКСТРАКЦИЯЛЫҚ ФОСФОР ҚЫШҚЫЛЫН АЛУ
Жұмыстың мақсаты мен міндеті:Экстракциялық фосфор қышқылын табиғатты фосфаттарын күкiрт қышқылымен ыдырату жолымен алынуына машықтандыру.
Қысқаша теориялық бөлім.
ЭФҚ апатитты немесе фосфоритты күкiрт қышқылымен ыдырату жолымен алынады. Алынған шикiзаттың құрамына байланысты алынған ЭФҚ бiрнеше қоспалардан тұрады. Негiзгi қоспаларда магний, кальций, алюминий, темiр, фтор, күкiрт қышқылы сияқты қосылыстар жатады. Фосфат шикiзатын ыдыратқанда жүретiн негiзгi реакция:
Ca5F(PO4)3+5H2SO4+5nH2O=5CaSO4nH2O+3H3PO4+HF
Табиғаттағы фосфаттың құрамындағы қоспалар да күкiрт қышқылымен әрекеттеседi. Ыдыратқанда пайда болатын сульфат кальцийдiң формасына байланысты. Дигидрат режимiмен /65-800С/ алынған ЭФК-ның шоғыры 18-32% Р2О5: жарты гидрат режимiмен /85-950С/ 45-48% Р2О5, ангидрит режимiмен /105 0С/ 48% Р2О5 жоғары болады.
ЭФҚ-ны өндiргенде тұнбаға түсетiн CaSO4- тың кристалдарының мөлшерi үлкен болса, ЭФҚ – ны сүзу процесi анағұрлым жеңiлденедi. Iс жүзiнде CaSO4 кристалдàнған мөлшерлерi үлкен болу үшiн, экстракцияны белгiлi сұйық пен қатты күйлерiнiң массалық қатынасында алады . Мысалы ол қатынастар 2:1 ден 3:1 ге дейiнгi аралықта ұстайды. Осы қатынасты экстракция процесiнде ұстау үшiн, экстракторда 14-16% Р2О5 бар фосфор қышқылын қосады. Оны сұйылту ерiтiндiсі деп атайды, Демек, iс жүзiнде экстракция процесiн күкiрт пен фосфор қышқылдарының қоспасымен жүргiзiледi деуге болады.
Табиғи фосфатты ыдырату фосфор және күкірт қышқылы қоспаларымен жүргізіледі. Фосфор қышқылының пульпасын оңай араластыру үшін сұйылту ерітіндісін көп мөлшерде қосады (сұйықтық қатты қатынасы 2:1...3:1). Сондықтан алғашқы кезде фосфат фосфор қышқылында ыдырайды:
Ca5F(PO4)3+(7+m)HЗРO4=5Ca(Н2РО4)2+mH3PO4+HF (31)
Пайда болған Ca (H2PO4)2 концентрациясы75-93% күкірт қышқылымен реакцияға түседі:
Затем образовавшийся Ca(Н2РО4)2 реагирует с серной кислотой концентрации 75-93% в присутствии H3PO4:
Ca(Н2PO4)2+H2SO4+mH3PO4+nH2O=CaSO4nH2O+(m+2)H3PO4
Ca (H2PO4)2+ 2 H2SO4 + nH3PO4 = CaSO4 + (n+2) H3PO4 + 4H2O
Негізгі қорытынды реакция:
СaF(PO4)3+ 5 H2SO4 + m H2O + n H3PO4 = 3 CaSO4 × m H2O +
+ (3 + n) H3PO4 + HF
Температуралық режимге және фосфор қышқылы шоғырына байланысты бұл үш процесс үш режимде жүруі мүмкін:
m=2 – дигидратты; m=0,5 - жарты гидратты; m=0 – ангидриттi режимдер.
Фосфаттар құрамындағы силикаттар (мысалы, нефелин, глауконит, каолин) реакция кезінде ыдырайды да сульфаттар түзейді:
Na2O ·K2O ·Al2O3·2 SiO2 + 5 H2SO4 = Na2SO4 + K2SO4 + Al2(SO4)3 +
+2 SiO2 + 5 H2O
K2O · Al2O3 · 2 SiO2 · 5 H2O + 4 H2SO4 = K2SO4 + Al2(SO4)3 + 2 SiO2 + 6 H2O
Кремний қышқылы фтор сутекпен реакцияға түседі:
6 HF + SiO2 = H2SiF6 + 2 H2O
Температура 70-90 OC
2 H2SiF6 + SiO2 = SiF4 + 2 H2O
жүріп, газда SiF4 бөледі. Салқын және булы газда
3 SiF4 + (n +2) H2O = 2 H2SiF6 + SiO2 · n H2O
реакциясы жүреді. Сондықтан абсорбция кезінде фтор құрамдас тұздар алуға болады. Фосфаттағы карбонаттар. Силикаттар ыдырайды:
Ca Mg (CO3)3 + 2 H2SO4 = CaSO4 + Mg SO4 + 2 H2O + 2 CO2
Mg SiO4 + 2 H2SO4 = 2 Mg SO4 + SiO2 + 2 H2O
Ca SiO4 + 2 H2SO4 = 2 CaSO4 + SiO2 + 2 H2O
Сондықтан күкірт қышқылының шығыны көбейеді. Магний сульфаты жақсы ериді, ол МКФ –пен реакцияға түседі:
Mg SO4 + Ca (H2PO4)2= CaSO4+ Mg (H2PO4)2
Яғни, бос фосфор қышқылының шығымы азаяды. Нефелин, каолин, гематит, гётит, лимонит, т.б. реакциялық қоспада ериді де, Al, Fe фосфаттарына өтеді:
Al2O3 + H2SO4 + Ca (H2PO4)2 = 2 Al PO4 + CaSO4 + 3 H2O
Fe2O3 + H2SO4 + Ca (H2PO4)2 = 2 Fe PO4 + CaSO4 + 3 H2O
Фосфаттар Fe PO4 · 2 H2O, Fe H3 (PO4 )2 · 2,5 H2O, Al PO4·2 H2O,
Al2(H PO4)3·2 H2O түрінде тұнбаға түседі.
Сондықтан Fe, Al көп фосфаттан ЭФК алудың қиындылықтары бар. Экстракция процесiнiң уақыты 4-6 сағат.
Қондырғылар,техникалық құрал жабдықтар:
Термостат
Электр плитасы
Кептіргіш шкаф
Химиялық ыдыстар
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
1.Күкiрт қышқылымен сұйылту ертiндiсiнiң мөлшерiн есептеу. Күкiрт қышқылмен сұйылту ертiндiлерiнiң мөлшерлерiн табу мұғалімнің тапсырмасымен орындалады.
2.Апатитты күкiрт қышқылымен ыдыратқанда, оның шығыны апатиттегi кальций тотығының санына байланысты болады. 100 г апатитты ыдыратқанда кететiн күкiрт қышқылының шығыны:
S= 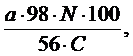 г
г
Бұл жерде: а – фосфат шикiзатындағы СаО – ның саны, %.
С - күкiрт қышқылының шоғыры,% 98 мен 56 – СаО мен Н2SО4
молярлық массалары.
N - күкiрт қышқылының стехиометрлiк мөлшерден артықтығы, %.
Сұйылту ертiндiсiнiң /W/ мөлшерiн төмендегi теңдеумен табамыз.
W = F - (100 + S - G), ã
Бұл жерде: S - 100г фосфаттан шығатын пульпаның өнiмдi шығымы,
G – газдардың /H2O, F, CO2/, бөлiнiп шығатын жалпы массалары,г.
Пульпаның өнiмдi шығымы:
F = 100× Г×( n + 1), г
Бұл жерде : Г – гипс саны немесе құрғақ фосфогипстiң саны.
Апатитте Г = 1,6 ; фосфоритте Г = 1,3 - 1,5.
Пульпадағы берiлген сұйық пен қатты заттардың қатынасы /Ж/Т/.
Есептеуге мысал келтiрейiк.
Ыдырауға 100 г фосфат ұнын алайық. Оның құрамы Р2О5 – 24,5%; F-2%,
СО2 - 6,5 %; MgО - 2,5% ; СаО - 39,8% ;ерiмейтiн қалдық - 14% ; Күкiрт қышқылының шоғыры – 75%; шығын мөлшерi – 105%; тығыздығы 1,669 г/см3. Ж:Тқатынасы 3:1. Ыдырату процесiнде 100г фосфат ұнынан 3г су, 25% фтор және СО2 газының барлық саны газ күйiне айналады.
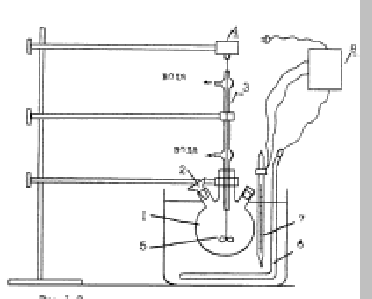
1- сурет-ЭФҚ алуға арналған зертханалық қондырғы.
Гипс саны: GГ = 14+ 39,8 · 172 / 56 · 100 = 133,4 г; Г = 133,4 / 100 = 1,33
Бұл жерде: 56 мен 142 - СаО мен молярлық массасы.
75%-тiк күкiрт қышқылының шығымы:
S = 39,8 · 98 · 1,05 · 100 / 56 ·75 ·1,669 = 58,42 см3 немесе 58,42 · 1,669 = 97,5 г
Пульпаның өнiмдi шығымы: F = 100 · 1,33×( 3 + 1) =532 г
Бөлiнген газдардың массасы: G = 6,5 + 3 + 2 · 0,25 = 10 г.
Сұйылту ертiндiсiң шығыны: W= 532 - ( 100 + 88,44 – 10 ) = 353,56 г.
Фосфор қышқылының алынуы.
ЭФҚ алыну қондырғысы 1- суретте белгiленген. 400-500 мл көлемдегi аралағыш тұрғысы бар реакторды /1/ жұмысқа қосады. Термосттаттағы /4/ температура 70-800С болу үшiн, оны реленi /5/ қыздырғышты /6/ және температураны реттейтiн контакт термометрлердi жұмысқа қосу керек. 70-800С температурасы бар реакторға есептелiнген сұйылту ертiндiсiн, күкiрт қышқылын құяды да аралағыстырғышты жұмысқа қосады. Сонан ақырын берiлген фосфатты қоса бастайды және реакцияның басталған уақытын белгiлейдi. Ыдырыртуды 2-4 сағат аралығында жүргiзу керек. Экстракция тәжiрбиесi бiткен соң, пульпаны Бюхнер үренкесiмен сүзу керек. Сүзу қондырғысын жұмысқа қосып, экстракциялы пульпаны үреңкеге құйып сүзу уақытын белгiлеу керек. Тұнбаның бетiнен кеткен судың уақытын да еске алу керек. Фильтратты өлшеген мензуркаға құйып көлемiн және салмағын өлшейдi. Фильтраттың тығыздығын анықтайды. Үреңкедегi тұнбаны 2-3 рет 60-700С дейiн қыздырылған, дестилденген сумен жуады. Тұнбаны фарфор тарелкасына салып 100-1050С кептiредi. Фильтраттағы Р2О5- ты фосфогипстегi жалпы Р2О5 тен суда ерiгiш Р2О5-тi фотоколориметр әдiсiмен анықтайды.
Талдаудың әдiстемесi.
Фосфогипстегi жалпы Р2О5-тi анықтау
5 г дәлдiкпен өлшенген нақты мөлшерiн 250 мл стаканға салып, оның үстiне 35 мл концентрлiк азот және 15 мл тұз қышқылдарын құйып, стақанды сағат әйнегiмен жауып 30 минут қайнатады. Ерiтiндiнi 250мл көлемi бар колбаға құйып, суытып көлемiн 250 мл дейiн сумен толтырады. Сонан соң оны сүзедi. Аликвотты пипеткамен 2 мл алып, 25 мл г ерiтiндiсiн 20 мл су құйылған 100мл колбаға құяды. Колбаның көлемiн 100 мл дейiн сумен толтырып 15 минуттан соң оның оптикалық тығыздығын ФЭК -те анықтайды. Анықталған оптикалық тығыздық арқылы калибрленген графиктен Р2О5 массасын тауып: оны төмендегi теңдеуге қойып, фосфогипстегi Р2О5 жалпы массалық үлесiн есептеймiз.
Р2О5 = m1 .V1 . 100 / m2 . V2 . 1000 ,%
Бұл жерде: m1 - калибрленген графиктен табылған Р2О5 – тың массасы, мг
m2 - талдауға алынған заттың нақты мөлшерi,г
V1 - колбаның көлемi,см3
V2 - талдауға алынған ерітiндiнiң көлемi,мл /2 см3/
Фосфогипстегi суда ерiмтал Р2О5 анықтау үшiн, 5 - 10г фосфогипстiң нақты мөлшерiн 500см3 колбаға салып, оның үстiне 300 см 3 су құйып 30 минуттай қолмен немесе шайқағыш аппаратта шайқайды.
Лайланған ерітiндiнi сүзiп, аликвоттан 2 мл алып 100см3 колбаға құяды. Колбаға 2 см3 20%-тiк тұз қышқылын 5-10см3 су қосады да 10 минут қайнатады. Сонан соң оны суытады да 30 см3 су, 25 см3 «Г» ерітiндiсiн құяды: көлемiн 100 см3 сумен жеткiзедi. Ерітiндiнiң оптикалық тығыздығы ФЭК –те анықтайды. Одан әрi фосфогипстегi жалпы Р2О5- ты анықтаған жолмен орындайды.
ЭФҚ- дағы Р2О5 тi анықтау
0,0001 г дәлдiкпен 2-5г нақты мөлшерiн 250см3 көлемдегi 15 мл 20% -тiк тұз қышқылы құйылған колбаға салады. Ертiндiнiң көлемiн 250 см3 дейiн сумен толтырады да араластырады, сүзедi. Сүзiлген фильтраттан 1 мл алып 100см3 көлемдегi колбаға салады. Одан 25 мл «Г» ерітiндiсiн құйып одан әрi фосфогипстегi жалпы Р2О5- тi анықтаған талдау арқылы жасайды.
Фильтраттағы фосфор және күкірт қышқылдарын көлемдік жолмен анықтау
Қоспаны NaOH ерітіндісімен алдымен метилоранж индикаторында, кейін фенофталейн индикаторында титрлейді. Сол кезде алдымен күкірт қышқылындағы сутектің екі ионың және фосфор қышқылындағы сутектің бірінші ионы бейтараптанады:
H2SO4 + 2 NaOH → Na2SO4
H3PO4 + NaOH → NaH2PO4
Фенолфталейн қатысуымен титрлегенде фосфор қышқылындағы сутектің титрлегенде фосфор қышқылындағы сутектің екінші ионы және монокальций фосфаттағы сутек ионының біреуі титрленеді.
NaH2PO4 + 2NaOH → Na2HPO4 + H2O
Ca(H2PO4)2 + 2 NaOH → CaHPO4 + Na2HPO4 + 2 H2O
Анализге ерітіндінің 5 см3 250 мл колбаға құяды , оған 2-3 тамшы метилоранж индикаторын қосады да 0.1 Н NаОН ерітіндісімен титрлейді. 0.1 Н NаОН ерітіндісінің шығынын белгілейді (а).
Колбаға 1-2 тамшы фенолфталейн қосады да 0,1 Н NаОН қайтадан қызғылт түске дейін титрлейді. Екінші рет титрлеуге кеткен 0,1 Н NаОН шығынын белгілейді (в).
Егер а > в болса, онда фильтратта күкірт және фосфор қышқылдары бар :
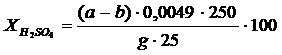
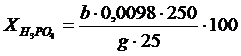
Бұн жерде g - анализден алынған фильтрат массасы, г.
Егерде a < в болса, онда фильтратта фосфор қышқылы және монокальцийфосфат болады:
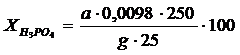

Процесстiң негiзгi технологиялық көрсеткiштерiн есептеу
Сүзу өнiмдiлiгi кг/м2сағ мына теңдеумен табылады.

Бұл жерде: а – фильтраттың немесе тұнбаның массасы,г.
Ғ - үренкенiң бетi, м2.
t - сүзу уақыты /тұнбаның бетiнiң сусызданғаны/, минут.
Р2О5-тың ерітiндiге өту коэффициентi процентпен:
Көту 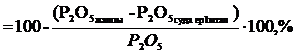
бұл жерде: Р2О5 жалпы, Р2О5 суда ерiгiш және Р2О5 жалпы - суда ерiмтал түрiндегi фосфогипстегi, және фосфаттағы мөлшерi, %
Фосфогипті жуу коэффициентi
Кжуу = 100 - 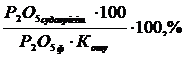
Технологиялық шығу коэффициенті
К шығу= 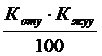 .
.
Жұмыстың нәтижелерiн төмендегi кестелермен бейнелейдi.
1- кесте- Алғашқы берiлген заттар
| Фосфорит немесе апатит | Күкiрт қышқылы | Сұйылту ерітiнд. Алғашқы берiлген заттар | ||||||||
| Шығыны,г | Құрамы,%
| Шығыны,г | Шоғыры, % | Р2О5,% | Шығыны,г | |||||
| Р2О5 | СаО | Є | СО2 | Н2О | Н.О | |||||
2-кесте- Процестiң технологиялық көрсеткiштерi
| Өнiмдердiң массалары,г | Р2О5- тың мөлшерi,% | К өту | Кжуу | К шығу | Q кг/м3 сағ.
| ||||
| Фосфогипс, ыллалды | Фосфогипс құрғақ | Жуу сулары | фосфогипс | Н3РО4 | |||||
| Жалпы | Ерiмтал | ||||||||
Бақылау сұрақтары
1. Фосфор қышқылын алуға қандай шикiзаттар қолданылады.?
2. ЭФҚ өндiрудiң әдiстерi
3. Күкiрт қышқылы мен сұйылту ерітiндiлерiнiң шығынын есептеу
4. Жұмыстың орындалу тәртiбi
5. Негiзгi технологиялық көрсеткiштерге не жатады және оларды қалай табады?
6. Фосфогипс деген не, оның құрамы?
7. Сұйылту ерітiндiсiнiң мөлшерiн табу жолдары
Тапсырма: Қажетті күкірт қышқылының шығынын есептеу. Алынған өнімінің сапасына химиялық талдау жасау. Алынған талдау бойынша техникалық көрсеткіштерді есептеу керек.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №5
ХИМИЯЛЫҚ ӘДІСПЕН КҮЙДІРГІШ НАТР АЛУ
Жұмыстың мақсаты мен міндеті: Зертханалық қондырғыда содалық ерітіндіні әкті сумен каустификациялау үрдісін зерттеу және танысу.
Қысқаша теориялық бөлім
Натрий гидроксиді немесе каустикалық сода (NаОН)-ақ түсті ылғалданған зат. Суда өте жақсы ериді, ол жасанды жібек, сабын, органикалық бояу, қағаз, текстиль және т.б. өндірістерінде көптеп қолданылады. өнім түрінде қатты және сұйық түрінде шығарылады. Қатты түріндегі натрий гидроксиді 2 маркалы: А және Б сәйкесін-ше химиялық және диафрагмалық түрінде шығарылса, сұйық күйінде 5 маркалы: А сынаптық, Б диафрагмалық сапаландырыл-ған, В диафрагмалық, Г және Д химиялық. Каустикалық соданы өндірісте 3 түрлі әдіспен алады. Олар: әкті, ферритті, электрохимиялық.
Әкті әдіс-негізінде мына реакция арқылы алынады:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
Бұл кезде пайда болған натрий гидроксиді тұнбадан бөлініп алып, буландырылады. Бұл үрдіс қайтымды тепе-теңдік шарттары кальций гидрототығы мен карбонатының ерігіштіктің арақатынасымен анықталады. Каустификациялау дәрежесі берілген ерітіндідегі соданы шоғырлануы азайған сайын және температурасы төмендеген сайын көтеріле береді. Алайда іс-жүзінде үрдісті реагенттердің әрекеттесу жылдамдығын арттыру үшін және кальций карбонатының ірі кристалды тұнбасын алу үшін 800-1100оС арасында жүреді. Әдетте натрий карбонатын натрий гидроксидіне айналуы 90-95%-ға жетеді және құрамында 100-120г/дм3 натрий гидроксиді бар сілтілік ерітінді алады
Сода ерітіндісін каустификациялау – каустикалық соданы алудың әктік тәсілін негізгі операциясы. Сода ерітіндісін әкпен немесе әк сутімен өндеу кезінде алмасу реакциясы жүреді де натрий гидрокарбонатының ерітіндісі пайда болады:
Na2CO3 + Ca(OH)2 Û 2NaOH + CaCO3 (1)
Реакцияның тепе-теңдік константасы:
K = 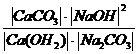 (2)
(2)
Жүйеде қатты заттар бар кезінде Ca(OH)2, CaCO3 концентрациясын бір шамада тұрақты деуге болады, яғни:
K = 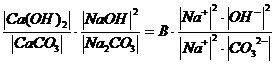
K¢ = 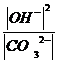 (3)
(3)
[OH-] және [CO32-] мәндерін тұздардың ерігіштік көбейтілерімен алмастыру арқылы тепе-теңдік константасының мәнін табуға болады:
ПР (Ca(OH)2) = [Ca2+]×[OH-]2 (4)
ПР (CaCO3) = [Ca2+]×[CO32-] (5)
Теңдеулерді өзгерту арқылы
K¢ = 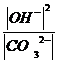 =
= 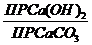 (6)
(6)
Бұл тепе-теңдіктің негізгі көрсеткіштері 1 кестеде келтірілген. Кестедегі сандарға қарағанда сода ерітіндісінің концентрациясы төмен кезінде каустификация дәрежесі өседі.
1-кесте
| Жалпы концентрация (каустификацияға дейін), | Каустификациядан кейінгі концентрация, | K¢ = | Каустификация дәрежесі, А % | |
| OH- | CO32- | |||
| 5,375 5,125 4,900 3,842 3,073 2,045 | 4,34 4,220 4,095 3,444 2,903 1,982 | 0,518 0,408 0,403 0,199 0,085 0,032 | 36,4 39,3 41,7 59,6 99,1 124,9 | 80,7 82,3 83,6 89,6 94,5 96,9 |
Температура көтерілгенде кальций гидроксидінің ерігіштігі азаяды, сондықтан тепе-теңдік константасының мәні төмендейді. Мысалы , СаСО3 гидролизы мен карбонатының ерігіштігі арқылы анықталғанда, 20°С кезінде К¢=2100, ал 90°С кезінде К‘= 90. Сондықтан каустификацияны толық жүргізу үшін температураны 15-20°С ұстауға болар еді. Бірақ, төмен температурада реакция жылдамдығы төмен және пайда болатын кальций карбонаты өте майда болғандықтан оны сүзу қиындыққа әкеледі.
Оңай сүзілетін тұнба алу үшін процессті жоғары температурада жүргізеді.
Практикада каустификацияны Na2CO3 2-3 н. ерітіндісімен (шамада 10-15% масс) 80°С кезінде жүргізеді. Соданың 90%-не дейінгісі NaOH айналады да, құрамында 100-120 г/л NaOH бар ерітінді алады.
Процесс жылдамдығы пайдаланған әк мөлшеріне және қасиетіне, түйіршіктер өлшеміне, әк тасын күйдіру режиміне, материалда қоспалардың болуына байланысты.
Қондырғылар, техникалық құрал жабдықтар:
Содалық ерітіндіні каустификациялау қондырғысы
Титрлеу қондырғысы
Химиялық ыдыстар
Қондырғының сызбанұсқасы
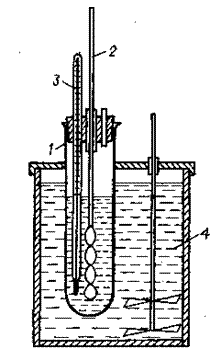
Сурет 2. Содалық ерітіндіні каустификациялау қондырғысы:
1 — каустицер; 2 — винтті араластырғыш; 3 —термометр; 4 — сулы термостат
Содалық ерітіндіні каустификациялау қондырғысы сулы термостат 4 батырылған каустицерден 1 тұрады.Термореттегіш көмегімен термостаттағы температура қойылып, реттеледі. Каустицер ретінде диаметрі 5-6 см, биіктігі 25-30 см.цилиндрге винтті араластырғыш 2 және термометр 3 өткізілген және тығындалған. Араластырғыштың айналу жиілігі 60 айн/ мин. Каустицердің тығынында диаметрі 8-10 мм болатын сұйықтың сынамасын алатын саңылау бар.
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Тәжірибені жасау алдында сода ерітіндісін концентрациясы 5—20% (масс.) аралығында болатындай дайындайды. Ерітінді концентрациясын аналитикалық жолмен бақылайды.
Каустификацияға қажет әктас мөлшерін содалық ерітіндінің мөлшері мен әктастың қасиеттеріне байланысты есептейді.СаО керекті мөлшерін (1) реакцияның стехиометриялық қатынасынан,теориялық мөлшерден 5-10% артық мөлшерде есептелінеді. Табылған СаО мөлшерін аналитикалық жолмен табылған әктастың көлеміне есептейді.
Тәжірибе жасау үшін 1 каустицерге содалық ерітіндінің белгілі мөлшерін құяды. Араластырғышты қосып, термостатты қосады. Каустицерде температура(50—90 °С) болғанда, цилиндрге тығындағы саңылау арқылы аз-аздап әктастың өлшенген мөлшерін 2-3 мин аралықта саламыз.
Әктастың алғашқы мөлшерін салғаннан бастап , уақытты белгілейді. Каустификацияны 1,5—2 сағ., әрбір 15 мин. сайын сұйықтықтың сынамасын талдауға алып, жүргізеді. Сынаманы пипеткамен алып, фильтрге салады, фильтратты NаОН және Nа2СО3 құрамын талдауға жібереді. Тапсырмаға байланысты, каустификацияны әртүрлі температурада содалық ерітіндінің белгілі бір концентрациясында немесе әр түрлі Na2СО3 концентрациясында бір температурада жүргізеді. Тәжірибеден соң, араластырғышты тоқтатып, термостаттан цилиндр-каустицерді алып тастайды. Kаустификацияланған ыстық содалық ерітіндіні сүзіп, белгілі ыстық су көлемімен шайып, құрғақ және химиялық талдау жасайды.
Талдау әдістемелерінің сипаттамасы
Щелоктардың құрамы мен талдау әдістемелер күйдіргіш натр өндірісінің алу әдісіне байланысты болады. Химиялық жолмен алынған NаОН өндірісі щелоктарында, олардың жалпы сілтілігін , яғни карбонатты және каустикалық сілті қоспасын (NaOH + Na2CO3) және күйдіргіш натр құрамын анықтайды.
Жалпы сілтілігін, метилоранж индикаторы қатысында күшті қышқылмен титрлеп анықтайды. Күйдіргіш натр мен натрий карбонатын жеке анықтау үшін екі әдіс: екі индикатормен титрлеу және 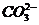 ионын барий хлоридімен тұндыру.
ионын барий хлоридімен тұндыру.
Щелоктың бірдей сынамасын екі индикатормен титрлеу әдісі фенолфталеин және метилоранж индикаторының әртүрлі рН мәнде индикаторлардың түсі өзгеруіне негізделген.
Жалпы сілтілікті анықтау
NaOH+Na2CO3 жалпы сілтілігін талдайтын сұйықтықтың сынамасын тұз қышқылымен метилоранж қатысында титрлеп табады. Талданатын сұйықтықтың 10мл негізгі ерітіндісін (W) пипеткамен сыйымдылығы 250 мл конустық колбаға құяды.Оған 50мл дистилденген суды, 2-3 тамшы метилоранж құйып және 1н HCI ерітіндісімен сары түстен қызғылт түске енгенше титрлейді.
Объем HCI сынаманы титрлеуге кеткен мөлшері, (а, мл), NaOH+Na2CO3
қосындысының жалпы сілтілігіне тең болады.
Күйдіргіш натрдың құрамын анықтау
Құрамында NaOH және Na2CO3 сұйықтыққа BaCI2 ерітіндісін құйғанда, 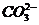 ионы ерімейтін барий карбонаты түрінде түзіледі:
ионы ерімейтін барий карбонаты түрінде түзіледі:
Ва2+ + 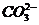 ® BaCO3↓
® BaCO3↓
Фенолфталеин қатысында тұнған сынаманы тұз қышқылымен титрлегенде ОН- ионының құрамын, алғашқы сынамадағы NaOH құрамына эквивалентті ОН- ионының құрамын табуға болады.
Талдау барысы. Талданатын негізгі ерітіндінің 10мл (W) пипеткамен конустық колбаға құйып, 50мл дистилденген суды және (30-40 мл) 10%-ті BaCI2 артық мөлшерін қосамыз. Барий карбонатын тұндырған соң сынамаға 3-4 тамшы фенолфталеин қосып, бірден 1н HCI ерітіндісімен жайлап араластырып титрлейді.
Бұл тирлеуді сақтықпен, ерітінді ашық ауада ұзақ қалдырмай және келесі себептермен көп араластырмайды:
- Құрамында ОН- және Ва2+ иондары бар ерітінді ауадан көміртек диоксидін жұтып, нәтижесінде анықталатын NaOH –тың көлемі азаюы мүмкін;
- ВаСО3 тұнбасы жартылай тұз қышқылымен әрекеттесуі мүмкін, НСI артық шығыны бөлінген көміртек диоксидінің ОН- ионына эквивалентті мөлшерінің бейтараптануымен толтырылады. Сондықтан титрлеу алдында бұл әрекеттесу тиімді емес.
-бірақ, титрлеу соңында көміртек диоксиді ерітіндіден жартылай ұшып, ВаСО3 дың НСI әрекеттесуін толтырмайды.
Сынаманың титрлеуге НСI (b, мл) көлемі, ондағы күйдіргіш натрдың құрамына сәйкес,

Мұнда СNaOH – с NaOH-тың ерітіндідегі құрамы, г/л;
0,04 –1 мл 1н. HCl немесе 0,004г 1 мл 0,1н. НС1 құрамында болатын, NaOH-тың қышқыл массасына эквивалентті массасы
Натрий карбонатының құрамын анықтау
Натрий карбонатының сынамадағы мөлшері, ерітіндінің жалпы сілтілі мен құрамындағы күйдіргіш натрмен есептелінеді, яғни т. е. сынамадағы Na2CO3 a-b мл 1н HCl ерітіндісіндегі құрамы :
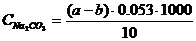 немесе
немесе 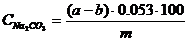
Мұнда С 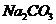
 - Na2CO3 ерітіндідегі құрамы, г/л;
- Na2CO3 ерітіндідегі құрамы, г/л;
0,053 – 1 мл 1н HCl ерітіндісіндегі қышқылдың массасына эквивалентті Na2CO3 массасы.
Ескертулер:
1. Концентрлі сілтілі ерітіндіні талдағанда, талданатын ерітіндіні сұйылту керек.
2. Әлсіз, сұйытылған щелоктарды сынаманы 0,1н HCl ерітіндісімен титрлейді.
Каустификация көрсеткіштерін есептеу
Үрдістің негізгі көрсеткіші ретінде каустификация дәрежесі болып табылады.Содалық ерітіндінің каустификация дәрежесін мына формуламен есептейді:
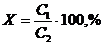 (8.10.)
(8.10.)
Мұнда С1 – NaOH-тың практикалық құрамы, г/л.
С2 –NaOH теориялық құрамы, г/л.
Бақылау сұрақтары
1. Каустикалық соданың химиялық алу
2. Әкті әдіспен каустикалық соданы алудың физика-химиялық негізі.
3. Химиялық әдістің эффектілігінің негізгі көрсеткіштері.
4. Содалық ерітіндінің оптималды концентрациясын негіздеу.
5. Эксперименталдық талдау әдісі негізінде содалық ерітіндінің каустификация үрдісінің оптималды параметрін анықтау
6. Химиялық әдіспен алынған каустикалық соданың электрохимиялық әдістен ерекшілігі.
7. Химиялық әдіспен алынған каустикалық сода үрдісінің кемшілігі.
8. Карбонатты суспензияның сүзу қасиетіне температура қалай әсер етеді?
9. Каустификация үрдісімен содалық ерітіндінің оптималды температурасын негіздеу.
10. Содалық ерітіндінің каустификация дәрежесін жоғарылату әдісі.
Тапсырма. Белгілі концентрациядағы содалық ерітіндіге кеткен әктастың шығымын есепте. Берілген температура мен уақытта каустикалық соданы алу. Химиялық талдау жүргізу. Каустификация үрдісінің көрсеткіштерін есепте.
ЗЕРТХАНАЛЫҚ ЖҰМЫС № 6
ҚАҚТАЛҒАН СОДАНЫ АЛУ
Жұмыстың мақсаты мен міндеті: Қақталған соданы алудың технологиясымен танысып, оның сапасын анықтау
Қысқаша теориялық бөлім
Сода өндiрiсiнде натрий бикарбонат ас тұзы ерiтiндiсiн NH3 және және СО2 газдарымен қанықтыру жолымен алынады. Сода алу процесiнiң қорытынды реакциясы:
NaCl + NH3 + CO2 + H2O = NaHCO3 + NH4Cl
Көмiрқышқыл газы суда нашар еритiндiктен, оны аммиактың қатынысуымен сiңiредi. Iс жүзiнде NaCl ерiтiндiсi алғашында аммиакты сiңiредi аммиагы бар ас тұзы ерiтiндiсi алынады. Сонан соң сол ерiтiндiден СО2 газын жiбередi. Бiрiншi сатыдағы аммиак сiңiру процесiн – абсорбция, екiншi сатыдағы СО2-нi сiңiру – корбонизация процестерi деп аталады. Карбонизация процесiнiң нәтижесiнде тұнбаға түскен NaHCO3 сүзiлiп оны кальцинациялайды (қыздырады). Кальцинация процесiнде жүретiн реакция:
2NaHCO3 160-180 C Na2CO3 + CO2 + H2O
Кальцинацияда бөлiнген СО2 газын карбонизация бөлiмiне қайтарылады. Сүзгенде алынған ерiтiндiдегi аммиакты пайдалану үшiн, оны дистилляция бөлiмiнде әк сүтiмен әрекеттестiрiп ыдырытады.
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2
Бөлiнген аммиак газын абсорбция бөлiмiне жiбередi. СaCl2 ерiтiндiсi, өндiрiстiң қалдығы болып саналады.
Әк сүтiн алу үшiн, керектi оксид кальцийды карбонат шикiзаттарын күйдiру (1000-1200оС) арқылы алады. Күйдiру реакциясы:
CaCO3 → CaO + CO2 – 178 кДж
Бөлiнген СО2 карбонизация бөлiмiне жiберiледi. Алынған оксид кальций сумен сөндiрiлгенде алынған әк сүтiн дистилляция бөлiмiнде қолданады.
CaO + H2O = Ca(OH)2
Сода өндiрiсiнде негiзгi алғашқы заттардың бiрiне NaCl ерiтiндiсін сода өндiрiсiне жiбередi. Демек қақталған сода алу технологиясы өте күрделi болып, ол төмендегiдей бөлiмшелерден (цехтардан) тұрады:
1.NaCl ерiтiндiсiн жер астындағы тас тұзын сумен ерiтiп ажырату жолымен алады.
1. NaCl ерiтiндiсiн тазарту
2. CaCO3 шикiзатын өндiру
3. Карбонат шикiзатын күйдiру (обжиг).
4. NaCl ерiтiндiсiн аммиакпен қанықтыру (аммонизация).
5. Аммиакты ерiтiндiнi СО2 газымен қанықтыру (карбонизация)
6. NaНCО3-тi қақтау (кальцинация).
Қондырғылар, техникалық құрал жабдықтар:
Газ тәрізді көміртегі қос тотығынан қақталған соданы алу қондырғысы
Электр плитасы
Кептіргіш шкаф
Химиялық ыдыстар
Термостат
Муфельді пеш
Техникалық және аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Ерiтiндiдегi Cl ионын анықтау (Мор әдiсi)
Мор әдiсiнiң мәнi бейтараптанған немесе әлсiз ерiтiндiлердi титрлегенде хлоридтар тұнбаға түседi.
NaCl + AgNO3 = AgCl + NaNO3
Егер ертiтiндiге бiрнеше тамшы дихромит калий тамызып, тұнбаға түскен барлық Cl ионнан артық қалған AgNO3 титрлегенде жүретiн реакция:
K2 Cr2O4 + 2Ag NO3 = Ag2 Cr2O4 + 2 KNO3
Пайда болған Ag2Cr2O4 (қызыл күрең) кiрпiш сияқты түрiнде болады.Кiрпiш түрiне айналғаны реакцияның ақырына дейiн барғанын белгiлейдi. Аммиагы жоқ ерiтiндiдегi Cl ионын төмендегi түрде анықтайды.
Талдауға пипеткамен 5 мл ерiтiндiнi алып 100 мл колбаға құямыз да көлемiн 100 мл дейiн сумен толтырамыз. Одан 5 мл алып конусты колбаға салып бiрнеше тамшы K2CrO4 ерiтiндiсiн тамызып, 0,1 AgNO3 ерiтiндiсiмен кiрпiш түрiндегi тұнба түскенше титрлейдi. Егерде AgNO3-тiң орнына 0,1 Hg(NO3)2 алса, ерiтiндiнi аздап 0,2 М азот қышқылымен қышқылдандырады. Индикатор орнына дифенилкарбазидтың 2%-тiк спирттелген ерiтiндiсiн қолданады. Титрлегенде тұнбаға түсетiн HgCl2 ерiтiндiнiң реңiн көк түрiне айналуына әсер етедi.
Тұзының ерiтiндiдегi мөлшерi:
| C NaCl = | V · N · 100 · K | · 58,5 г/л |
| 5,5 |
немесе
| C NaCl = | V · 0,00585 · 100 · 1000 | , г/л |
| 5,5 |
немесе
ХNaCl = CNaCl · 20, н.д.
бұл жерде: V – 0,1N AgNO3 [Hg(NO3)2]ерiтiндiсiнiң титрлегенде кеткен көлемi, см3,
К – түзету коэффициентi.
Бос аммиакты анықтау (тiкелей титр)
Пипеткамен 5 см3 аммиакталған NaCl ерiтiндiсiн алып, 100 см3 көлемдегi колбаға құйып сумен көлемiн 100 см3 жеткiзедi. Онан 25 см3 ерiтiндiнi алып конусты колбаға құйып оның үстiне 1-2 тамшы метилфанус тамызып IN НCl ерiтiндiсiмен сары түрiнен қызғылт түрiне дейiн ауысқанша титрлейдi. Титрмен реакциясы:
NH4OH + HСl = NH4Cl + H2O
NH4HCO3 + HCl = NH4Cl + CO2 + H2O
(NH4)2CO + 2HCl = 2NH4Cl + CO2 + H2O
Бос аммиактың мөлшерi:
|
NH3 бос = | V · K · 100 · 20 |
= B н.д. немесе NH3бос= В * | 17 | , г/л |
| 5 · 25 | 20 |
немесе:
| NH3 бос = | V · 100 · 0,017 · 1000 | , г/л |
| 5 · 25 |
Бұл жерде: V –IN HCl ерiтiндiсiнiң титрлегенде кеткен мөлшерi, см3,
N – HCl ерiтiндiсiнiң нормальдығы;
К – түзету коэффициентi.
Na2CO3 массалық үлесiн анықтау
0,0001 дәлдiкке дейiн өлшенген 2-2,5 г кальцийлендiрiлген соданың шақты мөлшерiн 250 мл конусты колбаға салып, 50 мл суда ерiтедi де 2N күкiрт қышқылымен метилораниж индикаторымен сары түрiнен қызғылт сары түрiне дейiн титрлейдi.
Na2CO3 массалық үлесi (%):
| Х = | V · 0,053 · 100 | ,% |
| m |
Бұл жерде: V – I н күкiрт қышқылының титрлегенде кеткен мөлшерi, мл.
0,0530 – I мл I н күкiрт қышқылына (IN) лайықты Na2CO3 массасы
m - Na2CO3 шақты мөлшерi, г.
Бақылау сұрақтары
1. Кальцийлендiрiлген соданы алу сатыларын айтыңыз.
2. NaCl ерiтiндiсiн аммиактандырғанда температураның процеске тиетiн әсерiн айтыңыз.
3. Ерiтiндiнi не үшiн тазалайды
4. Н.Д. деген не, қалай оны анықтайды
5. Карбонизация процесiне әсер ететiн факторларды айтыңыз.
6. Гидрокарбонатты кальцинациялау процесiн айтыңыз.
7. Аммиактың ерiтiндiдегi түрлерi, олардың айырмашылықтары.
8. Жұмыстың орындалу тәртiбiн түсiндiрiңiз.
9. Талдау жолдарына түсiнiк берiңiз.
10. Өндiрiс көрсеткiштерiн есептеу қолдары.
Тапсырма.Қақталған соданы кальцинация әдісімен алу.Химиялық талдау жасау. Алынған нәтижелерді өңдеу.
ЗЕРТХАНАЛЫҚ ЖҰМЫС №7
ҮШПОЛИФОСФАТ НАТРИЙДІ АЛУ
Жұмыстың мақсаты мен міндеті: Үшкөпфосфат натрий өндірісіне талдау жасау және негізгі компонентерді анықтап өнімнің сапасын оқып үйрену
Қысқаша теориялық бөлім
Үшполифосфат натрий техникалық түздарға жатады. Үшполифосат натрий кiр жуатын, тазартушы және ағартушы заттардың өндiрiстерде қолданады.
Үшполифосфат натрий өндiрiсте алыну жолы бiрнеше сатыдан тұрады.
1. Фосфор қышқылын карбонат натрий тұзымен бейтараптап, моно- және динатрий фосфат тұздарын алады:
2,5Na2CO3+3H3PO4 = NaH2PO4+2Na2HPO4+2,5CO2+2,5H2O
Бейтараптандыру процесі және келесі сатылары ортофосфат ертінділерінің концентрациясына, температурасына, натрий тотығымен фосфор тотығының мольдік қатынасына (металдық титр) және басқа факторларға байланысты болады. Іс жүзінде бейтараптандыру 80-900С аралығында өткізеді. Фосфор қышқылының концентрациясы 42-45%. Бейтарапаттандыру дәрежсеін ұстаумен бақылайды.
2.Алынған ортофосфат натрий тұздарының ерітінділері таза болу үшін оны сүзеді.
3.Фильтрден шыққан ортофосфат натрий тұздарын кептіру аппаратында сусыздандырады. Кептіргенде ертіндідегі гигроскопиялық суды ажыратады. Кептіру аппаратына берілетін газдың температурасын кірісінде 4000С шығысында 130-1400С ұстайды. Кептірілген тұз аппараттан 1200С-та шығады.
4. Сусыз моно- және динатрий фосфат тұздарын қатты қыздыру процесі. Кальцинация процесі қорытынды теңдеу реакциямен:
2Na2HPO4 + NaH2PO4 =Na5P3O10 +2H2O
2,5Na2CO3 + 3H3PO4 = Na5P3O10 +1,5H2O +2,5CO2
жүргізіледі.
. 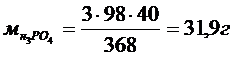
мұндағы: 98 бен 368 - H3PO4 , Na5P3O10
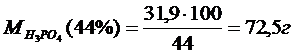
Бұл жерде.1,293-44%-тік H3PO4 тығыздығы г/см3
Na2CO3 шығыны Na2O/Р2О5 мольдік қатынасы 1:7 болғанда:
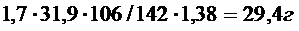
Шын шығыны 29,4/99 ·100=29,7г.
Бұл жерде : 106 мен 142 - Na2CO3 , Р2О5 молярлық массасы
1,38 -H3PO4 –ті Р2О5 айналдырып есептеудегі коэффициент
Үшполифосфат натрийдің ағартуын көбейтуге қосатын NН4NO3 тұзының саны, ерітіндінің массасының 2 %- ты болу керек.
Mерітіндіi = m  + mcîäà - m
+ mcîäà - m 
бұл жерде: mCO2-CO2- -нің массасы, оны /3/ теңдеу арқылы табамыз. 2,5*44*40/368=12 г.
Бұл жерде: 44-СО2 –нің молярлық массасы
Mерітінді =72,5+29,7-12=90,2г.
mNÍ4NO3 =90,2*2/100=1,84г.
Қондырғылар, техникалық құрал жабдықтар:
Пипеткалар
Колбалар
Аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Термостаттағы колбаға 1, есептелінген фосфор қышқылын құйып, оны берілген температураға дейін қыздырады.Термостаттағы колбаға 1,есептелінген фосфор қышқылын құйып, оны берілген температураға дейін қыздырады. Сонан соң берілген температурада аз-аздап үреңке /2/ есептелінген соданы төгеміз.Бейтараптану үрдісін 1-2 сағ. Аралығында жүргізеді. Бейтараптану біткен соң, үшмойынды колбаны термостаттан алып, оған есптелінген мөлшерде NÍ4NO3 ерітіндісін құяды. Ерітіндіні қоспалармен лайланса, оны сүзу керек /көк лента/. Сүзiлген ерітiнiдiні фарфор тарелкасына құйып, шкафта 100-1050С –та сусыздандырады. Сусыздандырылған тұздарды 350-4000С муфель пешiнде 20-30 минут қыздырады. Қыздырылған тұзды суытып өлшейдi. Сонан соң ондағы жалпы Р2О5 оның 1%-тік ерітіндісінің рН көрсеткішін анықтайды. Табылған жалпы Р2О5 саны арқылы Na5Р3О10 есептейдi. Алынған өнiмнiң сапасын стандартты өнiмiнiң сапасымен салыстырады.
2 нұсқа
Осы вариант бойынша берiлген өнiмдi алу үшiн, тиiстi ортофосфат натрий тұздарының мөлшерлерiн есептеу керек. Өндiрiсте алынған ортофосфат натрий тұздарының құрамында кристаллогидратты сулар бар. Мысалы Na2HPO4·12Н2О және NaH2PO4·2Н2О /2/ теңдеу арқылы әрекеттескендердің шығынын табуда Na2HPO4 пен NaH2PO4 мольдiк қатынасын 1: 2 деп алу керек.
Мысалы: Егерде тұздарда 99,8% Na2HPO4·12Н2О және 99% NaH2PO4·2Н2О болса, 100 г үшполифосфат натрий алу үшін тұздардың шығынын табыңыз.
.
NaH2PO4 ·2Н2О шығыны
100·15·100/368·99,8=42,5г.
Бұл жерде:156 мен 368 - NaH2PO4 ·2Н2О мен Na5P3O10 молярлық массасы
99,8 –тұздағы NaH2PO4 саны, %
NaH2PO4 · 12Н2О шығыны
100·368·100·2 /368·99=196,5г.
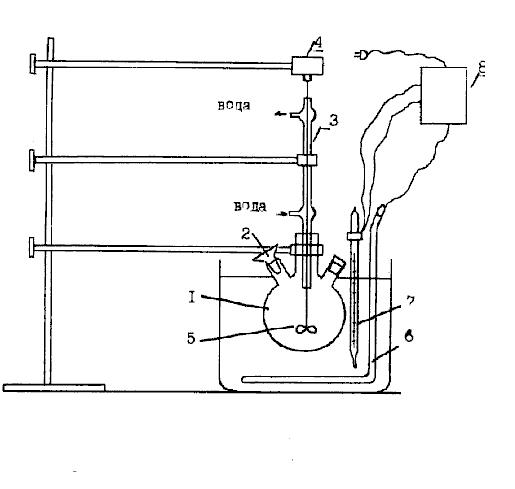
4- сурет-Үшкөпфосфат натрий алу қондырғысы
1-колба; 2-үренке; 3-қайтарымды тоңазытқыш; 4-матор; 5-араластырғыш
Екінші нұсқамен Na5P3O10 алынуы
Алдын-ала өлшенген фарфор тарелкасына есептелінген NaH2PO4·2Н2О және Na2HPO4 ·12Н2О тұздары салып муфель пешінде 340-4000С тампературада 20-30 минут қыздырамыз.. 350-4000 С температурада тұздар арасында төмендегі реакция жүреді:
2 Na2HPO4 = Na4P2O7 + Н2О (10)
NaH2PO4 = NaPO3 + Н2О (11)
Na4P2O7 + NaPO3 = Na5P3O10 (12)
Содан соң оны суытып өлшейді, ондағы жалпы P2O5 және оның
1 %–тік ерітіндісінің рН көрсеткішін анықтайды. Жалпы P2O5 арқылы Na5P3O10 мөлшерін есептеп оның сапасын стандартты сапасымен анықтайды.
Жалпы Р2О5 –ті анықтау
0,0005 г дәлдікке дейін 2,5 г өнімді 400 см3 көлемдегі стаканға салып, үстіне 100 см3 су 5 мл азот қышқылын құяды.Ерітіндіні 10 мин. қайнатады да суытып, сонан соң 2-3 тамшы метилоранж индикаторын тамызып, шыны таяқшамен араластыра отырып, 2М NaОН ерітіндісімен бейтараптандырады. Бейтараптандыруды ерітіндінің қызғылт түстен қызғылт сары түске ауысқанша тоқтатпайды.Сонан соң таяқшаны азғантай сумен шайып, стаканды магнитті араластырғышқа қояды. Шыны электроды бар потенциометрмен бюреткадан 1М NaОН ерітіндісімен титрлеп рН 6,4-ке жеткізеді.Осыдан кейін титрлеуді рН 9-ға жеткенше тоқтатпайды. Жалпы Р2О5-тың мөлшері үлесі, %:
Х Р2О5= V·0,071·100/2,5
Бұл жерде: V-1М NaОН ерітіндісінің рН –тың 4 тен 9-ға дейінгі кеткен көлемі, см3
0,071- 1 мл 1М NaОН ерітіндінің Р2О5 –тың саны, г
Жалпы Р2О5- тің мөлшерлі саны арқылы өнімдегі Na5P3O10 мөлшерін есептейді:
А =1,7277·ХР2О5
Бұл жерде 1,7277- Р2О5 -тi Na5P3O10 –ға айналдырып есептейтін коэффициент, оны мына қатынаспен табамыз.
368/1,5·142
Бұл жерде :368 бен 142– Na5P3O10 мен Р2О5 –тың молярлық массалары..
Жұмыстың нәтижелерін төмендегі кестелер арқылы өңдейді.
5-кесте-Алғашқы есептелінген нәтижелер
| тәжірибе аттары | Тәжірибені өткізуге жағдайлар | ||||
| уақыт, мин | температура, оС | Н3PO4, шоғыры,% | Н3PO4 мөлшерi, г/мл | NН4NO3 | |
6 –кесте Алынған нәтижелер
| Тәжірибе аттары | Тәжірибені өткізу жағдайлар | ||||||
| Уақыт, мин | Температура, 0С | Na5P3O10салмғы,г | P2O4 саны,% | 1%3к ертiндiнiң рН | Тарелканың салмағы г | Na5P3O10мөлшерлi ѕлесi,% | |
Бақылау сұрақтары
1. Үшполифосфат натрийдің өндірудегі сатылары
2. Соданың және фосфор қышқылының шығындары есептеуді түсіндіріңіз
3. Жұмыстың орындалу әдісі
4.Р2О5–ке жүретін талдаудың желісін түсіндіріңіз
5. Өнімдегі Na5P3O10 мөлшерлік үлесін табу жолы
6.Тапсырма.Берілген температура мен уақытта үшполифосфат алу. Соданың және фосфор қышқылының шығындарын есептеу.Химиялық талдау жүргізу.
№ 8 ЗЕРТХАНАЛЫҚ ЖҰМЫС
ФОСФАТ ШИКІЗАТТАРЫНА ТАЛДАУ ЖАСАУ
Жұмыстың мақсаты мен міндеті: Фосфат шикізаттарының негізгі компоненттеріне талдау жасауды үйрену
Қысқаша теориялық бөлім
Фосфорлы тыңайтқыш және жемдік фосфаттарды өндіру үшін негізінен табиғи фосфаттарды және экстракциялық фосфор қышқылын пайдаланады. Тыңайтқыштың физика-химиялық қасиеті және сапасы фосфорит рудасының минералдық, химиялық құрамына көп байланысты. Шикізат ретінде пайдаланатын фосфат рудасының (апатит және фосфорит) негізгі минералы–апатит тобы 3Ca3(PO4)2×CaX2 (X-фтор, хлор, гидроксил тобы). Кальций элементінің орында стронций сирек кездесетін церий тобы және басқа элементтерімен алмасуы мүмкін. Табиғатта көп тараған фторапатит 3Ca3(PO4)2.CaF2, гидроксилапатит 3Ca3(PO4)2.Ca(OH)2. Фосфаттардың құрамында нефелин (Na,K)2O.AI2O3.2SiO2.nSiO2, эгерин NaFeSi2O6, сфен CaTiO5, титаномагнетит FeTiO3.nFe3O4, дала шпаты (Na,K)AISi3O8, т.б. минералдар болады.
Фосфорит рудаларында фторапатиттен басқа фторгидроксилкарбонатапатит Ca10P5CO23(F,OH)3, франколит (штаффелит) Ca10P5,2C0,8O23,2F1,8OH, курскит Ca10P4,8C112O22,8F2(OH)1,2, глауконит (гидратталған силикат -Na,K,Mg,Ca,Fe,AI тотықтары бар), кальцит СаСО3, лимонит Ғе2(ОН)6.Ғе2О3, доломит СаСО3.MgСО3, магний силикат MgSiO4, каолин H2AI2Si2O8×H2O, пирит FeS2, кварц, дала шпаты, гранит, т.б. және органикалық заттар болады.
Фосфорит рудалары майда дәнді (қабатталып орналасқан), желвак (томпақ үйінді түрінде-конкреция), ұлутас (қабық, сыртқы қабық) және қалдық таралған (шашыранды) түрінде кездеседі.
Апатит кен орындары негізінен магмалық (балқыған) пайда болған, ал фосфориттік - тұнбалық.
Қазақстанда фосфорит кендері Қаратау аймағында және Ақтөбе облысында Шилісай массивінде. Қазіргі кезде өндірісте Қаратау фосфориттері пайдаланылуда.
Қондырғылар, техникалық құрал жабдықтар:
Фарфор шашкасы
Электр плитасы
Кептіргіш шкаф
Химиялық ыдыстар
Тигель
Аналиткалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Негізгі ерітінді дайындау және ерімейтін қалдықтардың массалық үлесін анықтау
Негізгі ерітінді дайындау үшін майдаланылған фосфат шикізатынан 0,0002г дәлдікке дейін аналитикалық таразыда 2-5г өлшеп алып 250мл стаканға салады. Оған патша арағынан (1:3 HNO3:HCI) 30мл және 30мл су құйып, бетін сағат әйнегімен жауып қайнағанша қыздырып, 30минут қайнатады. Алынған ерітінідіні 500мл өлшегіш колбаға үреңке «ақ лента» арқылы сүзеді. Стаканда қалған ерімейтін қалдықты жақсылап сүзгі қағазбен орап сүртіп, үреңкеге салады. Сүзгіде қалған ерімейтін қалдықты қайнаған дистилденген сумен бірнеше рет шаяды. Ертіндінің көлемін белгіге дейін дистилденген сумен жеткізеді (негізгі ерітінді).
Үреңкеде қалған ерімейтін қалдықты таразыда өлшенген тигельге салып, сусыздандырады. Содан соң оны 700-8000С температурада 30 -60 минут күйдіреді. Күдірілген тигельді эксикаторда суытып таразыда өлшейді. Алынған мәлімет бойынша ерімейтін қалдықтың массалық үлесін төмендегі теңдеумен анықтайды.
е.қ= (m1- m2)·100/ m, %
мұндағы: m- негізгі ерітінді дайындау үшін алынған фосфат шикізатының массасы,г
(m1-m2)--күйдірілген қалдықтың массасы, г
Дифференциалды фотоколлориметр әдісімен фосфорды анықтау
Әдістің мақсаты. Ортофосфаттарды ванадий және молибден қосылыстарының тұздарымен қосылыс түзеді де сары түс береді. Алынған ертіндіні фотоколориметр немесе спектометрде өлшейді. Светті сіңірудің молярлық коэффициенті e 20 000 (l -315нм) және e 2500 (l-400нм). Бірнеше минуттан кейін 0,5-1,2н азот ертіндісінде максималды интенсивтілік бірнеше тәулікке дейін сақталады. Кремний, аммоний, кальций, барий, марагнец, висмут, молибден және мышьяк фосфордың сапасына ешқандай әсер етпейді.
Реактивтер
Аммоний метаванадат , NH4VO3 кристалы
Аммоний молибдат, (NH4)6 Mo7O24*4H2Oкристалы
Калий фосфатты бір сулы, химиялық таза, кристалы
Калий перменганаты, 0,1н ерітіндісі
Азот қышқылы, қайнатылған шоғырлы және 1:3 сұйытылған.
Молибденвонадатты реактив (Г ертіндісі).
(Г ертіндісі) дайындау тәсілі:
А ертіндісі. 500мл диссилденген суға 334 мл азот қышқылының шоғырлы ерітіндісін құйып сумен 1 литрге жеткізеді.
Б ертіндісі. 50г аммоний 50-600С температурада қыздырылған 500мл
су қосып, суытып, оның сүзгіден өткізіп, 1 л дейін сумен жеткізеді.
В ертіндісі. 2,5г аммоний метаванадатқа 50-600С қызыдырылған 500мл су құйып (егер ванадат ерітіндісі сарыланса, онда ерітіндіге аммиак тамызады), 40мл шоғырлы азот қышқлын қосады . Ерітіндіні сүзеді, суытады көлемін 1л жеткізеді.
Содан соң А ерітіндісіне жәйлап араластыра отырып Б және В ерітініділерін қосып тәулікке қалдырады. Ерітінді тұрақты.
Калий фосфатының стандартты ерітіндісі.
Кептірілген 0,4794г калий фосфатын 1л белгісі бар колбаға салып, суда ерітеді, көлемін белгіге жеткізеді.
Градирленген график тұрғызу. Фосфоритті немесе окатышті талдағанда екі график тұрғызады. 100мл көлемдегі колба бойынша 10,12,14,16,18,20,22,14 мл және 20,22,24,26,28,30,32,34 мл стандартты ерітінді алады. Оларға 60 мл дейін су қйып 25 мл Г ерітіндісін қосады, беліге дейін су мен жеткізеді. Оларды жайлап араластырады. 30 минут өткен соң оптикалық тығыздығын анықтайды. Сонымен қатар стандартты ерітіндіге дәл осындай талдау жасалынады да оған график тұрғызылады.
Градуирленген график те абсица осінде фосфор құрамы, ал ордината осінде оптикалық тығыздық орналастырылады. Есептеуде табылған мәнді стандарт ертіндідегі фосфор мәніне көбейтіп қажетті фосфордың мәнін миллиграм бойынша анықтайды.
Талдау әдісі. Негізгі ертіндіден 1-2 мл алып 100мл белгісі бар колбаға құяды. 3-4 тамшы 2,4-динитрофенол индикатор қосып, содан соң тамшылатып 1:1 аммиак ерітіндісін сары түс пайда болғанша қосады. Алынған ерітіндіні 70 мл дейін су құйып, 25 мл г ерітіндісін қосып сумен белгіге дейін жеткізеді де араластырады. 30 минут өткен соң фотоколориметрде оптикалық тығыздығын анықтайды. Светофильтр 410-440нм болу қажетті.
Алынған фосфордың құрамы төмендегі теңдеумен анықталады.
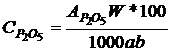
мұндағы, АР2О5- Аликовттың бөлімдегі фосфордың құрамы, мг
W- негізгі ерітіндінің көлемі, мл
a-үлгі массасы,г
b негізгі ерітіндіден алынған аликвот бөлімі, мл
Кальцийді комплексометриялық әдіспен анықтау
Әдістің мақсаты.Кальцийді тікелей комплекометриялық әдіспен сілті ортада титрлеу арқылы анықтайды. Ерітіндіге флоурексон индикаторын және триэтаноламин қатысында талдау жүргізіледі. Жоғары фосфаттардың болуынан ерітіндіде тұнба түзіледі. рН болдырмау үшін ерітіндіге сульфосальцил қышқылын қосады. Титрлеуді барлық ерітінділер қосылған соң тез арада жүргізу қажет.
Реактивтер
20 %-Күйдіргіш калий ерітіндісі
20%Сульфосальцил қышқылы
0,02М трилон Б ерітіндісі. 7,445г трилон Б аз мөлшердегі суда ерітіп сүзеді де көлемін 1л жеткізеді. Немесе фиксоналдан жасайды.
Триэтаноамин (ТЭА) 1:6 сұйытылған ерітінді.
Флоурексон индикаторы азотқышқылды калимен натрий хлоридінің (1:100) қоспасы
Аралас индикатор: 0,1г флоурексон, 0,1г тимолфталексон және 15 г калий хлоридін ступакада езіп дайындайды.
Талдау әдістемесі.
500 мл конусты колбаға негізгі ерітіндіден 25 мл алып 50-100мл су қосады, 5мл триэтаноламин, 15-20мл сульфосалицил қышқылын, 20-25 мл 20% калий гидроксидін қосып шпателмен индикатор флоруксен салып, трилон Б ерітіндісімен тирлейді. Титрлеу қара фон да жүргізіледі. Титрлеуді мұқият араластыра отрып жүргізту қажет.
Есеп.
Кальцийдің құрамын төмендегі теңдеумен есептейді
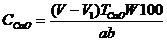
V -0,02М трилон Б ертіндісінің аликвотты бөлімді титрлеуге кеткен көлемі, мл
V1 – 0,02М трилон Б ертіндісінің бос бөлікке кеткен көлемі, мл
T CaO – 0,02М трилон Б ертіндісінің СаО бойынша титрі
a- үлгінің массасы, г
b- негізгі ертіндінің аликвот бөлімі
W-негізгі ерітінді көлемі, мл.
Комплексометриялық әдіспен магнийді анықтау
Әдістің мәні: Кальций мен магнийді қосынды санына тікелей комплексометриялық титрлеу жүргізеді. Титрлеуді аммиакты ерітіндіде рН=10 крезолфталексон немесе тимолфталексон индикаторымен және ТЭА қатысуымен трилон Б өткізеді. Магнийге кеткен трилон Б көлемін VСaО,МgО-VСaО айырмашылығымен анықтайды. Магнийдің көп мөлшері қатысқанда ерітіндінің рН магний аммоний фосфаты түзілуге қалай жағдай болады, ал бұл кезде титрлеуде трилон Б ерімейді.
Тұнбаның түзіліп кетпеуінен сақтану үшін титрлеуді тез жүргізеді. Тұнба түзілетін жағдай болса, онда аликвоттық бөлімді аз немесе өте сұйытылған күйде алу керек.
Реактивтер.
(25% ерітінді) аммиак су және сұйытылған (1:1) рН=10 аммиакты буферлі ерітінді. 54г аммоний хлоридін 350мл 25% аммиак ерітіндісінде ерітіп көлемін 1л сумен жеткізеді.
Кристалды аммоний хлориді.
Кристалды калий нитраты.
Тұз қышқылы (p=1.19г/см3) сұйылтылған 1:1 электролитті магний.
Магний хлоридінің стандарт ерітіндісі.
Сыйымдылығы 1л белгіленген колбаға 0,6032 метал магнийді салады. Сумен ылғалдандырып, тамшылатып тұз қышқылын 1:1 алынған үлгі ерігенше құяды. Ерітінді көлемін белгіге дейін жеткізеді және араластырады. (1мл ерітіндіні 0,01г MgO құрайды)
Тимолфталексон немесе крезолфталексон индикатор қоспаларын құрғақ ступкада калий нитратымен үгітеді. (1:100).
0,02М трилон Б ерітіндісі (кальций анықтауда қарау).
Ерітінді титрін MgO бойынша есептейді, ол үшін стандарт магний тұзының ерітіндісін пайдаланады.
ТЭА (кальц.анық.қарау).
Тропеолин 00,01% сулы ерітінді.
Талдау жүргізу: сыйымдылығы 500мл конусты колбаға 25мл негізгі ерітіндіден алып, 250-300мл су, 5-6 тамшы тропеолин ерітіндісін, 5мл ТЭА 1:1 аммиакты сары түске дейін келтіріп 10-15мл аммиактың буферлі ерітіндісін қосады. Содан соң тез бюреткадан трилон Б ерітіндісін кальцийге кеткеннен төмен қосып, тимолфталексон немесе крезолфталексон индикаторын қосып титрлеуді жүргізеді. Титрлеуді көк түстен сары немесе лас-сарыға дейін жүргізеді. Сонымен бірге бос үлгігі де титрлеу жүргізеді.
Магний құрамын MgO бойынша (%) төмендегі теңдеумен анықтайды
CМgО=[(VСaО, МgО-VxСaО, МgО)-(VСaО-VXСaО)]Tтр/МgО*W*100/ав
Мұндағы: VСаО,МgО-кальций мен магнийдің қосындысына кеткен трилон Б шығыны, мл.
VxСaО,МgО-кальций мен магнийдің бос үлгідегі қосындысына кеткен 0,02М трилон Б ерітіндісінің саны, мл.
VСaО-0,02М трилон Б ерітіндісін кальцийді титрлеуге кеткен шығыны, мл.
VxСaО-0,02М трилон Б ерітіндісінің кальцийді бос үлгідегі титрлеуіне кеткен шығыны, мл.
Ттр/МgО-магний тотығы бойынша 0,02М трилон Б ерітіндісінің титрі.
W-негізгі ерітінді көлемі, мл.
а-үлгі салмағы, г.
в-негізгі ерітінді бойынша алынған аликвот бөлімі.
Параллель алынған үлгінің айырмашылығы 0,2 % аспау керек.
Сульфосалицил қышқылымен темірді колориметриялық әдіспен талдау
Әдістің мәні: үш валентті темір сульфосалицил қышқылымен аммиак ерітіндісінде рН= 8,5-11,5 ішкі комплексті сары түске боялған қосылыс түзеді. Екі валентті темір сілтілік ортада ауадағы оттегімен тотығады және интенсивтілік жалпы темір құрамына пропорционал болады. Түсі көп түрлі және ұзақ уақытқа тұрақты. Максималды сіңіру l=427нм қарастырылады. Түстендірілген қосылыс диссоциациясын тоқтату үшін және оған әсер ететін алюминий, кальций, магний, сульфосалицилді қышқылын артығымен алады. Бұл әдіспен көп мөлшердегі темірді анықтауда қолданылады.
Реактивтер.
25% аммиак суының ерітіндісі.
20% сульфосалицил қышқылының ерітіндісі.
Темір нитратының стандарт ерітіндісі.
Талдау жүргізу. Сыйымдылығы 50мл белгіленген колбаға негізгі ерітіндінің аликвот бөлімін (5-10мл) салады, 10мл сульфосалицил қышқылының ерітіндісін қосып (апатиттегі темірді анықтағанда 20мл сульфосалицил қышқылын құяды) және аммиакпен ерітінді түсін қызыл бурадан сары түске өткенше аммиакпен бейтараптайды, содан соң 2-5 тамшы аммиакты артығымен қосады, ерітінді көлемін белгіге дейін жеткізеді және колориметрде 10мм кюветада бос үлгімен салыстыра отырып анықтайды. Аликвоттық бөлімде темір тотығаның санын калибирленген түзуден темір нитратының стандарт ерітіндісін пайдалана отырып анықтайды.
Темір құрамын темір (III) тотығын есептеу арқылы төмендегі теңдеумен анықтайды.
CFe2O3=(AFe2O3*W/aв)*100
Мұндағы:AFe2O3-калибирленген түзуден алынған темір тотығының құрамы.
W-негізгі ерітінді көлемі, мл.
а-үлгі салмағы, г.
в-негізгі ерітіндінің аливоттық бөлімі,мл.
Үлгідегі Fe2O3 саны 1-5% болса салыстырмалы қателік 5-2%құрайды.
Комплексометриялық әдіспен алюминийді анықтау
Әдістің мәні: Алюминийді қайта титрлеу арқылы анықтайды. Темірді титрлеп болған ерітіндіге белгілі мөлшерде трилон Б ерітіндісін құяды, рН=5,5 дейін бейтараптап және трилон Б артығын ксилен қызғылт индикаторының қатысуымен мырыш тұзының ерітіндісімен титрлейді. Алюминиймен бірге жәй комплексті қосылыс титан, мыс, мырыш, марганец сирек элементтерді титрлейді. Есептеу кезінде түзету жүргізеді.
Алюминийді дәл анықтау үшін жай әдісімен, негізгі титрленген ерітіндіні мырыш хлориді, трилон Б және басқа қалған элементтер фторидпен анықтайды. Алюминийді есептеу кезінде трилон Б, алюминий тотығының титрі пайдаланады.
Реактивтер.
Метал алюминий.
Аммиактың сулы ерітіндісі (25% ерітінді) сұйытылған 1:1.
Ацетатты буферлі ерітінді рН=5,5.
250мг ацетат натрийді және 20мл мұзды уксус қышқылын сыйымдылығы 1л белгіленген колбада ерітіледі.
Кристалды нитрат калий.
Тұз қышқылы (тығыздығы 1,19г/см3) сұйытылған 1:1 25%(көлем бойынша) және 0,001н мұзды сірке қышқылды ерітінді.
Ксилен-қызғылт индикаторы: құрғақ ступкада калий нитратымен 1:100 үгітеді.
Натрий ацетаты, кристалы.
Натрий фториді, қаныққан ерітінді.
Алюминий хлоридінің стандарт ерітіндісі.
0,5293г метал алюминийді 20мл 20% тұз қышқылында жай қыздыру арқылы ерітеді. Ерітіп болғаннан кейін ерітінді көлемін 1л жеткізеді. Дайын болған ерітіндінің 8мл-1мг алюминий тотығын құрайды (А ерітіндісі). А ерітіндісін тұз қышқылымен сұйылтқанда 0,01 н Б ерітіндісін алады, 1мл 10мкг алюминий тотығын құрайды. Оларды колориметриялық әдіспен алюминийді анықтауда қолданылады. 0,05М трилон Б ерітіндісі: 18,513г трилон Б аз мөлшердегі суда ерітіп, сүзеді және көлемін 1л жеткізеді.
Al2O3 бойынша ерітінді титрін талдау жүрісі бойынша құрастырады.
Метал мырышы.
0,05М мырыш хлорид ерітіндісі: 3,269г метал мырышты 50мл тұз қышқылы (1:1) ерітіндісінде ерітіп, 5-10мл дейін ерітіндіні буландырады және көлемін 1л жеткізеді содан соң 0,05 трилон Б ерітіндісімен мырыш хлорид ерітіндісінің қатынасын өлшейді. Ол үшін 10мл трилон Б ертіндісін көлемі 250мл колбаға құйып, 50-60мл сумен сұйылтады, 20мл ацетат буферлі ерітінді, ксилен индикаторын қосып мырыш хлоридімен титрлейді. Ерітінді түсі сары түстен қызыл-күлгін түске жеткенше жүргізеді.
Талдау жүргізу: Темірді титрлеген ерітіндіге 10мл 0,05М трилон Б ерітіндісін қосып 2-3 мин қайнатады. Ерітіндіге конго қағазының кішкене бөлігін салып аммиакпен қағаз түтіндегенше, ісінгенше бейтараптайды. Содан соң 20-25 мл ацетат буфер ерітіндісін қосып ерітіндіні қайнатады. Суытқаннан соң ерітіндіге шпателмен индикатор (к-о) қосады трилон Б артығын мырыш хлоридімен ерітінді түсі сарыдан қызыл-күлгінге айналғанша титрлейді.
Үлгіде хром, мырыш, қорғасын элементтері қатыспайды. Алюминий тотығы (%) төмендегі теңдеумен есептейді.
CАl2O3=(V-V’K)Tтp/Al2O3*W*100/ав*CTiO2*0,863м
Талдауға әсер ететін элементтердің қатысуына мырыш хлориді ерітіндісіне 30мл қаныққан натрийфторидін қосып 2-3мин қайнатады және суығаннан кейін трилон Б титрлейді. Алюминий құрамын есептеу арқылы төмендегі теңдеумен анықтайды. Берілген әдіс үлгіде 3% Al2O3 одан жоғары болғанда пайдаланады [8].
Фторды анықтау
Үлгіні ыдырату төменгі температурасы сілтілік балқыту электрод пайдалану арқылы анықтайды.
Реактивтер.
25% аммиак суының ерітіндісі.
Уксус қышқылды аммоний.
Лимон қышқылы, тұз қышқылы тығыздығы 1,9г/см3.
Мұзды уксус қышқылы.
Кристалды натрий гидроксиді.
Натрий фторидін этанолмен тұндыра отырып сулы ерітіндіден қайта кристалдап тазалайды. Кептіргіш шкафта 105-1100С температурада кептіреді. Реактивтерде және оның ерітіндісін органикалық шыны сосудтарда сақтайды.
3% сутегі пероксиді ерітіндісі.
10% трилон Б ерітіндісі. Фенолфталейн, 1% спирттік ерітінді келесі әдіспен дайындалады: 1г фенолфталейн 70мл этанолда ерітеді және 30мл су қосады.
Буферлі ерітінді рН=5,7-5,9 келесі әдіспен дайындайды. 230г уксус қышқылды аммонийді 10мл уксус қышқылын суда ерітіп, белгіге дейін 1л жеткізеді. Буферлі ерітіндісін рН-метрде өлшейді және рН=5,7-5,9 дейін аммиак немесе уксус қышқылы ерітіндісімен келтіреді.
Буферлі ерітінді рН=6 келесі әдіспен дайындайды. 294г лимон қышқылды натрий 1л дистиллятта ерітеді. Ерітінің рН-н рН-метрде өлшеп белгіге дейін келтіреді. Лимон қышқылды натрий болмаған жағдайда рН=6 келесі әдіспен дайындалады. 70г лимонқышқылы және 25г натрий гидроксиді 1л ерітіп буферлі ерітіндінің рН-н рН-метрде өлшейді.
Фтордың стандарт ерітіндісін 100мкг/мл келесі әдіспен дайындайды: 0,2210г натрий фторидін суда ерітіп және 1л белгіленген колбаға сұйылтады.
Градуирленген графикті тұрғызу.
Инструкция бойынша рН-метрді іске қосады. Фторид потенциялын анықтау үрдісі жұмысты бастар алдында рН-метрді 30мин қыздырады. Құралды қоспас бұрын, электродтарды сумен жуып, сүзгі қағазбен сүртіп және дистилденген су құйылған стаканға салады. 15мин өткеннен кейін стандарт ерітіндіні өлшейді, фтордың төмен құрамды болғаннан кейін рН-метрді 15мин тағыда қыздырады.
Жұмысты тоқтату кезінде электродтарды сумен жуады, сүзгі қағазбен кептіреді. Фтор селективті электротты құрғақ түрде сақтайды, ал хлор күміс электроттарды калий хлор ерітіндісінің қаныққан ерітіндісіне сақтайды. Хлор күмісті электрод калий хлоридінің қаныққан ерітіндісімен толықтырылады.
Сыйымдылығы 50мл белгіленген колбаға 2,5, 7,5,10 мл стандарт ерітіндісіне 100мкг/мл фтор, 10мл буферлі ерітінді рН=5,7-5,9 немесе 25мл буферлі ерітінді рН=6 қосып, белгіге дейін сумен жеткізіп араластырады. Өлшеуді 10мин өткен соң жүргізеді.
Стандарт ерітіндінің 25-30мл сыйымдылығы 50мл құрақ стаканға салады. Электродты ерітіндіге салып ерітінді потенциалын тоқтағанынша ұстайды. Одан соң бұл мәнді 3-5мин тексеріп құрал мәнін жазып алады. Ерітіндіден электродты алып,сумен жуып, сүзгі қағазбен кептіреді және келесі ерітіндінің шоғырын өлшеуге пайдаланады. Алынған мәліметтер бойынша градуирленген график тұрғызады.
Үлгіні ыдырату 0,5г майдаланған фосфоритті 0,0002г дәлдікке дейін өлшеп алып, никелді тигелге салып, 3г натрий гидроксидін қосады да 550-6000С 25мин аралығында балқытады. Балқыманы 150мл ыстық сумен полиэтилен стаканда сілтілейді, тигельді сақтықпен сумен шаяды. Қалған тұзды 25мл тұз қышқылымен 2-3тамшы 3% сутегі пероксиді ерітіндісін ерітеді. 250мл белгіленген колбаға ерітіндіні суытып, сумен белгіге жеткізіп араластырады. Одан әрі фторды төменгі әдіспен анықтаймыз.
а) буферлі ерітінді рН=5,7-5,9 пайдалану арқылы потенциометриалық анықтау.
Ыдыратылған үлгі ерітіндісінен 20мл ерітінді алып, сыйымдылығы 50мл колбаға құйып, 5 тамшы трилон Б құяды, 1-2 тамшы фенолфталеин қосады. Аликвоттық бөлімді аммиак ерітіндісімен күлгін түске дейін бейтараптайды. 10-15 мин өткен соң 10мл буферлі ерітінді құйып, белгіге дейін сумен жеткізіп араластырады. Дайын болған ерітіндінің 25-30мл стаканға құйып, электрод потенциялымен өлшеп, градуирленген графиктен табады.
Фтор құрамын процент бойынша төмендегі теңдеумен анықтайды.
СF=A*250*100/д*В*1000*1000
Мұндағы: А-графиктегі табылған фтор мәні.
д-үлгі салмағының массасы, г.
В-талдаудан алынған аликвод бөлімі, мл.
б)pH=6 буферлі ерітіндісін пайдаланып потенциометриялық анықтау.
15мл ыдыратылған ерітіндісіне алып сыйымдылыға 50мл белгіленген колбаға құяды, содан соң 5 тамшы трилон Б, 1-2 тамшы фенолфталин қосып, аммиак ерітінді алып күлгін түске дейін бейтараптайды. 10-15 мин өткен соң 25мл буферлі ерітінді қосып сумен белгіге дейін жеткізеді де рН-метрде селективті электрод арқылы фторид анықталады.
Фтор (%) құрамын төмендегі теңдеумен анықтаймыз.
CF=(A-500)*250*100/g*B*1000*1000
Мұндағы: (А-500)-талданатын ерітіндінің аликвот бөлімдегі фтор саны, мкг.
Екі параллель алынған үлгінің мәні 0,15% аспау керек.
Бақылау сұрақтары
1 Агрегаттыкқ күйдегі шикізат жағдайы
2 Фосфат шикізатының түрлері
3 Фосфорды анықтау әдісі
4 Кальцийді анықтау әдісі
Тапсырма. Оқытушының берген тапсырмасы бойынша әр түрлі фосфат шикізаттарына талдау жасау. Олардың құрамын анықтау қажет.
№ 9 ЗЕРТХАНАЛЫҚ ЖҰМЫС
ҚОС СУПЕРФОСФАТТЫҢ АЛЫНУЫ
1 Жұмыстың мақсаты:Іс-тәжірбиеде қос суперфосфатты алу технологиясымен танысу ,оның сапасын МЕСТ бойынша талдау жасау
Қысқаша теориялық бөлім
Қос суперфосфат шоғырлы фосфор тыңайтқышына жатады. Қос суперфосфатты фосфат шикiзаттарын фосфор қышқылы арқылы ыдырату жолымен алады. Оның сапасын ондағы сiңiрiмдiлiк, суда ерiгiштiк Р2О5-тың және бос фосфор қышқылының мөлшерлерiмен бағаланады.
Зертханада қос суперфосфат камералық әдiске жақын жолмен алынады. Қос суперфосфат алуда ең негiзгi реакция:
Сa5F(PO4)3+7H3PO4+5H2O=5Ca(H2PO4)2H2O+HF (1)
Фосфаттың құрамындағы доломит темiр, алюминий қоспалары да фосфор қышқылымен әрекеттеседi:
CaMg(CO3)2+4H3PO4+H2O=Cа(H2PO4)2H2O+Mg(H2PO4)2H2O+2CO2 (2)
AI2O3+2H3PO4+H2O=2AIPO4 2H2O (3)
Fе2O3+2H3PO4+H2O=2FePO4 2H2O (4)
Фторапатит ыдырағанда бөлiнген фторид сутегi кремний ангидридiмен және силикатпен әрекеттесiп төртфторлы кремний және гексафторкремний қышқылын түзедi.
4HF+SiO2=SiF4+2H2O (5)
SiF4+2HF=H2SiF6 (6)
Фосфор қышқылының шығынын есептеу
Фосфор қышқылының шығынын оқытушының тапсырмасы бойынша орындайды.
Апатиттi фосфор қышқылымен ыдыратқанда оның шығынын (1) реакция арқылы есептейдi.
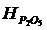 =2,33[Р2О5(апатит)], г немесе Н3РО4=
=2,33[Р2О5(апатит)], г немесе Н3РО4= 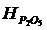 ×1,38, г
×1,38, г
Егер ыдыратуға қатысатын фосфор қышқылының шоғыры белгілі болса, онда шығынның саны,
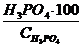 болады.
болады.
бұл жерде: 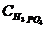 - ыдыратуға қатысатын Н3РО4 шоғыры, %
- ыдыратуға қатысатын Н3РО4 шоғыры, %
Немесе
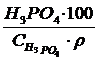 ; мл
; мл
бұл жерде: r - Н3РО4 тығыздығы , г/см3
Қос суперфосфатты Қаратау фосфаттарынан алатын болсақ, онда фосфор қышқылының шығыны төмендегі теңдеумен есептелінеді. ( 100 г Қаратау фосфоритін ыдыратқанда )
 = 2,54 А1 + 3,55 А2 + 1,39 А3 + 0,89 А4 - А, г
= 2,54 А1 + 3,55 А2 + 1,39 А3 + 0,89 А4 - А, г
Бұл жерде :А1, А2,А3,А4 жґне А – СаО, МgО, Al2О3, Fe2O3 және Р2О5 -нің фосфориттегі саны,%
Берілген шоғырдағы фосфор қышқылын шығынын есептегенде :
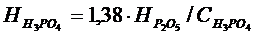 , г немесе
, г немесе 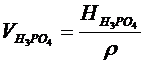 , мл
, мл
Бұл жерде: r - берілген шоғырдағы фосфор қышқылының тығыздығы, г/смì3 .
Есептеу мысалы
Құрамында 39,8% СаО, 2,5% MgO, 1,5% AI2O3, 1,0% Fe2O3 , 24,5% Р2O5 бар фосфорит ұнының стехиомтериялық нормасы 100% болғанда 73 % H3PO4 шығынын есептеңіз.
100г фосфорит ұнындағы Ca3(PO4)2, MgO, AI2O3, Fe2O3 және СаО, байланыспаған Ca3(PO4)2 массаларын есепеп табамыз.
Масса Ca3(PO4)2: (310. 24,5) /142=53,49г
мұндағы: 310 и 142 – Ca3(PO4)2 және Р2O5 молекулалық салмағы.
24,5 –, 100 г фосфорит ұнындағы Р2O5 массасы.
СaО –ның Ca3(PO4)2 түрінде байланысқан массасы
(53,49.3.56)/310=28,99г
мұндағы: 56 –СаО молекулалық массасы
СаО-ның Ca3(PO4)2, байланыспаған массасы
39,8 - 28,99 = 10,81 г
мұндағы 39,8 –100 г фосфорит ұнындағы СаО-ның масса, г
Масса MgO - 2,5г,
Масса Fe2O3 - 1,0 г
Масса AI2O3 – 1,5 г
100% шоғырлы фосфор қышқылының шығыны :

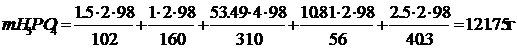
73% фосфор қышқылының шығымы
mH3PO4= 
73% фосфор қышқылының көлемі, мл.
V Ф.К. = 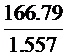 =107,12 см3
=107,12 см3
мұндағы 1,557 г/см3 - 73% шоғырлы фосфор қышқылының тығыздығы.
Қондырғылар, техникалық құрал жабдықтар:
Фарфор шашкасы
Электрплитасы
Кептіргіш шкаф
Химиялық ыдыстар
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Есептелінген мөлшердегі фосфор қышқылын фарфорлы ыдысқа салып, шыны таяқшамен араластыра отырып 1-2 минут аралығында есептелінген фосфорит ұнын салады. Араластыру температурасы 80-900С болу керек. Тағы да 3-5 минут араластырады да 10-1100С температурада кептіргіш шкафқа салады. Шкафта 60-90 минут тұру керек. Осы уақыт өткен соң фарфорлы ыдысты алып суытады да өлшейді. Алынған өнімді майдалап, жалпы, сіңірімді және суда ерімтал мен бос күйдегі Р2О5 талдау жасайды.
Талдаулардың орындалу әдісі
Жалпы Р2O5 талдау
1-1.5 г. қос суперфосфатты 0.001 г дәлдiкпен өлшеп алып, 250мл стаканға салады. Оған 50 мл 20%НСI тұз қышқылын құйып, бетін сағат әйнегiмен жауып қайнағанға шейiн қыздырады. Қайнатуды 30 минут iшiнде жүргiзiп, суытады. Суыған ерiтiндiнi өлшегіш 250 мл колбаға құйып, оны сызығына дейiн сумен толтырып араластырады. Сонан кейiн фильтратты таза конусты колбаға сүзедi. Онан 1 мл фильтратты пипеткамен алып 100 мл көлемдегi колбаға салып, оған 100 мл 50 мл дестилденген су мен 25 мл * Г * ерiтiндiсiн құяды. Содан соң колбаның көлемiн 100 мл жеткiзедi. 15 минуттан кейiн фотокалориметрде ерiтiндiнiң оптикалық тығыздығын өлшейдi. Табылған оптикалық тығыздықтың көрсеткiшi арқылы калибрленген графикпен Р2О5 -тың мг санын табамыз. Р2О5 пайыздық санын төмендегi формуламен есептеймiз
Р2О5 =( а × 250 × 100) /(д ×в 1000), %
бұл жерде: а - Р2О5 -тың калибрленген сызықпен табылған саны, мг
д - қос суперфосфаттың нақты мөлшерi, г.
в-талдауға алынған ерітіндінің көлемі, мл.
Сіңірімділік P2O5-i анықтау
0,0002 г дейін дәлдікпен өлшенген 1-2г қоссуперфосфатты үреңке арқылы 500мл көлемдегі колбаға салады. Үреңкедегі жұғылып қалған суперфосфатты 200мл 93+ 30С дейін қыздырылған трилон Б ертіндісін құйып шайқаңыз. Сонан соң, колбаны тығындап, механикалық шайқағышта 20-30 минут шайқаңыз. Ерітіндінің көлемін 500мл су мен жеткізіп «ақ лента» қағазы арқылы сүзіңіз.
Пипеткамен 2мл фильтратты алып, 100мл көлемдегі колбаға құйып үстіне 2мл 20%-тік тұз қышқылын, 10-15мл су құйып, 10 минут қайнатыңыз.
Сонан соң, оны суытады, 30мл су, 25-30 мл «Г» ерітіндісін қосады, колбадағы белгіге дейін сумен жеткізеді. Осы операциядан кейін ФЭК оптикалық тығыздығын тауып, теңдеу бойынша есептейді.
Р2О5 = (а × 250 × 100) /(д ×в 1000), %
бұл жерде: а - Р2О5 -тың калибрленген сызықпен табылған саны, мг
д - қос суперфосфаттың нақты мөлшерi, г.
в-талдауға алынған ерітіндінің көлемі, мл.
Суда ерімтал және бос түріндегі Р2О5-ті анықтау
0,0002г дейін өлшенген 4-5г қос суперфосфатты көлемі 500мл колбаға салып, 300мл су құйып, механикалық шайқағыш қондырғысында 30 минут шайқайды. Сонан соң ерітіндіні сумен белгіге дейін жеткізіп сүзеді.
Пипеткамен 2мл фильтрат алып көлемі 100мл колбаға құйыңыз. Оның үстіне 2мл 20%-тік тұз қышқылын, 5-10мл су құйып 10минут қайнатады. Колбаны суытып 30мл сумен сұйылтады, суыған колбаға 25-30мл фосфат ерітіндісін құйып. Оның көлемін 100мл дейін сумен жеткізеді. Одан әрі талдауды жалпы Р2О5 анықтағандай етіп жүргізтеді.
Р2О5 = (а × 250 × 100) /(д ×в 1000), %
бұл жерде: а - Р2О5 -тың калибрленген сызықпен табылған саны, мг
д - қос суперфосфаттың нақты мөлшерi, г.
в-талдауға алынған ерітіндінің көлемі, мл.
Реакцияға қатыспай қалған Р2О5-ті төмендегі жолмен анықтайды: Жоғарыда дайындалған ерітіндіден 50мл фильтратты алып конусты колбаға құяды. Оған 100-150мл су қосып, 3-5 тамшы метилоранж индикаторымен 0,1м NaOH 0,1М ерітіндісімен сары түске айналғанша титрлейді. Бос түрдегі Р2О5-тің массалық үлесін төмендегі теңдеумен есептейді:
Р2О5 бос = (V1*0,0071*V2/ m * V3)100,%
Бұл жерде:
V1 –0,1 М NaOH ерітіндісінің титрлегендегі кеткен көлемі, мл
V2 – ерітіндінің жалпы көлемі, мл (500мл)
V3-талдауға алынған ерітіндінің көлемі, мл
m – суперфосфаттың талдауға алынған мөлшері,г.
Үрдістің көрсеткіштерін есептеу
Қос суперфосфатты алуда маңызды көрсеткіштердің бірі фосфаттың ыдырау коэффиценті жатады. Фосфаттың ыдырау коэффициентін төмендегі теңдеумен анықтайды:
КЫ=([P2O5(ф)- P2O5(ж)- P2O5(сің)].B).100%/ P2O5(ф)
бұл жерде: Р2О5жалпы және Р2О5 сің.- қос суперфосфаттағы Р2О5-тың жалпы және сіңірімділік түріндегі массалық үлестері, %.
P2O5(ф) – фосфориттегі Р2О5-тың массалық үлесі, %
В-қос суперфосфат өнімінің шығымы,г.
Қос суперфосфаттың шығымы /В/ төмендегі қатынаспен табылады:
В=Gсуп/Gф
бұл жерде: Gсуп- қоссуперфосфаттың массасы, г
Gф-фосфаттың массасы, г
Тәжірбие нәтижелерін төмендегі кестеге арқылы өңделеді
7- кесте–Тәжірбие нәтижелерін
| Р2О5фосфаттағы , % | Р2О5жалпы , % | Р2О5бос% | Р2О5сің % | Р2О5суда ерімтал % | Кы % |
Бақылау сұрақтары.
1. Қос суперфосфат деген не, оның алынуы.
2. Шикізаттардың түрлері және олардың өнімінің сапасына тиетін әсерлері.
3. Өнімнің құрамына, ыдырау дәрежесіне әсер ететін факторларды келтіріңіз
4. Фосфор қышқылының шығынын есептеу.
5. Ыдырату коэффицентін есептеу.
6. Талдаудың орындалу тәртіптері.
7. Қос суперфосфаттың алыну әдістері.
Тапсырма.Берілген өнімніңсанына қарай фосфор қышқылын есептеу. Химиялық талдау жасау. Қорытынды шығару.
№ 10 ЗЕРТХАНАЛЫҚ ЖҰМЫС
ПРЕЦИПИТАТТЫҢ АЛЫНУЫ
1 Жұмыстың мақсаты мен міндеті:преципитатты лабораториялық жағдайда алу процесiн үйренумен қатар, технологиялық көрсеткіштерге баға бере бiлудi көздейдi.
Қысқаша теориялық бөлім
Преципитатты фосфор тыңайтқышы және фосфат жемi ретiнде қолданады. Тыңайтқыш преципитат құрамында 33-48%, Р2О5 сiңiрiмдiлiк, ал фосфат жемi ретiнде қолданылатын преципитатта Р2О5-тың 0.4%тiк тұз қышқылы ерiтiндiсiнде ерiмтал саны 47 ± 1% болу керек.
Преципитатты фосфор қышқылы ерiтiндiсiнен, әк сүтiмен болмаса, езiлген әктiң лайлы ерiтiндiсiмен әрекеттестiрiп алады. Тұнбаға түскен CaHPO4×2H2O тұзын сүзiп құрғатады. Преципитатты алуға әлсiз фосфор қышқылы қолданады.
Фосфор қышқылын кальций карбанаты тұзы пайда болады:
CaCО3 + 2H3PO4 = Ca(H2PO4)2 + CO2 + H2O (1)
Ca(OH)2 + 2H2PO4 = Ca(H2PO4)2 + 2H2O (2)
Әлсiз фосфор қышқыл ерiтiндiсiн одан әрi бейтараптандырған сайын, дигидрофосфат кальций гидрофосфатна айналады:
Ca(H2PO4)2+2H2O = CaHPO4 × 2H2O + H3PO4 (3)
Дигидрофосфат әкпен немесе әк сүтiмен де әрекеттесiп кальций гидрофосфатына айналады:
Ca(H2PO4)2 + Ca(OH)2 + 2H2O = 2CaHPO4× 2H2O (4)
Ca(H2PO4)2 + CaCO3 + 3H2O = 2CaHPO4× 2H2O (5)
Берiлген әк сүтi егерде стехиометрикалық мөлшерден жоғары болса, калций гидрофосфат ыдырап кальций фосфатына айналуы мүмкiн.
4CaHPO4=Ca(H2PO4)2+Ca3(PO4)2 (6)
Сол себептен фосфор қышқылын әк сүтiмен бейтараптандырғанда оның мөлшерiн есептеп берiп, ерiтiндiнiң РН көрсеткiшiн 6.3 тен асырмау керек. Фосфор қышқылындағы қоспалар әкпен немесе әк сүтiмен әрекеттескенде:
H2SO4 + Ca(OH)2 = CaSO4 × 2H2O (7)
H2SiF6 + Ca(OH)2 = 3CaF2 + SiO2 + 4H2O (8)
Кальций гидрофосфатың кристалдануына көп факторлар әсер етедi. Кальций гидрофосфатың жайлап тұнбаға түсiрсе оның кристалдары үлкен болады. Температураны тұнбаға түсiрерде 40-600С тан асырмау керек. Түсетiн кристалдарға фосфор қышқылының құрамындағы қоспалар керiсiнше әсер етедi.
Преципитатты алу процесiнде ең маңызды көрсеткiшiне оның преципитаттың коэффициентi жатады. Бұл көрсеткiштi ылғалсыз преципитаттағы Р2О5 -тың санды мөлшерлерiмен өнiмге талдау жасап бағалайды.
Қондырғылар, техникалық құрал жабдықтар:
Нейтрализатор
Кептіргіш шкаф
Химиялық ыдыстар
Фотоколориметр
Аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Әрекетшілердің шығын мөлшерiне есептер.
Әкті және калций карбонатының керектi шығын мөлшерiн төмендегi теңдеулермен табады:
H3PO4 + Ca(OH)2 = CaHPO4 × 2H2O (9).
(Fe1Al)2O3 + 2H3PO4 + H2O = 2(Fe1Al)PO4 × 2H2O (10)
H2SO4 + Ca(OH)2 = CaSO4 × 2H2O (11)
H2SiF6 + 3Ca(OH) = 3CaF2 + SiO2 + 4H2O (12)
H3PO4 + CaCO3 + H2O = CaHPO4 × 2H2O + CO2 (13)
H2SO4 + CaCO3 + H2O = CaSO4 × 2H2O + CO2 (14)
H2SiF6 + CaCO3 = CaSiF6 + CO2 + H2O (15).
Осы реакциялардың iшiнен /10/ реакциясында әк пен кальций корбанат қатыспайды, тек қана фосфор қышқылы әрекеттеседi.
Әк пен кальций карбонатының шығынына мысал келтiрейiк. Есептi 100г қышқылға жүргiземiз.
ЭФҚ /экстракциялық фосфор қышқылы/ құрамы, %:
P2O5-20, F-1.5, (Fe1Al)2O3-2, SO3-1.5.
100г фосфор қышқылындағы массалары:
Н3РО4 = (20 × 2 × 98) /142 = 27,61 г
(Fe1Al) = 2 г
H2SiF6 = (1,5 × 144) / (6 × 19) = 1,89 г
H2SO4= (1,5 × 98) /80 =1,84 г
(Fe1Al)2O3 пен байланысқан фосфор қышқылының массасы:
(2× 2× 98) / 131 = 2,99 г
Бұл жерде: 131 - (Fe1Al)2O3 орташа малекулалық массасы. Фосфор қышқылының әк немесе әк сүтiмен байланысатын массасы:
27,61 - 2,99 = 24,62 г.
СаО шығыны: 9 реакция бойынша (56 × 24,62) / 98 = 14,07 г
11 реакция бойынша (56 × 1,84) / 98 = 1,05 г
12 реакция бойынша (3 × 56 × 1,89) / 98 = 2,21 г
Жалпы СаО шығыны: 14,07 +1,05 +2,21 = 17,33 г.
Оксид кальций реактивiндегi СаО саны 99% болғанда, СаО-ның шығыны: 17,33 / 0,09 = 17,51 г
Әк сүтінің шығыны (әк сүтiнiң концентрациясы 70 г/л болғанда):
(17,33 × 1000) / 70 = 247,57 мл.
Дайындалған әк сүтiнiң тығыздығы 1,15 г/см3 болса, оны дайындағанда кететiн судың массасы:
247,57 × 1,15 -17,51 = 266,86 г
Кальций карбонатының шығыны:
13 реакциясымен (100× 24,62) / 98 = 25,12 г
14 реакциясымен (100 × 1,84) /98 = 1,88 г
15 реакциясымен (100 × 1,89) /98 = 1,31 г
Бұл жерде:
4,62. 1,84. 1,89 - Н3РО4, H2SO4 және H2SiF6 массалары г.
Жалпы шығын: 25,12 +1,88 +1,31 = 28,31 г.
Кальций карбонаты тұзының тазалығы 95% болғанда жалпы СаСО3 шығыны:
28,31 / 0,95 = 29,8 г
СаСО3 суспензиясында Ж:Т қатынасы 1,5:1 болғанда, оны дайындағанда кететiн судың массасы:
29,8 × 1,5 = 44,7 г
СаСО суспензиясының жалпы массасы 44,7 + 29,8 = 74,5 г
Әк сүтін дайындау
500мл көлемдегi араластырғышы бар фосфор не шыны стаканға 50-70мл су құйып 20-250С температурада 2-3г әктi қосып былғайды. Одан әрi әлсiн-әлсiн су мен әктi қосып 30-40 минут iшiнде әк сүтiн дайындауды бiтiредi. Әк пен судың шығындарын жоғары көрсетiлген есеппен iстеу керек.
Преципитаттың алынуы
500мл көлемдегi стаканға есептелген фосфор қышқылын құйып, араластырушыны жұмысқа қосыңыз. 40-500С температурада 10-15 см3/мин жылдамдықта әк сүтiн қосып, тәжiрибенi 1-1,5 сағатқа созыңыз. Сонан соң пульпаны Бюнхер воронкасымен сүзу керек. Шыққан фильтраттың көлемiн, массасын табасыз да, ондағы Р2О5 -тың мөлшерiне талдау жүргiзесiз. Тұнбаны бiрнеше рет жуасыз да, оны шкафқа 1000С температурада кептiресiз. Ылғалсыз преципитатты өлшейсiз. Алынған преципитаттағы жалпы және сiңiрiмдiлiк түрiндегi Р2О5тi анықтайсыз. Талдауды ылғалды преципитатқа да жасауға
болады, бiрақ ылғалдығын тауып, ылғалсыз өнiмiн есептеу керек.
P2O5кебу = (P2O5ылғал× 100) / (100 - W) г.
Бұл жерде: Р2О5 -ылғалды өнiмдегi жалпы және сiңiрiмдiлiк
түрiндегi Р2О5 -тың массалық үлесi %.
W - өнiмнiң ылғалдығы,%.
Ылғалсыз преципитаттың массасы:
Gқұрғақ = (Gылғалды ×100) / (100 - W), г.
Бұл жерде: G - ылғалды преципитаттың массасы, г.
W - преципитаттың ылғалдылығы,%
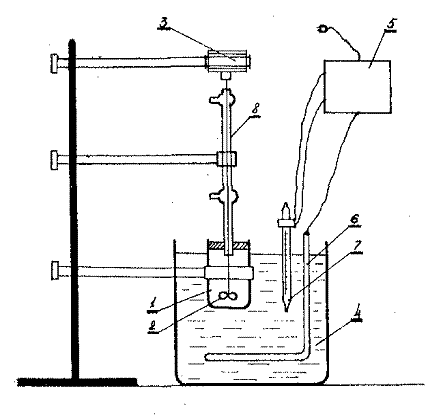
7-. сурет.- Преципитат алынуы қондырғысының нобайы
Өнiмдерге талдау жасау
Преципитаттың ылғалдығын анықтау
0.001г дәлдiкке дейiн өлшенген бюксқа 3-5г ылғалды преципитатты салып өлшейдi. Сонан соң бюксты шкафта 1000С температурада тұрақты салмаққа дейiн кептiредi. Әр 2 сағатта салмағын өлшеп тұру керек. Кептiрiлген преципитат кальций хлориды бар эксикаторда суытылады. Суытылған преципитатты өлшейдi. Преципитаттың ылғалдығы төмендегi формуламен есептейдi:
W = (g - g1) / g × 100%
Бұл жерде: g - кептiрiлуге дейiн преципитаттың салмағы, г.
g1 - кептiрiлген преципитаттың салмағы, г.
Преципитатпен фильтраттағы жалпы Р2О5 -тi фотоколориметрлiк әдiспен анықтау
1-1.5 г. преципитатты немесе 5 г фильтратты 0.001 г дәлдiкпен алып 200мл стаканға салады. Стаканға 50мл 20%-тік тұз қышқылын құйып қайнағанға дейiн қыздырады. Стаканды сағат әйнегiмен жауып қою керек. Қайнатуды 30 минут iшiнде жүргiзiп, суытады. Суытылған ерiтiндiнi 250 мл колбаға құйып, оны сызығына дейiн сумен толтырып араластырады. Сонан кейiн фильтратты таза конусты колбаға сүзедi. Онан 1 мл фильтратты пипеткамен алып 100 мл көлемдегi колбаға салып, оған 100 мл 50 мл дестилденген су мен 25 мл * Г * ерiтiндiсiн құяды. Содан соң колбаның көлемiн 100 мл жеткiзедi. 15 минуттан кейiн фотокалоиметрде ерiтiндiнiң оптикалық тығыздығын өлшейдi. Табылған оптикалық тығыздықтың көрсеткiшi арқылы калибрленген графикпен Р2О5 -тың мг санын табамыз. Р2О5 проценттiк санын төмендегi формуламен есептеймiз
Р2О5 = а × 250 × 100 / д × 1000, %
бұл жерде: а - Р2О5 -тың калибрленген сызыєпен табылған саны, мг
д - преципитаттың шақты мөлшерi, г.
Преципитаттағы сiңiрiмдiлiк түрiндегi Р2О5 – ты анықтау
1 г преципитатты 0.001г дәлдiкке дейiн өлшеп, 500 мл көлемдегi колбаға үренке арқылы 200 мл трилон В ерiтiндiсiмен жуады. Ерiтiндi 93 ± 3 0C температураға дейiн қыздырылып нақты мөлшердегi преципитатты жуып колбаға түсiредi. Сонан соң колбаға 15 минут шайқаушы машинада шайқайды, суытады да көлемiн 500 мл дестилденген сумен жеткiзедi. Оны *ақ лента* қағазы арғылы сүзедi. 1 мл фильтратты 100 мл көлемдегi колбаға салып, жоғарыда көрсетiлген әдістеме арқылы талдау жасайды /жалпы Р2О5/.
Жұмыстың нәтижелерiн өңдеу
Преципитатқа айналу коэффицентi есептелiнедi:
Кпрец = (С прец · Р2О5прец / Ск · Р2О5к )· 100, %
бұл жерде: Ск, С прец – алғашқы фосфор қышқылымен ылғалсыз
преципитаттың массалары, г.
Р2О5к, Р2О5прец – фосфор қышқылындағы және ылғалсыз
преципитаттағы Р2О5 –тiң массалық үлесi, %.
Жұмыстың нәтижелерiн кестелерге жазыңыздар
8-к е с т е- Алғашқы заттар
| Әрекеттесушiлердiң шығыны, г. | Ерiтiндiнiң құрамы, % масс. | |||
| Фосфор қышқылы | Әк немесе карбонат кальций | Су | Фосфор қышқылындағы Р2О5 | Әк немесе СаСО3 құрамындағы СаО |
9-к е с т е
| Температура | СаСО3 қоймалжынындағы немесе СаОН- тағы СаО-ның мөлшерi, г/л | Преципитатталған уақыт, сағат | Преципитат | фильтрат | ||||
| масса, г | ылғалдығы, %. | Р2О5 %. | масса, г. | Р2О5 % | ||||
| жалпы | сiңiрiмдi | |||||||
Кпрец = j(t) или Р2О5усв .= j(t)
Бақылау сұрақтары
1. Преципитат деген не?
2. Преципитат алуға қажетті шикізаттар
3. Процестiң химизмi.
4. СаСО3 немесе Са(ОН)2 шығын есептеу жолдары.
5. Жұмыстың орындалу тәртiбi.
6. Өнiмге және фильтратқа қандай талдаулар жасайды.
7. Преципитаттың коэффиценттiк есебi.
Тапсырма. Берілген тыңайтқышқа шығындалатын күкірт қышқылын есептеу. Берілген температурамен уақытта процесті жүргізу Өнімнің сапасынн анықтау.
№11 ЗЕРТХАНАЛЫҚ ЖҰМЫС
ЖАЙ СУПЕРФОСФАТТЫҢ АЛЫНУЫ
Жұмыстың мақсаты мен міндеті: Жай суперфосфаттың алынуы жолымен танысып, оның өндірістегі регламент параметрлерімен салыстырып, сапасын анықтауды үйрену.
Қысқаша теориялық бөлім
Жай суперфосфат фосфат шикізатын күкірт қышқылымен ыдырату жолмен алынады. Ол. 65-72% қатты, 28-35% сұйық заттардан тұрады. Қатты күйлерінде кальций, магний, темір, алюминийфосфаттары, кальций сульфаты, ыдырамайтын минералдар жатады. Сұйық күйлері фосфор қышқылымен қаныққан дигидрофосфат кальцийден тұрады. Жай суперфосфаттың сапасын ондағы сіңірімді түрдегі Р2О5-тың мөлшері арқылы бағалайды. Бастапқы шикізат түріне қарап, жай суперфосфаттың сіңірімді Р2О5 түрі 14 пен 21 %-тің аралығында болады.
Негізгі реакциялар мен күкірт қышқылының шығындарын анықтау есептері.
Жай суперфосфатты апатитті күкірт қышқылымен өңдеу арқылы алынуын төмендегі қорытынды теңдеумен жазуға болады:
2Ca3 F(PO4)3 + 7H2 SO4 + 6,5H2 O =3Ca(H2PO4)2*H2O + 7CaSO4*0,5 H2O + 2HF (4.1)
Шынында, апатит күкірт қышқылымен ыдыратқанда оның алыну реакциясы 2 сатыда жүреді.
Бірінші сатыда фторапатит күкірт қышқылымен әрекеттеседі:
Ca5F(PO4)3+5H2SO4+2,5H2O=3H3PO4+5CaSO4*0,5H2O+HF (4.2)
Екінші сатыда реакциялар төменгі жылдамдықпен өтіп, 15-30 тәулікке дейін созылады.
Ca5 F (PO4)3 + 7H3РO4 + 5H2 O = 5Ca (H2PO4)2*H2 O + HF (4.3)
Қаратау фософриттің апатитен ыдырау артықшылығы оның ыдырау жолы 3 сатыда жүреді.
Бірінші сатыдағы реакциялар:
Ca5 F(PO4)3 + 5H2SO4 = 5CaSO4 + 3 H3PO4 + HF (4.4 )
Ca Mg (СO3)2 + 2H2 SO4 = CaSO4 + Mg SO4 + 2CO2 + 2H2O ( 4.5)
Mg2 Si O4 + 2H2SO4 = 2 MgSO4 + S iO2+H2O ( 4.6)
Бұл реакцияларда үрдіс фосфор қышқылымен сульфат магний тұздары пайда болумен аяқталады.
Екініш сатыда:
Ca5 F (PO4)3 + 5Mg SO4 + 7H3PO4 = 5CaSO4 + 5Mg (H2PO4)2 + HF (4.7)
Екінші сатыдағы реакция біткенде, оның сұйық күйі Н3РО4, Mg(H2PO4)2 және Н2О тұрады.
Үшінші сатыда ыдырамай қалған апатит фосфор қышқылмен әрекеттеседі:
Ca5 F(PO4)3 + 7H3PO4 = 5 Ca(H2PO4)2 +HF (4.8)
Фосфорит құрамындағы темір және алюминий тотықтары да күкірт қышқылымен әрекеттеседі.
Fe2 O3 + H2SO4 + Ca(H2PO4) = 2 FePO4 + CaSO4 + 3H 2O (4.9)
Al2O3 + H2 SO4 + Ca(H2PO4)2 = 2 AlPO4+ CaSO4 + 3 H2O (5.0)
Апатитті күкірт қышқылмен ыдыратудағы күкірт қышқылының шығынын /1/ теңдеу арқылы есептейміз:
7МH2SO4 /3М P2O5 = 686/428=1,61
массаның бөлігі 1 массалық Р2О5 –тың бөлігіне тең.
Егер апатиттің 100масс. а% Р2О5 бар болса, 100%-тік күкірт қышқылының шығыны:
а.1,61 =в массалық бөлшек Н2SO4
Ыдыратуға жұмсалатын Н2SO4 шоғыры С болғанда оның шығыны:
a.1,61/С=в /С м.б/ 100м. болады;
болмаса, оның көлемі
а.1,61/С* ρ=в/С* ρ, см3
бұл жерде: ρ-күкірт қышқылының тығыздығы, г/см3.
Жай суперфосфатты Қаратау фосфоритінен алғанда күкірт қышқылының шығынын /4.1/,/4.3/,/4.9/ және /5/ реакциялары арқылы есептейді.
Көрсетілген реакциялар бойынша есептегенде шығын коэффициентері мынадай болады:
1 реакция: 7 Н2SO4/3Р2О5
2 реакция бойынша: 7*H2SO4 / 3* P2O5 = 7*98/ 3*142 = 1,61 м.б
3 реакция бойынша 1моль H2SO4 / 1моль СO2 = 98 / 44 = 2,33 м.б
4 реакция бойынша 1 моль H2SO4/ 1моль Fe2O3 =98/160=0,61 м.б
5 реакция бойынша: 1 моль H2SO4/ 1 моль Al2O3 =98/102=0,96 м.б
Сонда жалпы күкірт шығыны:
N H2SO4 = 1,61*a + 2,33*в + 0,61*с + 0,96*д
Бұл жерде: а,в,с және д -Р2О5, СO2, Fe2O3 және Al2O3 шикізаттағы мөлшері, %.
Күкірт қышқылының массалық немесе көлемдік шығыны жоғарыда көрсетілген есептер бойынша табылады. Іс-жүзінде H2SO4 шығыны стехиометриялық мөлшерден 3-5% жоғары алынады.
Қондырғылар, техникалық құрал-жабдықтар
фарфор шашкасы
кептіргіш шкаф,
химиялық ыдыстар
техникалық және аналитикалық таразы
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Жұмыс келесі сатылардан тұрады:
1. Күкірт қышқылының шығынын мөлшерін есептеп табу
2.Жай суперфосфатты берілген жағдайда алу
3.Суперфосфаттағы жалпы, сіңірімділік, суда ерімтал және реакцияға қатыспай қалған (бос) фосфор қышқылының Р2О5-түрінде мөлшерін анықтау
4. Өндірістік көрсеткіштерін есептеу
Есептелінген мөлшердегі күкірт қышқылын фарфорлы ыдысқа салып 50-600С қыздырылған соң, шыны таяқшамен араластыра отырып 1-2 минут аралығында есептелінген фосфорит ұнын салады. Сонан соң суперфосфаты бар шашканы 105-1100С температурада кептіргіш шкафқа салады. Шкафта 60-90минут тұру керек. Осы уақыт өткен соң фарфорлы ыдысты алып суытады да өлшейді. Алынған өнімді майдалап, жалпы, сіңірімді және суда ерімтал мен бос күйдегі Р2О5 талдау жасайды.
Талдаулардың орындалу әдісі
Жалпы Р2O5 талдау
1...1.5 г. жай суперфосфатты 0.001 г дәлдiкпен өлшеп алып, 250мл стаканға салады. Оған 50 мл 20%НСI тұз қышқылын құйып, бетін сағат әйнегiмен жауып қайнағанға шейiн қыздырады. Қайнатуды 30 минут iшiнде жүргiзiп, суытады. Суыған ерiтiндiнi өлшегіш 250 мл колбаға құйып, оны сызығына дейiн сумен толтырып араластырады. Сонан кейiн фильтратты таза конусты колбаға сүзедi. Онан 1 мл фильтратты пипеткамен алып 100 мл көлемдегi өлшегіш колбаға салып, оған 50 мл дестилденген су мен 25 мл * Г * ерiтiндiсiн құяды. Содан соң колбаның көлемiн 100 мл жеткiзедi. 15 минуттан кейiн фотокалоиметрде ерiтiндiнiң оптикалық тығыздығын өлшейдi. Табылған оптикалық тығыздықтың көрсеткiшi арқылы калибрленген графикпен Р2О5 -тың мг санын табамыз. Р2О5 пайыздық санын төмендегi формуламен есептеймiз
Р2О5 = (m1*V1*100)/( m2*V2*1000) %
m1-калибирленген графикпен табылған Р2О5-тің массасы,мг
V1- колбаның көлемі, см3
m2- талдау алынған суперфосфаттың массасы, г.
V2-талдауға алынған фильтраттың көлемі, см3
Сіңірімділік P2O5-i анықтау
0,0002 г дейін дәлдікпен өлшнген 1-2г жайсуперфосфатты үренке арқылы 500мл көлемдегі колбаға салады. Үренкедегі жұғылып қалған суперфосфатты 200мл 93+ 30С дейін қыздырылған трилон Б ертіндісімен құйып шайқаңыз. Сонан соң, колбаны тығындап, механикалық шайқағышта 20-30минут шайқаңыз. Ерітіндінің көлемін 500мл сумен жеткізіп «ақ лента» қағазы арқылы сүзіңіз.
Пипеткамен 2мл фильтратты алып, 100мл көлемдегі колбаға құйып, үстіне 2мл 20%-тік тұз қышқылын, 10-15мл су құйып, 10 минут қайнатыңыз.
Сонан соң, оны суытып, 30мл су, 25-30 мл «Г» ерітіндісін қосып, колбадағы белгіге дейін сумен жеткізіңіз. Осы операциядан кейін ФЭК оптикалық тығыздығын тауып, теңдеу бойынша есептеңіз.
Р2О5 = (m1*V1*100)/( m2*V2*1000) =%
m1-калибирленген графикпен табылған Р2О5-тің массасы,мг
V1- колбаның көлемі, см3
m2- талдау алынған суперфосфаттың массасы, г.
V2-талдауға алынған фильтраттың көлемі, см3
Суда ерімтал және бос түріндегі Р2О5-ті анықтау
0,0002г дейін өлшенген 4-5г жай суперфосфаттың көлемі 500мл колбаға салып, 300мл су құйып, механикалық шайқағыш қондырғысында 30минут шайқайды. Сонан соң ерітіндіні сумен белгіге дейін жеткізіп сүзеді.
Пипеткамен 2мл фильтрат алып көлемі 100мл колбаға құйыңыз. Оның үстіне 2мл 20%-тік тұз қышқылын, 5-10мл су құйып 10минут қайнатады. Колбаны суытып 30мл сумен сұйылтады, суыған колбаға 25-30мл фосфат ерітіндісін құйып. Оның көлемін 100мл дейін сумен жеткізеді. Одан әрі талдауды жалпы Р2О5 анықтағандай етіп жүргізтеді.
Р2О5 = (а × 250 × 100) /д ×в 1000, %
бұл жерде: а - Р2О5 -тың калибрленген сызықпен табылған саны, мг
д - қос суперфосфаттың нақты мөлшерi, г.
в-талдауға алынған ерітіндінің көлемі, мл.
Реакцияға қатыспай қалған Р2О5-ті төмендегі жолмен анықтайды: Жоғарыда дайындалған ерітіндіден 50мл фильтратты алып конусты колбаға құяды. Оған 100-150мл су қосып, 3-5 тамшы метилоранж индикаторымен 0,1м NaOH 0,1М ерітіндісімен сары түске айналғанша титрлейді. Бос түрдегі Р2О5-тің массалық үлесін төмендегі теңдеумен есептейді:
Р2О5 бос = (V1*0,0071*V2/ m * V3)100,%
Бұл жерде:
V1 –0,1 М NaOH ерітіндісінің титрлегендегі кеткен көлемі, мл
V2 – ерітіндінің жалпы көлемі, мл (500мл)
V3-талдауға алынған ерітіндінің көлемі, мл
m – суперфосфаттың талдауға алынған мөлшері, г.
Үрдістің көрсеткіштерін есептеу
Жай суперфосфатты алуда ең маңызды көрсеткіштерінің біріне фосфаттың ыдырау коэффиценті жатады. Фосфаттың ыдырау коэффицентін мына формуламен анықтайды.
К=(Р2О5 сің/Р2О5 жалпы)100,%
бұл жерде:Р2О5 жалпы және Р2О5 сің –жай суперфосфаттың Р2О5-тің жалпы сіңірімділік түріндегі массалық үлестері, %
Жай суперфосфаттың шығымы /В/ төмендегі қатынаспен табады:
B = Gсуп../ Gg ;
Бұл жерде: Gсуп.-жай суперфосфаттың массасы,г.
Gg –фосфаттың массасы,г.
7 Жұмыстың нәтижелерін кестемен өрнектеңіз
10-кесте-суперфосфаттың сипаттамасы мен құрамы
| Р2О5 жалпы, % | Р2О5 бос , % | Р2О5 сің , % | Р2О5 суда ерімтал , % | К , % |
Бақылау сұрақтары
1. Жай суперфосфат қалай алынады?
2.Фосфаттың ыдырау коэффициенті деген не, ол қалай анықталады?
3.Ыдырау үрдісіне температура мен күкірт қышқылы қалай әсер етеді, оны түсіндіріңіз?
4. Апатит пен Қаратау фосфоритінің ыдырау үрдісіндегі айырмашылығын түсіндіріңіз.
5. Күкірт қышқылының мөлшері қалай есептелінеді.
6. Жай суперфосфаттағы Р2О5 түрлері, оларға сипаттама беріңіз.
Тапсырма. Оқытушының берген бастапқы мәліметтері бойынша есептеу жүргізу және соған байланысты өнімді алып, талдау жасау
№ 12 ЗЕРТХАНАЛЫҚ ЖҰМЫС
АММОФОСТЫҢ АЛЫНУЫ ЖӘНЕ ОНЫҢ САПАСЫН ТЕКСЕРУ
Жұмыстың мақсаты мен міндеті: аммофостың алынуын оқып үйрену және оның сапасын бақылау.
Қысқаша теориялық бөлім
Аммофос – құрамында екі қоректі элементі бар (азот және фосфор) жоғары шоғырлы күрделі тыңайтқышқа жатады. Өндіруге қолданылатын алғашқы шикізаттың түріне байланысты оның құрамында 41-52% сіңірімділік Р2О5 және 9-13% N болады.
Аммофос экстракциялық немесе термиялық фосфор қышқылдарын аммиак газымен бейтараптаңдыру жолымен алынады.
H3PO4 + NH3(г) = NH4H2PO4 + 147кДж (1)
H3PO4 + 2NH3(г) = (NH4)2HPO4 + 215кДж (2)
H3PO4 + 3NH3(г) = (NH4)3PO4 + Q (3)
Фосфат аммоний тұздары тұрақсыз қосылыстарға жатады: аммоний дигидрофосфаты 1000С, аммоний гидрофосфаты 700С, ал аммоний үшфосфаты 25-300С температура ыдырай бастайды. Сол себептен аммофостың құрамы 80-90% аммоний дигидрофосфат, 10-20% аммоний гидрофосфат тұздарынан тұрады.
Егерде аммофосты алуға экстракциялық фосфор қышқылы (ЭФҚ) қолданылса, оның құрамындағы темір, алюминий, магний, кальций сульфаттары де аммиакпен әрекеттеседі. ЭФҚ құрамындағы H2SO4 және H2SiF6 қышқылдары да аммиакпен бейтараптанып тұздар құрайды:
2NH3 + H2SO4 = (NH4)2SO4 (4)
2NH3 + H2SiF6 = (NH4)2SiF6 (5)
ЭФҚ-нан бейтараптандырып алынған аммофоста суда еритін фосфаттарға: NH4H2PO4, (NH4)2HPO4, (NH4)2SO4, (NH4)2SiF6, цитрат аммоний ерітіндісінде еритіндерге: AІPO4.2H2O, FePO4.2H2O, CaHPO4. 2H2O NH4(Fe,AІ)(HPO4)2 .0,5H2O, NH4MgPO4 .2H2O жатады. Осы екі түрдегі фосфаттардың қосындысы сіңірімділік фосфаттар деп аталады. Аммофостың құрамында жоғарыда келтірілген қосылыстардан басқа фторид, фторидсиликат, гипс тағы басқа қоспалар да болады.
Қондырғылар, техникалық құрал жабдықтар:
Газ тәрізді аммиактан аммофосты алу қондырғысы
Электр плитасы
Кептіргіш шкаф
Химиялық ыдыстар
Фотоколориметр
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Лабораторияда аммофосты аммиак газының қолданылуына байланысты үш әдіспен алуға болады. Лаборатория қондырғысының үлгісі 1 суретте келтірілген.
3.1.Баллонан аммиакты жіберу жылдамдығын реометр арқылы реттейді. Ол үшін үшбағытты кранды «а» жағдайына көшіреді, яғни аммиакты ауаға жібереді. Реометрмен /3/ керекті жылдамдақта аммиакты жіберуді реттегеннен кейін, үшбағытты кранды «в» жағдайына көшіреді, яғни аммиакты фосфор қышқылы арқылы жібереді. Алдын ала аммиактың жылдамдығы мен мөлшерін біліп, фосфор қышқылын бейтараптандыру процесінің керекті уақытын есептеп табу керек. Үздіксіз аммиактың жылдамдығын реометрмен бақылап тұру керек. Егер аммиактың жылдамдығы төмендесе, онда барботер тұздармен бітеліп қалғандығын білдіреді. Бейтараптандыру процесін pH арқылы бақылайды. PH көрсеткіші 4 пен 6-ның арасында болу керек. Егерде pH – метр приборы болмаса pH бақылауы әмбебап индикатор қағазы арқылы орындалады. Бейтараптандыру процесін 60-800С аралығында жүргізу керек. Берілген температураны контакт термометрі 12 арқылы реттейді. Бейтараптандыру процесі біткен соң барботерді ерітіндіден шығарып, үшбағытты кранды “а” жағдайына көшіріп, аммиак баллонын жабады. Жалпы аммиактың шығынын табу үшін орта жылдамдықты (мл/мин) бейтараптандыру уақытына көбейтеді.
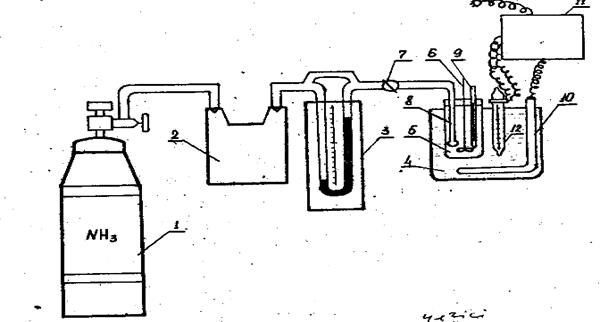
1 –сурет -Аммофос алыну қондырғысының үлгісі
| 1. Аммиак баллоны 2. Ресивер 3. Реометр 4. Термостат 5. Реактор 6. Былғауыш | 7. 3-жолды кран 8. Барботер 9. Бақылау термометрі 10. Қыздырғыш 11. Термореле 12. Контакт термометрі |
3.2. Аммиак газын аммиак суын қыздыру арқылы алуға болады.Оның қондырғысы аммиак құйылған колбадан, газды шығаратын түтіктен, ол түтіктің бір шеті фосфор қышқылының ерітіндісіне түсу керек. Фосфор қышқылы бар колбаны термостатқа орналастырған абзал. Термостатта температура 30…400С-да болу керек. Бейтараптандыру процесін pH арқылы бақылайды.
3.3. Бейтараптандыруды аммиак суымен де (25% NH4OH) істеуге болады. Бұл жағдайда жоғары концентрациялық (30-40% P2O5) алу керек. Фосфор қышқылын бейтараптандыруды 20-30 минут уақыт ішінде 30-400С- те жүргізеді. Аммиак суын тамшылатып бөлу үренкесі арқылы жіберу керек.
Осы үш әдістің қайсысымен болсын алынған қоймалжың ерітіндіні фарфор тарелкесіне салып кептіреді. Кептіргенде әлісін - әлсін шыны таяқшамен араластырып тұру керек. Кептіру 60-700С температурада кептіру шкафында орындалады. Кептіру уақытын белгілеуі керек. Кептірілген аммофосты өлшейді де, ылғылдығына, азотқа және сіңірімділік P2O5 – ке талдау жасайды. Табылған керекті заттарды (P2O5, N) оның қосындысын құрғақ түріне есептеу керек. Алынған нәтижелердің сандарын стандарт көрсеткіштерімен салыстырады.
Талдаулардың орындалу әдістемесі
(МЕСТ 20851-75, МЕСТ 20851.3-93, МЕСТ 20851.4-75)
Аммофостың ылғалдығын анықтау
Өнімнің 5 г (g1) 0,001г. дәлдікке дейін өлшеп алып, бюкске салып кептіру шкафында 600С температурада тұрақты салмағына дейін ұстау керек. Шкафтан соң аммофосты эксикаторда суытып, өлшейді (g2). Оның ылғалдығын мына формуламен анықтайды:
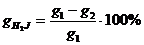
Сіңірімділік түріндегі P2O5- ті анықтау
1 г. өнімді 0,001г дәлдікке дейін өлшеп 500 см3 көлемдегі колбаға салады. Оған 150см3 0,2м трилон Б ерітіндісін (93+30С қыздырылған) құйып, 15 минуттай шайқағыш аппаратта шайқайды. Сонан соң колбаның көлемін 500 см3 дейін сумен жеткізеді. Оны сүзіп бірінші бөлігін төгіп тастап, 1 мл аликвотты пипеткамен алып 100 мл көлемдегі колбаға салады. Оған 2 мл концентрлік тұз қышқылын, 10 мл су құйып ақырын 5-10 минут қайнатады. Оны суытады да 20 мл су және 25 мл «Г» ерітіндісін құяды. Одан кейін көлемін 100 мл дейін сумен жеткізіп, оны светофильтр №4 пен фотоколориметрде оптикалық тығыздығын анықтайды. Анықтау салыстырушы ерітінді арқылы орындалады. Оптикалық тығыздықтың мөлшерімен калибрленген график арқылы оған сәйкес P2O5 – тің массасын табады. Оның массалық үлесі, %:
Р2О5 = а × 250 × 100 / д × 1000, %
бұл жерде а - P2O5 – тің графикпен табылған массасы, мг.
g - өнімнің талдауға алынған нақты мөлшері, г.
Формалин әдісімен азотты анықтау
Формалин аммиакпен әрекеттесіп чексаметилентетрамин (уротрапин) [N4(CH2)6] құрайды. Бұл реакция сұйытылған аммоний тұздарының ерітіндісінде эквивалентік мөлшерде фосфор қышқылын бөледі. Бөлінген фосфор қышқылын фенолфталейн индикаторы арқылы натрий сілтісінің ерітіндісімен титрлейді.
4NH4H2PO4 + 6CH2O = N4(CH2)6 + 4H3PO4 + 6H2O (6)
5 г аммофостың шақты мөлшерін (0,001 г дейін дәлдікпен өлшенген) 500 см3 көлемдегі колбаға салып, оған 400 см3 су құяды. Колбаны тығындап 30 минут шайқайды. Сонан соң көлемін 500 см3 дейін сумен толтырады да сүзеді. Аликвоттан 50 мл алып 250мл конустық колбаға салып, оған 2-3 тамшы фенолфталейн тамызады. Егерде ерітінді түссіз түрге айналса, 0,1 м NaOH ерітіндісімен қызғылт түріне дейін бейтараптандырады. Сонан соң 10-15 мл фенофталейнмен бейтараптандырылған формалин ерітіндісін құйып, 0,1 M NaOH ерітіндісімен жұтаң қызғылт түріне дейін титрлейді.
Азоттың мөлшер үлесі, %.
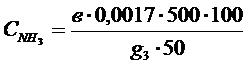 немесе
немесе 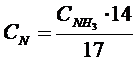
бұл жерде: в – 0,1 м NaOH ерітіндісінің титрлегенде кеткен көлемі, мл.
g3 – өнімнің талдауға алынған шақты мөлшері, г.
0,0017 – аммиактың 1 мл 0,1 м ерітіндіге сәйкес массасы.
Нәтижелерді өңдеу
Тәжірибе бойынша анықталған P2O5 бен N мөлшерлерін ылғалсыз өнімге есептеледі. Керекті заттардың суммасын табады да, оны стандартты көрсеткіштермен салыстырады.
Тәжірибенің нәтижелерін төмендегі кестеге түсіреді.
1-Кесте-Тәжірибенің нәтижелері мен жағдайлары
| Жағдайы | нәтижелері | ||||||||||
| CH3PO4 P2O5 % | t бастапқы оС | бастапқы уақыты мин. | pH | NH3 көлемі VNH3 | toC | 
| 
| CN | Cp2O5 | CN/ Cp2O5 | m |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
Бақылау сұрақтары
1 Аммофостың сапасын қандай көрсеткіштермен анықтайды?
2 Аммофостың құрамына нендей қосылыстар кіреді?
3 Аммофостың кептіру температурасын дәлелдеңіз.
4 Жұмыстың орындалу тәртібін айтыңыз.
5 Аммофостағы P2O5 – пен N табу әдісін айтыңыз.
Тапсырма: Соңғы өнім немесе негізгі компонентер бойынша есептеп аммофос алу.
№ 13 ЗЕРТХАНАЛЫҚ ЖҰМЫС
АММОНИЙ НИТРАТЫН (АММИАК СЕЛИТРАСЫН) ӨНДІРУ ТЕХНОЛОГИЯСЫ (4 сағат)
Жұмыс мақсаты мен міндеті: азот қышқылын аммиакпен бейтараптау арқылы аммоний нитраты өндіру
Қысқаша теориялық бөлім
Аммоний нитраты – ауыл шаруашылығында көп мөлшерде пайдаланылатын азот құрамдас тыңайтқыштардың бірі.
Оны өндіру тәсілі азот қышқылын аммиакпен бейтараптау реакциясына негізделген:
NH3+HNO3=NH4NO3 (1)
Сұйық азот қышқылын (47-54%) бейтараптаудан алынған ертіндіні буландыру арқылы суық балқыма алынады, оны түйіршіктеу арқылы тауар өндіріледі.
Азот қышқылын бейтараптау кезінде көп мөлшерде жылу бөлінеді. Сондықтан экспериментті жүргізгенде қауіпсіздікті сақтау керек, немесе азот қышқылында алдын ала NH4NO3 бір шамасын ерітеді де, қалған бос азот қышқылын аммиакпен бейтераптайды.
Қондырғылар мен техникалық құралдар
Кептіргіш шкаф
Химиялық ыдыстар
Аналитикалық және техникалық таразы
Титрлеуге қажеттті бюретка
4 Жұмысты орындау әдісі
Реакторға берілетін аммоний нитратының мөлшерін есептеу. Мысалы, экспериментке 100г 10%-тін азаот қышқылы алынады. Құрамында 40% NH4NO3 бар ертінді алу үшін, қышқылға Хг аммоний нитраты керек.
x*100/(100+x)=40%
100x=40*100+40*x
x=4000/60=66.67г
Барлығы 100+66,67=166,67г ерітінді пайда болады.
Ертінді құрамы: HNO3 =100*10/1667.67=6% (10г)
Н2О= 100*90/166,67=5% (90г)
NH4NO3=100*40/166,67= 40% (66,67)
___________________________________
Барлығы 100% 1667.67г
Бейтараптауға керек аммиакты реакция (1) бойынша есептейді:
HNO3 NН3
63 17
10 х х=2,698~2,7г 100% NН3
Экспериментте 25%-тік аммиак ертіндісін пайдаланса, онда 2,7/0,25=10,8г
Эксперимент кезінде аммиак толық реакцияға түспеуі мүмкін (аммиактың біразы ұшуы мүмкін). Сондықтан алынатын аммоний нитраты теориялық жолмен есептеуге болады.
Бастапқы 166,67г ертіндіні бейтараптау кезінде алынатын аммоний нитраты: 66,67+10*80/63=79,368г
80,63- NH4NO3, HNO3 молекулалық массалары.
Эксперимент кезінде А г - NH4NO3 (сусыз) алынса, онда аммоний нитратының шығымы
Х=А*100/79,368, %
Эксперимент кезінде келесі параметрлерді анықтайды:
-аммиактың жєне азот қышқылының шоғырын жєне шығынын;
-алынған өнімдегі азот жєне аммиак құрамын.
Өнімдегі аммиак бойынша, аммоний нитраты құрамын анықтайды.
Жұмыс істеу тәртібі және алынған нәтижелерді өңдеу
Аммиакты анықтау
Аммиактың жалын құрамын 3 тәсілмен анықтайды.
1. Ертіндідегі амиактың күшті негізді қосу және қыздыру арқылы айдау;
2. Ертіндіге күшті негізді стехиометрияда артық мөлшерде қосады да, артығын кері титрлеу және қыздыру арқылы айдау;
3. Байланыстағы аммиакты формальдегидті тәсілмен анықтау (күйдіргіш натр ертіндісімен формасын қатысуында титрлеу)
Талдау жүргізетін бөлмедегі ауада аммиак болмау керек.
Тікелей титрлеу арқылы анықтау
Ертіндіні метилоранж қатысуымен қышқылмен титрлейді. Бос және жартылай байланыстағы аммиак қышқылмен бейтерапталады:
NH4ОН+HCI=NH4CI+H2O
NH4HCO3+HCI=NH4CI+CO2+H2O
(NH4)CO3+2HCI=2NH4CI+H2O+CO2
Талдау жолы: Аналитикалық таразыда өнімнің 0,5-2,0г мөлшерін дәлдігі 0,0002г алады, оны өлшемді колбаға салады, суда ерітеді, жақсы араластырады, колбаға белгіге дейін су құяды.Даярланған ертіндіден 10-15 мл өлшемді көлемі 250мл конусты колбаға құяды, 40-50мл тазаланған су және 2-3 тамшы индикатор метилоранж қосады. Ертіндіні 0,1 немесе 1,0 НСІ қышқылмен титрлейді (түсі сарыдан қызғылтқа өткенше)
Бос және жартылай байланысқан аммиак
QNH3=(а-в)*0,017*V*100/g*а, %
V-титрлеуге кеткен қышқыл көлемі, мл;
0,017-1мл НСІ ертіндісіне эквивалентті NH3 массасы,г.
N-қышқылдың нормальдігі
g-зерттелетін заттың нақты мөлшері ,г
Жалпы аммиакты кері титрлеу арқылы анықтау.
Ертінді үлгісін (нақты өлшемін) алдын ала тікедей титрлеу арқылы (мысалы NaOH ертіндісімен) барлық аммиакты бос түріне айналдырады:
NH4CІ+NaOH=NaCІ+NH4OH
(NH4)2SO4+2NaOH=Na2SO4+2NH4OH
Аммиакты қыздыру арқылы толық айдағаннан қалған ертіндідегі артық NаОН қышқылмен титрленеді (1н НСІ), метил-оранж индикаторы
G NH3= (50-V)*0.017*1000/10,немесе % NH3 =(а-в)*0,017* V*100/g*A
V-титрлеуге кеткен 1н НСІ көлемі,г
0,017-1мл 1н НСІ эквивалентті NH3
N-қышқыл нормальдігі
g-зерттелетін заттың нақты мөлшері,г
A-анализге алынған ертінді мөлшері,мл;
b-титрлеуге кеткен NaOH көлемі, мл;
a-аммиакты ұстауға кеткен Н2SO4 (0,1н) ертінді көлемі,мл;
Формальдегидтік тәсіл
Құрамында аммоний тұздары (NH4CI, (NH4)2SO4 т.б ) бар бейтарап ертіндіге формалин қосылады. Реакция кезінде гексаматилентетрамин (уротропин) және бос қышқыл түзіледі:
4NH4CI +6СН2О= (СН2)6N4+4НСІ+6Н2О
Бөлінген қышқылды негізбен титрлейді (индикатор-фенолфталейн).
Қышқыл мөлшері ертіндідегі аммиак мөлшерін эквивалентті.
Реактивтер:
Формалин, 40%-тік
Күйдіргіш натр, 1н, 0,1н,
Тұз қышқылы, 1н
Фенолфталин-индикатор, 1%-тік спирттеі ертінді
Метилоранж- индикаторы, 0,1%-тік
Талдау жолы:
Тікелей титрді анықталған ертіндіні қайнату арқылы СО2 газынан тазалайды, салқындатады, 5-10мл 40%-тік формалин ертіндісін (күйдіргіш натр ертіндісінде фенолфталин арқылы бейтерапталған) және 2-3 тамшы фенолфталин қосады. 2-3 минуттан кейін 1н NaOH ертіндісімен түсі қызыл- қоңырға өзгергенге дейін титрлейді.
Аммиак құрамы :
NH3(ж)=(V*К*Н/5)*20н.б. немесе % NH3=(а-в)*0,017* V*100/g*А
V -титрлеуге кеткен көлемі 0,1н NaOH көлемі,мл;
К -NaOH ертіндісінің нормальдігін түзету коэффиценті;
Н -0,1н NaOH ертіндісінің нормальдігі
g-зерттелетін заттың нақты мөлшері,г
A-анализге алынған ертінді мөлшері,мл;
0,017-1мл 1н НСІ эквивалентті NH3
Азотты анықтау
(формальдегидтік тәсіл)
Ертіндідегі азотпен формалин реакцияға түскенде гексаметилентетрамин N4(CH2)6 түзіледі, бос қышқыл пайда болады:
4NH4NO3+6 CH2O=N4(CH2)6+4HNO3+6H2O
Ертіндіде кальций, магний бар болса, алдын ала фенолфталеин қатысуында тирлеу керек.
Талдау жолы
Өнімнің 5г (3) өлшемін дәлдігі 0,001г дейін алады, оны өлшемді 500мл колбаға (негізгі ертінді) салады, 400мл су құяды, 30мин аппаратта араластырады.
Колбадағы сұйыққа белгіге дейін су қосады, араластырады және ақ лента-сүзгі арқылы сүзеді, фильтраттың алғашқы порцияларын төгеді. Конусты колбаға (250мл) 15 мл формалин, 100мл су және 2-3 тамшы фенолфталеин құяды, 0,1н NaOH ертіндісімен қызғылт түске дейін бейтараптайды. Бейтарапталған ертіндіге 25-50мл негізгі ертіндінің аликвотасын қосады, жақсы араластырады. 2-3 мин тыныштыққа қояды, кейін 0,1н NaOH ертіндісімен әлсіз қызғылт түске дейін титрлейді.
Азот құрамы:
CN=V*0.014*500*100/g3*50
V -титрлеуге кеткен 0,1н NaOH көлемі,мл;
g3-анализге алынған өнім мөлшері, г;
0,014-1мл 0,1н NaOH сәйкес азот массасы.
Жұмыс қорытындысын төмендегі кестеге толтырады
| Жағдай | Қорытынды | ||||||
| t, мин | T,0C | HNO3,% | V(NH3) | N,% | NH3,% | NH4NO3,% | C(H2O) ,% |
Бақылау сұрақтары
1.Аммоний нитратын өндіруге керек шикізаттар сипаттамасы
2.Бейтараптау процесіне әртүрлі факторлардың әсері
(уақыт, температура, аммиак пен азот қышқылы шығыны)
3.Өнім алуға әртүрлі фаторлар әсері
4.Эксперимент жүргізу тәсілі
5.Химиялық анализ тәсілі
Тапсырма. Аммоний селитрасын берілген мөлшерде алу. өнімді талдау. Процесс қорытындысын жасау.
ХИМИЯЛЫҚ ЛАБОРАТОРИЯДАҒЫ ТЕХНИКА ҚАУІПСІЗДІГІ.
1.Қышқылдарды, сілтілерді және басқа сілтілі сұйықтарды пипеткамен ауызбен соруға қатаң тиым салынады. Қышқылдар мен сілтілерді тек қана сорғышпен груша алу қажет.
2.Барлық құрғақ реактивтерді, әсіресе күйдіргіш сілтілерді фарфор қасықтар немесе шпательмен алу қажет.Күйдіргіш сілтілерді қолмен ұстауға қатаң тиым салынады.
3.Ішінде бром,сутек пероксиді, плавик қышқылы және басқа күйдіргіш сұйықтары бар ыдыстарды ашқанда, ыдыстың аузы ашып жатқан адамға бағытталмауы тиіс.
4.Қышқылдар мен сілтілер және басқа улы уландырғыш заттармен тек қана желдеткіші қосылған сорғыш шкафтың ішінде жұмыс істеу қажет.
5.Раквинаға сумен араласпайтын сұйықтарды және қатты заттарды, сонымен қатар күшті уларды тастауға қатаң тиым салынады.
6.Белгісіз және аты күмән келтіретін реактивтерді пайдалануға қатаң тиым салынады.
7.Қосулы тұрған электр құралдарының жанында өрттен қауіпті заттармен жұмыс істеу.
8.Ыстық сұйығы бар ыдыстарды тек қана екі қолмен ұстау қажет: бір қолмен ыдыстың мойынан, ал екінші қолмен ыдыстың түбі.
9.Сынған ыдысты сыпырғы және күрек көмегімен жинайды, қолмен жинауға болмайды.
10.Қышқылдармен, сілтілермен және басқа күйдіргіш заттармен күйіп қалған жағдайда:
11.Зақымданған жерді судың көп мөлшерімен жуып, содан соң қышқылмен күйгенде - 10 % -к сода ертіндісімен; сілтілермен күйгенде -3 - 4%-к сірке қышқылының немесе 3 % - к бор қышқылының ертіндісімен шаяды.
12.Күйген жер қызарған жағдайда, 2 % -к марганец ертіндісімен шаяды;
13. Қиын жағдайларда алғашқы көмек көрсеткеннен кейін дәрігерге қаралу қажет.
14.Шынымен жарақаттанумен бірге қышқылдар мен сілтілер әсер етсе, ең алдымен жарақаттанған жерді судың көп мөлшерімен шаю қажет және жарақаттанған жерді шыны қалдықтарының қалмағанына көз жеткізіп, содан соң айналасын иод ертіндісімен өңдеп таңып тастау қажет. Күкірт қышқылы теріге төгілген, жағдайда, оны судың көп мөлшерімен шайып, кейін соданың әлсіз ертіндіісімен бейтараптандырады және калии пермангат ертіндісіне салынып алынған матамен таңып, дәрігерге көрсетеді.
15.Егер қышқыл төгілсе: қышқылды сумен сұйылтып, содан соң оны мен бейтараптандырады және күрекпен алып тастайды. Егер төгілсе,онда сумен сұйылтып, содан кейін оның үстіне құм төгіп немесе сумен шайып тастау керек, содан соң барып содамен бейтараптандырады.
16.Егер төгілген сілті болса, онда оны сумен шайып, кейін әлсіз қышқылмен сірке, бор бейтараптандырады.
17.Ыдыстарды хром қоспасымен жуғанда, хром қоспасын алған ыдысқа қайтып жинайды, хром қоспасын раквинаға төгуге болмайды.
18.Лабораторияда жұмыс істеп болған соң, сіз қолыңызды жуып және аузыңызды шаюыңыз қажет.
Әдебиеттер
1. М.Е.Позин. Технология минеральных удобрений и солей. М.: Химия, 1957.с. 277
2. 2.И.М.Кольтгоф, Е.Б.Сендэл, Количественный анализ
3. Справочник основной химической промышленности, стр.498- 499, Берль-Лунге
1. Позин М.Е. Технология минеральных удобрений – Л.Химия, 1974,с.376.
2. Дохалова А.Н.,Кармышев В.Ф., Производство и применениеаммофоса – М:Химия, 1977.с.240.
3. Постников Н.Н. Термическая фосфорная кислота, соли и удобрения на ее основе – М:Химия, 1976
4. КопыловВ.А., ЗавертяеваТ.И. АндрейченкоА.М. Производство двойного суперфосфата. – М:Химия., 1976
5. Шапкин М.А.,ЗавертяеваТ.И.,Зинюк Р.Ю. Двойной суперфосфат. Технология и применение – Л:Химия, 1987.
6. СоколовскийА.А.,Яшнее.В.Технология минеральных удобренийи кислот.-М:Химия, 1971.
7. Крашенниников С.А. Технология соды. М:Химия, 1988
8. Шокин И.Н., Крашенниников С.А., Технология соды. М:Химия, 1975
9. Зайцев И.Д., ТкачГ.А. Производство соды. М:Химия, 1986
10. Мойжес И.В. руководство по анализу в производстве фосфора, фосфорной кислоты и удобрений. Л:Химия, 1973.
11. Методы анализа фосфатного сырья, фосфорных и комплексных удобрений – Л?Химия, 1975.
12. Позин М.Е. руководство к практическим занятиям неорганических веществ. Л:Химия 1980.
13. Лапкина е.Д., Горобец Л.И. Сборник унифицированных методов анализа сырья, побочных продуктов и технологических отходов в производстве фосфора. - Чимкент, 1978.
14. Кельман Ф.Н. Методы анализа при контроле производства серной кислоты и фосфорных удобрений. –М:Химия., 1963
15. Атрощенко В.И., Каргин С.И. Технология азотной кислоты –МХимия,1970
16. Амелин А.Г. Технология серной кислоты – М:Химия, 1983
17. Воскресенский П.И. Техника лабораторных работ – М:Химия, 1973
18.Г.М. Гильманова, Г.П. Попова, Л.И. Миркина, Е.С. Бугенов, А.С. Сейтмагзимов Методические указания к выполнению лабораторных работ по технологии неорганических веществ для студентов специальности 25.02-Шымкент: КазХТИ, 1990, 55с.
19.Г.М.Гильманова,Г.П.Попова Методические указания к выполнению лабораторных работ по технологии отраслевого производства для студентов специальности 07.04-Шымкент. КазХТИ,1999
20.Методы анализа фосфатного сырья, фосфатных и комплексных удобрений-Л: Химия,1975
.
Жұлдызбаева С.Е.,Бестереков Ү.Б., Тлеуова С.Т., Қадырбаева А.А.
«Бейорганикалық заттардың химиялық технологиясы»
пәнінен зертханалық жұмыстар орындауға арналған
ЛАБОРАТОРИЯЛЫҚ ПРАКТИКУМ
Шығаруға жіберілді, 2012 ж.
Қағаз форматы, офсетті баспа А4 1/16
Типография қағазы. Көлемі 2,4 б.б.қ.
Тираж 20 дана. Тапсырыс №
©М.Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университеті, 2015ж.
М.Әуезов атындағы Оңтүстік Қазақстан мемлекеттік университетінің шығарым баспасы, Шымкент қ., Тауке хан даңғылы, 5
 |
Жұлдызбаева С.Е., Бестереков У.Б., Тлеуова С.Т., Кадирбаева А.А.

ЛАБОРАТОРИЯЛЫҚ ПРАКТИКУМ
«Бейорганикалық заттардың химиясы мен технологиясы»
пәні бойынша зертханалық жұмыстар орындауға арналған

Шымкент, 2015 г
 |
Дата добавления: 2018-04-04; просмотров: 2884; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

