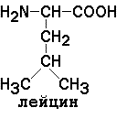
Неполярные (гидрофобные) аминокислоты

| 
| 
|
| 
| 
|
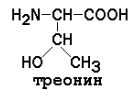
Полярные (гидрофильные) аминокислоты

| 
| 
|

| 
| 
|
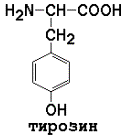
Ароматические (в основном неполярные) аминокислоты

| 
| 
|
Отрицательно заряженные аминокислоты

| 
|
Положительно заряженные аминокислоты

| 
| 
|
В некоторых белках содержатся специфические производные аминокислот. В коллагене (белке соединительной ткани) обнаружены оксипролин и оксилизин. Основой структуры гормонов щитовидной железы является дийодтирозин – производное тирозина.


Общим свойством аминокислот является амфотерность (от греч amphoteros - двусторонний). В интервале рН 4,0-9,0 почти все аминокислоты существуют в форме биполяных ионов (цвиттерионов). Значение изоэлектрической точки аминокислоты (ИЭТ, рI) рассчитывается по формуле:
 .
.
рI для моноаминодикарбоновых кислот рассчитывается как полусумма значений рK (таблица 1) a- и w-карбоксильных групп, для диаминомонокарбоновых кислот – как полусумма значений рK a- и w-аминогрупп.
Существуют заменимые аминокислоты, которые могут быть синтезированы в организме человека, и незаменимые, которые в организме не образуются и должны поступать в составе пищи.
Незаменимые аминокислоты: валин, треонин, лейцин, лизин, метионин, триптофан, изолейцин, фенилаланин.
Заменимые аминокислоты: глицин, аланин, аспартат, аспарагин, глутамат, глутамин, серин, пролин.
Условно заменимые аминокислоты (могут синтезироваться в организме из других аминокислот): аргинин (из цитруллина), цистеин (из серина), тирозин (из фенилаланина), гистидин (при участии глутамина).
|
|
|
Относительное содержание различных аминокислот в белках неодинаково.
Для обнаружения аминокислот в биологических объектах и их количественного определения используют реакцию с нингидрином.
Таблица 1. Константы диссоциации аминокислот
| Аминокислота | pK1 | pK2 | pK3 |
| Алании | 2,34 | 9,69 | |
| Аргинин | 2,18 | 9,09 | 13,2 |
| Аспарагин | 2,02 | 8,80 | |
| Аспарагиновая кислота | 1,88 | 3,65 | 9,60 |
| Валии | 2,32 | 9,62 | |
| Гистидин | 1,78 | 5,97 | 8,97 |
| Глицин | 2,34 | 9,60 | |
| Глутамин | 2,17 | 9,13 | |
| Глутаминовая кислота | 2,19 | 4,25 | 9,67 |
| Изолейцин | 2,26 | 9,62 | |
| Лейцин | 2,36 | 9,60 | |
| Лизин | 2,20 | 8,90 | 10,28 |
| Метионин | 2,28 | 9,21 | |
| Пролин | 1,99 | 10,60 | |
| Серии | 2,21 | 9,15 | |
| Тирозин | 2,20 | 9,11 | 10,07 |
| Треонин | 2,15 | 9,12 | |
| Триптофан | 2,38 | 9,39 | |
| Фенилаланин | 1,83 | 9,13 | |
| Цистеин | 1,71 | 8,33 | 10,78 |
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Существуют 4 основных уровня структурной организации белковых молекул.
Первичная структура белка – последовательность расположения остатков аминокислот в полипептидной цепи. Отдельные аминокислоты в белковой молекуле связаны друг с другом пептидными связями, образующимися при взаимодействии a-карбоксильных и a-аминогрупп аминокислот:
|
|
|
 .
.
В настоящее временя расшифрована первичная структура десятков тысяч различных белков. Первым этапом определения первичной структуры белка является установление аминокислотного состава методами гидролиза. Затем определяют химическую природу концевых аминокислот. Следующий этап - определение последовательности аминокислот в полипептидной цепи, для чего применяют частичный избирательный (ферментативный либо химический) гидролиз.
Дата добавления: 2018-04-05; просмотров: 598; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
