Физические и химические свойства
Все дикарбоновые кислоты представляют собой твердые кристаллические вещества, растворимые в воде.
Двухосновные карбоновые кислоты более сильные, чем одноосновные с тем же числом атомов углерода. Кислотность двухосновных кислот тем выше, чем короче цепь атомов углерода, связывающих карбоксильные группы. В соответствии с этим щавелевая кислота – самая сильная из двухосновных кислот.
Двухосновные кислоты вступают в те же реакции, которые свойственны и одноосновным кислотам. Обладая двумя карбоксильными группами, двухосновные кислоты дают два ряда производных, в образовании которых участвуют один карбоксил
или два карбоксила. Например:

Кроме того существуют реакции характерные только для двухосновных кислот.
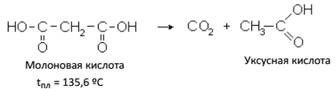
1. Разложение с выделением из одного карбоксила СО2 и превращением в одноосновную кислоту. Для такого разложения достаточно нагревания выше t плавления.
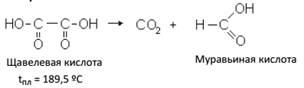
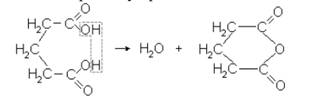
2. Образование из дикарбоновых кислот их циклических производных. При нагревании янтарной кислоты происходит выделение одной молекулы воды и образование ангидрида янтарной кислоты, имеющего строение пятичленного кольца (цикла):

При нагревании следующего гомолога янтарной кислоты – глутаровой кислоты – также образуется ангидрид циклического строения, кольцо ангидрида глутаровой кислоты имеет шесть атомов:
Аналогично двухосновная ароматическая фталевая кислота очень легко теряет воду и превращается в ангидрид фталевой кислоты или фталевый ангидрид:
|
|
|

Отдельные представители (щавелевая кислота, молоновая кислота, янтарная кислота, адипиновая кислота, фталевая кислота, терефталевая кислота)
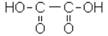 Щавелевая кислота встречается в виде солей во многих растениях, например в щавеле и кислице. Она кристаллизуется из воды в виде дигидрата (СOOH)2 ·2H2O с tплав. = 101,5 ºС. Кристаллизационная вода удаляется медленной сушкой при 110–120 ºС. Безводная кислота плавится при 189 ºС.
Щавелевая кислота встречается в виде солей во многих растениях, например в щавеле и кислице. Она кристаллизуется из воды в виде дигидрата (СOOH)2 ·2H2O с tплав. = 101,5 ºС. Кристаллизационная вода удаляется медленной сушкой при 110–120 ºС. Безводная кислота плавится при 189 ºС.
Щавелевая кислота способна окисляться до СО2 и воды:
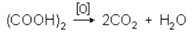
На этом основано ее применение в качестве восстановителя и для установления титра марганцовокалиевой соли. При нагревании выше температуры плавления, в присутствии концентрированной H2SO4 происходит разложение щавелевой кислоты:
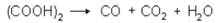
В технике щавелевую кислоту получают:
1) окислением древесных опилок кислородом воздуха при нагревании их с расплавленным едким калием или смесью едких калия и натрия;
2) при быстром нагревании до 400 ºС калиевой или натриевой соли муравьиной кислоты:
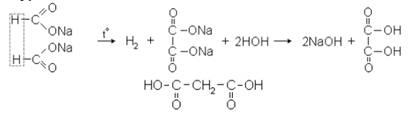
Молоновая кислота – кристаллическое вещество с tпл. = 135,6 ºС.
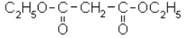
Диэтиловый эфир молоновой кислоты, называемый обычно молоновым эфиром обладает высокой химической активностью и способен к ряду интересных химических превращений. Молоновый эфир представляет собой жидкость с приятным фруктовым запахом. Он применяется при ряде синтезов лекарственных веществ, например при получении барбитала.
|
|
|
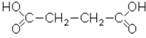 Янтарная кислота, этандикарбоновая кислота или бутандионовая кислота содержится в янтаре, в буром угле, во многих растениях, особенно много ее в недозрелых фруктах.
Янтарная кислота, этандикарбоновая кислота или бутандионовая кислота содержится в янтаре, в буром угле, во многих растениях, особенно много ее в недозрелых фруктах.
Янтарная кислота – твердое кристаллическое вещество с tпл = 182,8 ºС. В технике получается гидрированием малеиновой кислоты и из природной смолы – янтаря путем сухой перегонки.
Янтарную кислоту можно применять в реакциях поликонденсации с гликолями; некоторые эфиры янтарной кислоты служат пластификаторами.
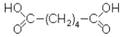 Адипиновую кислоту – белое кристалическое вещество с tпл = 153 ºС в больших количествах приготовляют окислением азотной кислотой циклогексанола. Используют для производства волокон – капрона и найлона.
Адипиновую кислоту – белое кристалическое вещество с tпл = 153 ºС в больших количествах приготовляют окислением азотной кислотой циклогексанола. Используют для производства волокон – капрона и найлона.
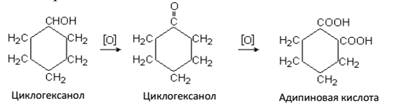
Фталевые кислоты
При окислении ароматических углеводородов, содержащих в молекуле две боковые цепи, в зависимости от расположения боковых цепей могут быть получены три изомерные дикарбоновые кислоты, называемые фталевыми:
|
|
|
Фталевая кислота – кристаллическое вещество, tпл = 206 –208ºС (с разложением), растворима в горячей воде. Ее получают окислением нафталина. Практически сразу получается фталевый ангидрид.
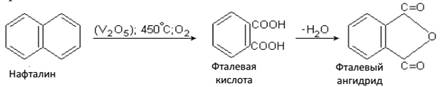
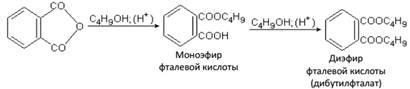
Широкое применение в качестве пластификаторов для пластических масс нашел диэфир фталевой кислоты дибутилфталат, его получают:
При взаимодействии с аммиаком фталевый ангидрид образует имид фталевой кислоты – фталимид:

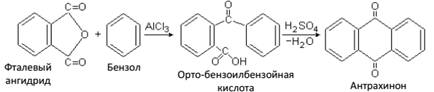
Фталимид – твердое вещество, служит исходным веществом для технического синтеза ценного красителя индиго и ряда других соединений. При конденсации фталевого ангидрида с бензолом в присустствии хлористого алюминия получается антрахинон, широко применяемый в производстве красителей (промышленный способ).
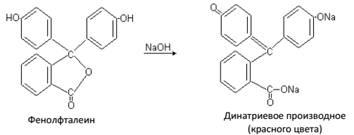
Фталеины – продукты конденсации фталевого ангидрида с фенолами. Важным представителем группы фталеинов является фенолфталеин – индикатор широко применяемый в аналитической химии:

Фенолфталеин – белое кристаллическое вещество, хорошо растворимое в спирте. Под действием щелочей фенолфталеин переходит в соль ярко-малинового цвета:
Терефталевая, или n-фенилкарбоновая, кислота (изомер фталевой кислоты) применяется в большом количестве для синтеза ценного волокна – лавсан (терилен).
|
|
|
Лавсан – полиэфир, получаемый конденсацией терефталевой кислоты и этиленгликоля:

Дата добавления: 2018-04-05; просмотров: 900; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
