Бифидобактерии, молочнокислые бактерии, непатогенные штаммы кишечной палочки как основа нормофлоров. Механизм положительного влияния пробиотиков
Методы извлечения внутриклеточных продуктов. Разрушение клеточной стенки биообъектов и экстрагирование целевых продуктов.
Выделение продуктов биосинтеза
Общая схема этой стадии технологического процесса представлена на рис. 12. Если продукт локализован внутри клеток, их разрушают, удаляют клеточные осколки и выделяют продукты из осветленной среды; секретируемый продукт выделяют непосредственно из среды.
Для отделения биомассы клеток или культуралъной жидкости используют сепараторы, осадительные центрифуги, фильтр-прессы, вакуум-барабанные фильтры, ротационно-вакуумные фильтры, отстойники. Выбор оборудования зависит от масштаба культивирования, типа клеток, свойств культуральной жидкости.
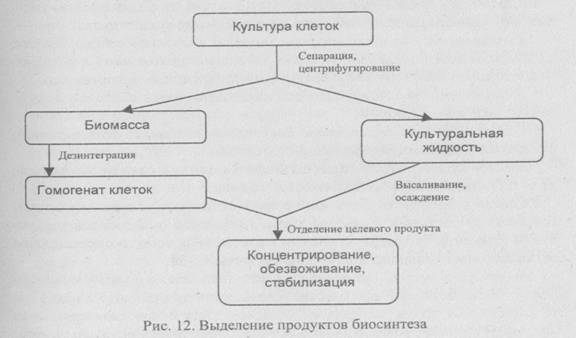
Для выделения клеток из больших объемов культуральной среды (в промышленных масштабах) используют высокоскоростное центрифугирование с помощью соответствующих центрифуг полунепрерывного действия. Суспензию клеток непрерывно подают в барабан центрифуги, клетки концентрируются в нем, осветленная жидкость удаляется. Когда барабан заполняется осажденными клетками, центрифугу останавливают и клетки собирают. Неудобство этого способа - необходимость остановки процесса, вероятность утечки микроорганизмов в окружающую среду, невозможность полного удаления клеток из среды.
Альтернативный метод выделения клеток из культуральной среды — фильтрация через мембрану. Но процесс фильтрации быстро замедляется за счет накопления клеток на поверхности фильтра. Увеличение давления фильтруемой среды дает временный эффект, так как клетки забивают поры, образуя менее проницаемый слой.
|
|
|
Разрушение (дезинтеграция) клеток. Для этой цели применяют разнообразные химические, биологические, физические методы. Все процедуры должны быть одновременно достаточно жесткими, чтобы разрушить клеточную стенку, и достаточно мягкими для исключения денатурации белка (изменения структуры конечного продукта).
Клеточные стенки микроорганизмов состоят из разных полимеров, поэтому универсального метода их разрушения не существует.
У грамположителъных микроорганизмов клеточная стенка состоит из толстого пептидогликанового слоя N-ацетилглюкозамина и остатков N-ацетилмурамовой кислоты, соединенных пептидными мостиками.
У грамотрицателъных бактерий клеточная стенка тоньше и покрыта снаружи слоем липидов.
Стенка дрожжевых клеток состоит из плотного слоя частично фосфорилированных маннатов и Р-глюканов.
Низшие грибы имеют многослойные клеточные стенки, состоящие из а- и Р-глюканов, гликопротеидов и хитина.
|
|
|
Состав и прочность клеточной стенки зависят от условий культивирования, скорости роста клеток, фазы, на которой они собираются, условий хранения сконцентрированных клеток и от того, экспрессировал ли выделенный микроорганизм клонированный ген.
Химический метод разрушения клеточных стенок - обработка щелочью. Если белковый продукт не разрушается при рН от 10,5 до 12,5, то можно без труда лизировать большие количества бактериальных клеток. Например, рекомбинантный гормон роста человека очень просто выделить из клеток Е. соli обработкой натрия гидрокарбонатом при рН 11. После обработки щелочью не остается практически ни одной жизнеспособной клетки, что автоматически решает проблему утечки рекомбинантных микроорганизмов.
Основной биохимический метод разрушения клеток микроорганизмов - лизис с помощью ферментов. Так, лизоцим яичного белка легко гидролизует клеточные стенки грамположительных бактерий. Для разрушения клеток грамотрицательных бактерий используют лизоцим и ЭДТА. Клеточные стенки дрожжей и плесневых грибов гидролизуют одним или несколькими ферментами: фосфоманназой, [B-1,3- и B-1,6-глюканазой, хитиназой - или комплексным дрожжелитическим препаратом. Ферментативная обработка высокоспецифична, а лизис происходит в мягких условиях.
|
|
|
Клетки можно разрушать физическими методами: немеханическими (осмотическим шоком или быстрым многократным замораживанием-оттаиванием), механическими (обработкой УЗ, соударением, гомогенизацией под давлением). Механическое разрушение высокоэффективно, особенно УЗ-излучателями, генерирующими высокочастотные звуковые волны. УЗ-дезинтеграторы состоят из транзисторного генератора УЗ-волн, пьезоэлектрического или магнитострикционного преобразователя, набора рабочих камер (аппарат на основе УЗ-диспергатора
УЗДН-1, Россия).
При большом количестве клеток используют баллистическую дезинтеграцию, ее проводят в высокоскоростных шаровых мельницах, куда помещают концентрированную суспензию клеток. Камера мельницы заполнена инертным абразивным материалом (стеклянными, полимерными шариками диаметром 1 мм). Содержимое быстро перемешивают лопасти, насаженные на ось. Большинство клеток разрушаются под действием сдвиговых напряжений, возникающих в результате быстрого движения шариков относительно друг друга, поверхности лопастей и камеры. Условия оптимального разрушения клеток подбирают, варьируя числом и формой лопастей, скоростью перемешивания, числом и размером шариков, геометрией камеры, температурой, концентрацией клеток (аппараты фирмы «Willi A.. Васhhоtеm», Швейцария,(
|
|
|
Gifford Wood Со», США).
Соударение - клеточную суспензию большой вязкости направляют под давлением на неподвижную поверхность, в месте соприкосновения выделяется большое количество энергии, разрушающей клетки. Активность клеточных белков при разрушении клеток методом соударения уменьшается незначительно.
Экструзионные методы (продавливание суспензии клеток через капиллярные отверстия) предназначены для обработки жидких или замороженных суспензий клеток. Диаметр отверстий рабочих матриц составляет от нескольких миллиметров до десятых его долей. В гидроэкс-трудерах давление достигает 2000-4000 кг/см2, в твердофазовых экс-трудерах - 10000-50000 кг/см2. После экструзии давление резко сбрасывают, что вызывает лизис клеток. Экструзионные дезинтеграторы производят фирмы «Маnton Gaulin» (США), LКВ (Швеция).
Дальнейшая обработка. После разрушения клеток их осколки удаляют низкоскоростным центрифугированием или микрофильтрацией через мембрану.
Белковый продукт выделяют из лизата методом высаливания — осаждением высококонцентрированными растворами нейтральных солей, чаще всего натрия- или аммония сульфатом. Седиментация белка может быть достигнута органическими растворителями (этанолом, ацетоном).
Получение готовой продукции
Получение готовой продукции связано с сушкой и консервированием биопрепаратов. Объект сушки - живые микроорганизмы, клетки, ферменты, гормоны и др. БАВ. Биопрепараты кроме биологически активной составляющей содержат органические соединения и значительное количество воды. Вода в продуктах биосинтеза может быть в свободном или связанном состояниях; значительная часть воды удерживается в субстрате физико-механическими и адсорбционными связями (вандерваальсовы силы). Физико-механически связанная вода находится в порах и капиллярах материала.
Для высушивания биопрепаратов применяют методы, не приводящие к потере биологической активности, где доминирует сублимационная сушка (установки типа «Иней» Института биологического приборостроения, г. Пущино (Россия), «Юзефруа» (Франция), «Неto - Неlton» (Дания).
Использование распылительных сушилок ограничено по причине сравнительно жестких условий сушки.
Термолабильные и неустойчивые по ряду показателей биопрепараты при высушивании в суспензиях (не содержащих защитных сред) подвержены существенным структурным и морфологическим изменениям. Это может сопровождаться утратой жизнеспособности и разрушением клеточных структур.
Среды высушивания (защитные среды) - криопротекторы. Денатурирующее влияние замораживания сдерживается инактивацией (изменением свойств) защитных агентов:
высокомолекулярных компонентов (ПВП м.м. от 2600 до 6400 -
декстран, желатин, пептон);
низкомолекулярных и буферных компонентов (глютамат, трис-
буфер).
Защитная среда предохраняет биопрепараты от необратимых изменений в процессе замораживания, высушивания и при последующем хранении. Защитные среды, как правило, состоят из нескольких компонентов. Так, для консервирования клеточных культур используют крио-защитные свойства глицерина и DMSО, их добавляют к питательной среде в концентрации 5-10%. При температуре минус 180-196 °С жизнеспособность законсервированной культуры может сохраняться неограниченно долго.
Розлив, укупорку, этикетировку, упаковку готовой продукции проводят в отдельных аппаратах (при малотоннажном производстве); это компактные установки для ампул, ёмкостей для инфузий; машины для укладки, упаковки.
Технологические линии (крупномасштабное промышленное производство) включают:
•УЗ-моечные машины;
•стерилизационные сушильные туннели (с ламинарными потоками горячего воздуха);
•машины для наполнения и запайки ампул;
•машины наполнения и запайки ёмкостей для растворов внутривенного введения (электронно-турбинный розлив в соответствии с GМР);
• машины для наполнения и запайки порошкообразных препаратов;
•машины для наполнения и укупорки флаконов с навинчивающимся колпачком и специальной насадкой;
•наполнительные и укупорочные машины для инъекций;
•машины для нанесения кода (маркировка цветным кольцом);
•машины для контроля на герметичность;
•этикетировочные машины;
•машины для капсулирования порошков;
•машины для сборки, наполнения, запайки шприц-тюбиков. Отдельные установки и технологические линии выпускают фирмы
Америки, Швейцарии, Франции, Германии, Финляндии; установки этих фирм отвечают требованиям СМР.
Антибиотики как биотехнологические продукты. Методы скрининга продуцентов. Биологическая роль антибиотиков как вторичных метаболитов. Механизмы действия антибиотиков на микроорганизмы. Пути создания высокоактивных продуцентов антибиотиков. Причины сохранения жизнедеятельности суперпродуцентов антибиотиков.
Антибиотики – это вещества, продуцируемые микроорганизмами или получаемые из других природных источников, обладающие антибактериальным действием. Они вмешиваются в обмен белков, нуклеиновых кислот и в энергетические процессы поражения организмов и клеток, избирательно воздействуя на определенные межмолекулярные механизмы. Химическая природа антибиотиков разнообразна и сложна, среди них есть пептиды, полиеновые соединения, полициклические вещества и т.п.
Антибиотики по направлению действия классифицируются на следующие группы:
1. антибактериальные;
2. противогрибковые;
3. антипротозойные;
4. противовирусные;
5. противоопухолевые.
Также выделяют следующие направления антимикробного действия антибиотиков:
1) бактерицидное (фунгицидное) действие – вызывающее гибель бактерий и грибов;
2) бактериостатическое (фунгиостатическое) действие – вызывающее задержку роста и развития бактерий и грибов.
Некоторые из антибиотиков взаимодействуют с рибосомами бактерий, тормозя биосинтез белка в бактериальных клетках и в то же время практически не взаимодействуют с эукариотическими рибосомами. Поэтому они избирательны для бактериальных клеток и малотоксичны для человека и животных (стрептомицин, тетрациклин и т.п.). Один из самых эффективных противотуберкулезных препаратов – антибиотик рифампицин – блокирует работу прокариотических РНК-полимераз – ферментов, катализирующих биосинтез РНК – связываясь с ферментом, но в то же время не обладает способностью связываться с РНК-полимеразами эукариот. Антибиотики взаимодействуют с ДНК и этим нарушают процессы, связанные с размножением и реализацией заложенной в ней наследственной информации. Антибиотики с таким механизмом действия обычно высокотоксичны и в качестве антибактериальных препаратов не используются, а применяются в химиотерапии злокачественных опухолей (актиномицин Д).
Все антибиотики были выделены в ходе систематического скрининга микроорганизмов; число их было существенно увеличено путем химической модификации, цель которой состоит в:
1) расширении спектра действия и повышения эффективности;
2) снижении токсичности и устранении нежелательных побочных эффектов;
3) создании аналогов, устойчивых к разрушению микробами и обладающих, поэтому большим временем «полужизни»;
4) усовершенствовании способов их введения.
Поскольку микробы могут разрушать антибиотики, возникла необходимость модифицировать природные антибиотики ферментами микроорганизмов, но лишь немногие из этих веществ оказались экономически приемлемыми.
Физиологическое значение антибиотиков для продуцирующих их микроорганизмов неясно. Одни исследователи считают, что синтез антибиотика дает определенные преимущества микроорганизмам-продуцентам в борьбе за существование в природных популяциях. Согласно другой точки зрения, антибиотики представляют собой «отбросы» обмена веществ микроорганизмов и не имеют приспособительного назначения.
Самый богатый источник антибиотиков – организмы, живущие в почве. В почвенных микроэкосистемах чрезвычайно развита конкуренция между обитателями, а антибиотики входят в тот природный «арсенал», который нужен для захвата экологической ниши. Образцы почв из всех районов мира постоянно анализируют в поисках новых сильнодействующих антибиотиков. Одним из самых продуктивных источников антибиотиков служит род Streptomyces. К этому роду принадлежат многие виды актиномицетов, у которых обнаружено и идентифицировано свыше 500 видов антибиотиков.
При оптимизации любого промышленного процесса, протекающего с участием живых организмов, основные усилия бывают направлены на улучшение их генетически обусловленных свойств. Традиционно для повышения продуктивности штаммов используют мутагенез с последующим скринингом и отбором подходящих вариантов.
1. До «эры» генной инженерии ценные для промышленности штаммы-продуценты антибиотиков с повышенной продуктивностью получали в основном с помощью мутагенеза и селекции природных микроорганизмов. Например, в результате селекции и улучшения техники ферментации промышленный выход пенициллина достиг 20 г/л, что в 10 тыс. раз выше уровня, который имелся в исходном штамме Penicillium.
2. Скрининг.
3. В основе скрининга лежит тотальная проверка полученных клонов. Отобрав наиболее продуктивные клоны, повторяют обработку тем же или другим мутагеном, вновь отбирают наиболее продуктивный вариант и т.д., т.е. здесь речь идет о ступенчатом отборе по интересующему признаку.
4. Скрининг веществ с целью обнаружения медикаментов так же стар, как и сама медицина. Практически все антибиотики были найдены в результате испытания супернатана (осадочной жидкости) посевов микроорганизмов на наличие веществ, которые могут тормозить рост патогенных микроорганизмов. Современные полусинтетические антибиотики являются результатом химической модификации базового вещества, полученного с применением биотехнологии.
Процесс промышленного производства антибиотиков включает в себя следующие стадии:
1) подготовка питательно среды (среда должна обеспечивать максимальное накопление клеток и синтез антибиотиков, содержать дешевые и доступные компоненты, обеспечивать экономичные приемы выделения и очистки, обладать хорошей фильтрующей способностью).В технологии получения антибиотиков путем культивирования микроорганизмов возможно применение твердых питательных сред: с этой целью применяют агаризованные или сыпучие субстраты (пшено, ячмень, пшеничные отруби и т.п.) и жидких питательных сред.
Условия синтеза антибиотиков:
Стерильность.
Отсутствие посторонней микрофлоры при культивировании продуцентов антибиотиков – важнейший фактор биотехнологического процесса. Для обеспечения стерильности процесса вся аппаратура и коммуникации герметизируются, стерилизуются и держаться под давлением. Питательная среда и воздух для аэрации также стерилизуются. Засев ферментера, отбор проб на анализ проводится в асептических условиях.
Развитие посторонней микрофлоры опасно во многих отношениях:
1. Посторонняя микрофлора, развиваясь в питательной среде, видоизменяет ее и тем самым нарушает оптимальные условия биосинтеза, что уменьшает уровень накопления антибиотика.
2. Наличие посторонней микрофлоры затрудняет дальнейшую обработку культуральной жидкости, отделение ее от мицелия и приводит к получению некачественного нативного раствора.
3. Продукты жизнедеятельности посторонних микроорганизмов могут загрязнять получаемый антибиотик и снижать ее качество.
Питательная среда.
Условия синтеза антибиотиков заключаются в том, что в питательной среде должны присутствовать источники азота, углерода, фосфора, а также предшественники антибиотиков и витамины. К источникам азота относятся - аминокислоты, аммонийные соли и иногда нитраты; к источникам углерода – глюкоза и лактоза, также в питательной среде должны присутствовать такие элементы как сера, магний, марганец, железо, цинк, кобальт. Кроме того, при производстве антибиотиков в состав питательной среды должны входить соевая мука, кукурузный экстракт, жмых масленичных культур.
РН.
Для бактерий рH питательной среды составляет приблизительно 7, для грибов – 4,5 –5, для актиномицетов – 6,7 - 7,5.
Для большинства известных антибиотиков оптимальный рН близок к нейтральному. При значительном закислении или защелачивании среды процесс биосинтеза тормозится. Многие антибиотики в щелочных или кислых средах неустойчивы и легко инактивируются.
Для регулирования рН в питательные среды для получения антибиотиков часто добавляют некоторое количество мела, который вступает в реакцию с возникающими в ходе процесса метаболизма кислотами, образуя при этом нейтральные соли и углекислый газ, впоследствии удаляемый из среды.
Температура.
Для биосинтеза каждого антибиотика требуется определенная температура. Так, для биосинтеза пенициллина грибом рода пеницилиум оптимальной температурой является 25 – 26 °С, в то время как при образовании антибиотиков актиномицетами обычно поддерживают более высокую температуру 27 – 29 °С.
В процессе ферментации вследствие интенсивно протекающих процессов выделяется значительное количество тепла, поэтому для поддержания оптимальной температуры необходимо постоянное охлаждение среды.
Перемешивание и аэрация.
Так как продуценты антибиотиков являются аэробами, следовательно, требуется создать при их синтезе хорошую аэрацию. Во время ферментации происходит одновременно два процесса – растворение кислорода в питательной среде и потребление кислорода микроорганизмом. Микроорганизмы используют для дыхания только растворенный в среде кислород, поэтому обеспеченность микроорганизма кислородом определяется скоростью его растворения в культуральной жидкости.
При глубинном культивировании микроорганизмов в помышленных масштабах этот процесс осуществляется путем пропускания воздуха через питательную среду и культуральную жидкость с помощью специальных аэрирующих приспособлений – барботеров. При этом жидкость интенсивно перемешивается.
Основное назначение аэрации и перемешивания – это снабжение культуры кислородом, но одновременно эти процессы способствуют поддержанию мицелия в равномерно взвешенном состоянии и выравниванию концентрации питательных веществ и продуктов обмена в культуральной жидкости.
Вспенивание.
Питательные среды, применяемые при получении антибиотиков, содержат вещества, способные образовывать весьма стойкие пены. Эти вещества могут образовываться в процессе ферментации. Аэрация и перемешивание среды вызывают образование слоя пены на поверхности жидкости, что ухудшает условия развития продуцента.
Пеногашение осуществляется главным образом путем добавления поверхностно активных веществ, способствующих снижению стойкости пена и в дальнейшем ее разрушению.
2) Подготовка посевного материала (продуценты-мутанты® колба на качалке® первый инокулятор (10 л)® второй инокулятор (100-500 л)® ферментер),
3) Ферментация (для получения антибиотиков используют методы поверхностного и глубинного культивирования).
Промышленная ферментация – специализированный процесс получения различных веществ в химической или родственной отраслях промышленности с помощью микроорганизмов, включая процесс их размножения.
Современная ферментационная установка состоит из нескольких небольших емкостей ферментеров для инокуляции (получения посевного материала) и ферментера большого размера (от 1 л до 1000 м3) для проведения конечной стадии получения целевого продукта. Эти емкости соединены между собой с помощью фиксированных трубопроводов или гибких шлангов. В ферментерах часто используют механическое перемешивание. Кроме того, ферментационные установки могут включать в себя установки для обработки сырья, емкости для приготовления питательной среды, оборудование для непрерывной стерилизации или варочные котлы, установки для получения пара высокого давления и больших объемов стерильного воздуха для аэробной ферментации.
4) Выделение антибиотиков (методы выделения целевого продукта различаются в зависимости от локализации антибиотиков: экстракция органическими растворителями, осаждение в виде нерастворимого комплекса, сорбция на ионообменных смолах),
5) Очистка антибиотиков (данная стадия технологического процесса включает в себя следующие этапы: осаждение, сорбция, сушка),
6) Получение готового продукта (упаковка, фасовка).
Бифидобактерии, молочнокислые бактерии, непатогенные штаммы кишечной палочки как основа нормофлоров. Механизм положительного влияния пробиотиков.
Общая классификация биопрепаратов.
В терапии дисбактериоза кишечника важную роль играет нормализация режима питания, охранительный психоэмоциональный режим, разъяснительные беседы с больным. Выбор лекарственных препаратов – сложная задача врача-гастроэнтеролога при функциональных заболеваниях желудочно-кишечного тракта.
В настоящее время биологически активные вещества, применяемые для улучшения функционирования пищеварительного тракта, регуляции микробиоценоза желудочно-кишечного тракта, профилактике и лечения некоторых специфических инфекционных заболеваний подразделяют на:
- диетические добавки;
- функциональное питание;
- пробиотики;
- пребиотики;
- синбиотики;
- бактериофаги;
- биотерапевтические агенты.
По литературным данным, первые три группы объединяются в одну группу пробиотики. Применение пробиотиков и пребиотиков приводит к одному и тому же результату – увеличению числа молочнокислых бактерий, естественных обитателей кишечника. Таким образом, эти препараты в первую очередь должны назначаться детям грудного возраста, пожилым людям и тем, кто находится на стационарном лечении.
Пробиотики – живые микроорганизмы: молочнокислые бактерии, чаще бифидо- или лактобактерии, иногда дрожжи, которые относятся к нормальным обитателям кишечника здорового человека.
Препараты-пробиотики на основе вышеозначенных микроорганизмов широко используются в качестве питательных добавок, а также в йогуртах и других молочных продуктах. Микроорганизмы, входящие в состав пробиотиков, не патогенны, не токсичны, содержаться в достаточном количестве, сохраняют жизнеспособность при прохождении через желудочно-кишечный тракт и при хранении. Пробиотики, в основном, не считаются лекарственными препаратами и рассматриваются как средства, благоприятно влияющие на состояние здоровья человека. Они могут включаться в питание в качестве диетических добавок в виде лиофилизированных порошков, содержащих бифидобактерии, лактобактерии и их комбинации, используемых без назначения врача для восстановления микробиоценоза кишечника, для поддержания хорошего состояния здоровья, поэтому разрешение на производство и применение пробиотиков в качестве диетических добавок от государственных структур, контролирующих создание лекарственных препаратов (В США – это Food and Drug Administration (FDA), в России – Фармакологический комитет и Комитет медицинских и иммунобиологических препаратов МЗ РФ) не требуется.
Пребиотики. Чтобы компонент пищи был классифицирован как пребиотик, он не должен подвергаться гидролизу пищеварительными ферментами человека, не должен адсорбироваться в верхних отделах пищеварительного тракта, однако должен являться селективным субстратом для роста и/или метаболической активации одного вида или определенной группы микроорганизмов, заселяющих толстый кишечник, приводя к нормализации их соотношения. Ингредиенты питания, которые отвечают этим требованиям, являются низкомолекулярными углеводами. Свойства пребиотиков наиболее выражены во фруктозо-олигосахаридах (ФОС), инулине, галакто-олигосахаридах (ГОС), лактулозе, лактитоле. Пребиотики находятся в молочных продуктах, кукурузных хлопьях, крупах, хлебе, луке репчатом, цикории полевом, чесноке, фасоли, горохе, артишоке, аспарагусе, бананах и многих других продуктах. На жизнедеятельность микрофлоры кишечника человека в среднем расходуется до 10 % поступившей энергии и 20 % объема принятой пищи.
Смесь пробиотиков и пребиотиков объединена в группу синбиотиков, которые оказывают полезный эффект на здоровье организма-хозяина, улучшая выживаемость и приживаемость в кишечнике живых бактериальных добавок и избирательно стимулируя рост и активацию метаболизма лактобактерий и бифидобактерий. Применение прокинетиков в лечении функциональных нарушений имеет место, но их эффективность не очень высока и они не могут использоваться в виде монотерапии. Среди прокинетиков наиболее эффективными антирефлюксными лекарственными препаратами, используемыми в настоящее время в педиатрической практике, являются блокаторы дофаминовых рецепторов – прокинетики, как центральных (на уровне хеморецепторной зоны мозга), так и периферических. К ним относятся метоклопрамид и домперидон.
Также еще одним методом преодоления нарушения нормального функционирования желудочно-кишечного тракта является метод энтеросорбции. Принцип энтеросорбции основан на связывании и выведении из желудочно-кишечного тракта различных микроорганизмов, токсинов, антигенов, химических веществ и т.п. Адсорбционные свойства сорбентов обусловлены наличием в них развитой пористой системы, обладающей активной поверхностью, способной удерживать газы, пары, жидкости или вещества находящиеся в растворе. Механизмы лечебного действия энтеросорбции связаны с прямыми и опосредованными эффектами.
Кроме вышеозначенной классификации биопрепаратов, применяемых для нормализации состояния кишечной микрофлоры при дисбактериозе, существует еще один вид их классификации:
а) монопрепараты – это препараты, содержащие только один штамм бактерий (колибактерин, лактобактерин, бифидумбактерин);
б) ассоциированные препараты – препараты, содержащие два и более штамма бактерий (например, бификол – двухкомплексный препарат, содержащий штамм кишечной палочки М17 и бифидобактерии). За рубежом применяют такие ассоциированные препараты, как омнифлора, нормофлора и другие, содержащие до 5 – 6 различных штаммов микроорганизмов. Отечественные препараты выпускаются в виде лиофилизированной массы в ампулах или флаконах для перорального применения.
Характеристика биопрепаратов, применяемых для нормализации состава кишечной микрофлоры.
Последние годы характеризуются бурным увеличением количества пробиотиков за счет как модернизации и улучшения свойств старых препаратов, так и появления новых, в том числе поликомпонентных, содержащих новые штаммы микроорганизмов, а также различные биологически активные вещества. Это позволило классифицировать группу пробиотиков на несколько составляющих ее подгрупп:
1. Монокомпонентные. Бифидосодержащие (бифидумбактерин, состоящий из штаммов вида B.breve, бифидин, содержащий штаммы вида B.adolescentis M-42). Лактосодержащие (биобактон, состоящий из ацидофильных лактобактерий). Препараты из апатогенных представителей рода bacillus (споробактерин).
2. Поликомпонентные. Бифилонг, ацилак, аципол, биоспорин, линекс - 3-компонентный препарат из ацидофильных лактобактерий, би-фидобактерий инфантис и фекального стрептококка. Бифилак, би-фикол, бифиформ, бифилонг, ацепол, ацелак, линекс.
3. Комбинированные. Бифидумбактерин форте, кипацид - лактобактерий и комплексный иммуноглобулин, препарат с лизоцимом -бифилиз, биофлор жидкий с экстрактом сои, овощей и прополиса.
4. Иммобилизованные на сорбенте бактерии — бифидумбактерин форте.
Бифидо- и лактосодержащие пищевые продукты - бифилакт, би-фидок и др.
Бактисубтил (Bactisubtile) - препарат на основе устойчивых к действию желудочного сока спор бактерий, прорастание которых происходит в кишечнике. Вегетативные формы бактерий высвобождают энзимы, расщепляющие углеводы, жиры, белки; в результате образуется кислая среда, угнетающая процессы гниения. Препарат препятствует нарушению синтеза в кишечнике витаминов группы В и Р. Форма выпуска - капсулы.
Бифидумбактерин в порошке (Bifidum bacterium in pulveris) представляет собой лиофилизированную микробную массу живых антагонистически активных штаммов Bifidumbacterium bifidum. Обладает антибактериальной активностью в отношении широкого спектра патогенных иусловнопатогенных бактерий, восстанавливает микрофлору кишечника, нормализует деятельность ЖКТ, обладает иммунорегулирующими свойствами. Назначают при дисбактериозе у детей и взрослых. Выпускается в виде таблеток", во флаконах, пакетах и ампулах.
Бификол сухой (Bificolum siccum) представляет собой микробную массу живых антагонистически активных штаммов Bifidobacterium bifi-dum и Е. coli. Применяется для лечения больных хроническими колитами разной этиологии на фоне дисбактериоза у детей и взрослых. Форма выпуска — флаконы и таблетки.
Бифилиз (Bifilys) в 1 мл содержит 5 млн живых бифидобактерий, органические кислоты, легкоусвояемый белок, лизоцим. Показан при острых кишечных заболеваниях вируснобактериальной природы.
Бифилонг сухой (Bifilong siccum) представляет собой микробную массу живых антагонистически активных двух штаммов Bifidobacterium bifidum и Bifidobacterium longum. В виде лиофилизата выпускается в ампулах и флаконах. Применяется для лечения острых и хронических заболеваний кишечника, профилактики и лечения дисбактериоза у детей и взрослых.
Биовестин — экологически чистая эмульсия живых бифидумбакте-рий (активнее сухого бифидумбактерина). Назначают при диатезах и иммунодефицитах с первых дней жизни.
Лактобактерин в порошке (Lactobacterinum in pulvis) — сухая микробная масса живых антагонистически активных двух штаммов Lacto-bacterium acidophilus. Форма выпуска - ампулы.
Аципол сухой содержит штаммы Lactobacterium acidophilus и полисахарида кефирных грибков. Рекомендован детям с первых дней жизни и взрослым для коррекции дисбиотических изменений в кишечнике.
Линекс (Ыпех) содержит Lactobacterium acidophilus, Bifidobacterium bifidum, E. faecalis. Поддерживает физиологическое равновесие кишечной микрофлоры.
Колибактерин сухой - лиофилизированная микробная масса живых бактерий Е. coli. Применяется для лечения детей и взрослых, страдающих хроническим колитом. Форма выпуска — флаконы, ампулы и таблетки.
Споробактерин сухой - микробная масса живых бактерий Bacillus subtilis. Применяется для лечения хирургических инфекций мягких тканей, остеомиелита, дисбактериозов. Выпускается в виде лиофилизиро-ванной массы в ампулах.
Энтерол 250 (Enterol-250) применяется в качестве активного компонента, содержит лиофилизированные дрожжи Sacchoromyces boulardii, механизм действия которых принципиально отличается от механизма действия других бактериальных препаратов. Sacchoromyces boulardii, обладают генетически обусловленной устойчивостью к антибиотикам и поэтому при проведении антибактериальной терапии сохраняют свою активность. Они не колонизируют пищеварительный тракт, клетки дрожжей элиминируются с калом в течение нескольких дней после завершения курса терапии. Таким образом, Sacchoromyces boulardii действуют как «временная» кишечная микрофлора, способная сохранять или восстановливать равновесие экосистемы кишечника.
Концентрат «Наринэ» - лиофилизированная в среде культивирования микробная масса живого штамма Lactobacillus acidophilus новорожденных детей Армении с добавлением защитной среды сахаро-желатино-молочной. Препарат выпускается в виде порошка кремового цвета, кисломолочного вкуса, во флаконах и пакетах. Пребиотики
Лактулоза (Lactulose) - синтетический дисахарид. Под влиянием препарата увеличивается количество лактобактерий, что приводит к повышению кислотности в просвете толстого кишечника; наряду с этим увеличивается объем каловых масс и проявляется слабительный эффект без влияния на слизистую оболочку и гладкую мускулатуру кишечника. Лактулоза уменьшает образование и всасывание азотсодержащих токсичных веществ в проксимальном отделе толстого кишечника, не уменьшает абсорбцию витаминов, не вызывает привыкания. Форма выпуска - сироп, состоящий из лактулозы, галактозы, лактозы.
Пантотенат кальция. Утилизируется бифидобактериями и способствует увеличению их массы.
Памба (парааминобензойная кислота). Способствует росту бифидо-и лактобактерий, кишечных палочек.
Хилак-форте - концентрат метаболизма бактерий. Способствует восстановлению нормофлоры.
Нормазе (лактулоза) - синтетический дисахарид. Понижает рН в толстом кишечнике, снижает концентрацию гнилостных бактерий, стимулирует перистальтику и рост бифидобактерий.
Лизоцим (Lysocim) - мукополисахаридаза, фермент белковой природы. Препарат оказывает бактериолитическое действие, разрушает полисахариды микробной клетки, подавляет рост грамположительных бактерий, стимулирует неспецифическую реактивность организма, оказывает противовоспалительное и муколитическое действие.
Дата добавления: 2018-04-04; просмотров: 1908; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
