РЕГУЛЯТОРНЫЕ СУБПОПУЛЯЦИИ Т-ЛИМФОЦИТОВ
ИММУННАЯ СИСТЕМА
И ОСНОВНЫЕ ИММУНОПАТОПАТОЛОГИИ
Профессор В.В.Климов
| 1. ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ИММУННОЙ СИСТЕМЫ 1.1. Основные понятия 1.2. Клетки иммунной системы 1.3. Молекулы иммунной системы 2. ИММУННЫЙ ОТВЕТ 2.1. Стадии иммунного ответа 2.2. Эффекторные реакции 2.3. Регуляция иммунных процессов 3. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ 4. АУТОИММУННЫЕ РАССТРОЙСТВА 5. ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА |
Мультимедийный учебник в Интернете:
http://www.immunology.klimov.tom.ru
1. ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
ИММУННОЙ СИСТЕМЫ
1. 1. Основные понятия
ИММУНИТЕТ (IMMUNITY) - это общебиологический феномен, суть которого заключается в долговременном самоподдержании внутри отдельного организма баланса между генетически "своим" и "несвоим" в условиях чужеродного окружения. ИММУННАЯ СИСТЕМА (IMMUNE SYSTEM) специализируется в реализации механизмов данного феномена. Чтобы понять основы науки ИММУНОЛОГИИ (IMMUNOLOGY), необходимо изучить защитные механизмы, направленные на устранение "несвоего", и регуляторные процессы, которые формируют внутренний гомеостаз "своего" в организме. Иммунитет может быть врождённым (или неспецифическим) и адаптивным (приобретённым, специфическим). Строго говоря, об иммунитете целесообразно говорить только во втором случае; врождённый иммунитет - это скорее совокупность факторов и механизмов неспецифической резистентности. Отказ одного или нескольких компонентов иммунной системы может приводить к развитию иммунодефицитов и утрате способности к защите от инфекции. Расстройства регуляции в функционировании данной системы способствуют развитию аутоиммунных болезней, аллергий (на основе четырёх типов гиперчувствительности) и росту опухолей. Важность самого существования иммунной системы иллюстрируется появлением в последние 20 лет новой болезни - СПИД (синдрома приобретённого иммунодефицита), при которой наблюдаются все возможные варианты нарушений со стороны иммунной системы.
|
|
|
АНТИГЕН (АNTIGEN) является макромолекулой, содержащей чужеродную или собственную информацию, которая представляет собой основу для запуска специфического иммунного ответа; с другой стороны, следует иметь в виду, что любой антиген часто служит для исследователей иммунобиологическим маркёром. Общее число различных антигенов оценивается в число 1018. Молекула полного антигена состоит из информационной части (низкомолекулярные антигенные детерминанты, эпитопы, гаптены) и несущей части (макромолекулярный белок). Изолированная информационная часть сама по себе не является иммуногенной, т.е. не способна индуцировать иммунный ответ.
|
|
|
АНТИТЕЛО (ANTIBODY) или ИММУНОГЛОБУЛИН (IMMUNOGLOBULIN) - это один из типов молекул иммунной системы. Антитела и антигенраспознающие рецепторы могут связывать соответствующие антигены.
ЛИМФОЦИТЫ (LYMPHOCYTES) являются главными клетками иммунной системы. По-существу, иммунная система - это иерархическая совокупность лимфоидных клеток (1013). Существуют T-, B-и NK- лимфоциты. Т-клетки дифференцируются в тимусе и играют ключевую роль во всех направлениях специфического иммунного ответа. В-лимфоциты дифференцируются в костном мозге, являются предшественниками плазмоцитов - антителопродуцентов. NK-клетки (естественные киллеры) участвуют в неспецифической цитотоксичности по отношению к внутриклеточно расположенным патогенам. Остальные клетки (макрофаги, дендритные клетки, нейтрофилы, эозинофилы, тучные клетки и др.) также участвуют во многих иммунных процессах, но их участие скорее опосредованное, т.е. они привлекаются лимфоцитами для реализации функций иммунной (лимфоидной) системы..
Стратегической функцией иммунной системы является реализация генетической программы индивидуального развития организма от рождения до смерти в условиях чужеродного окружения. Тактические функции:
|
|
|
1. Защита от "несвоего" (инфекции, трансплантата).
2. Элиминация модифицированного "своего" (опухолей, повреждённых, стареющих клеток).
3. Регуляция роста и развития клеток и тканей.
Главными партнёрами иммунной системы являются центральная нервная система, эндокринная система и печень, которые наиболее важны для обеспечения регуляции гомеостаза.
Функциональная организация иммунной системы может быть рассмотрена на органном, клеточном и молекулярном уровнях. Существует два типа органов иммунной системы, центральные (или первичные) и периферические (или вторичные). КОСТНЫЙ МОЗГ (bone marrow) - центральный орган, в котором рождаются все клетки иммунной системы и созревают В-лимфоциты (В-лимфопоэз или В-коммитмент). ТИМУС(thymus)- центральный орган, в котором дифференцируются Т-лимфоциты (Т-лимфопоэз или Т-коммитмент) и который также является общекоординирующим для всей иммунной системы.
В периферических органах происходит встреча лимфоцитов с антигенами и их специфическая антигензависимая дифференцировка. Этот процесс называется иммунным ответом(immune response), сутью которого является создание целой "армии" специфически реагирующих лимфоцитов и специфических антител, которые осуществляют эффекторные реакции по уничтожению данного конкретного антигена. Существуют Т-клеточный и В-клеточный (гуморальный) пути иммунного ответа.
|
|
|
К периферическим органам относятся:
q Лимфатические узлы, лимфатические протоки и селезёнка;
q Лимфоидная ткань, ассоциированная со слизистыми оболочками, mucosae (Mucous-Associated Lymphoid Tissue - МАLT), которая расположена на пяти уровнях. Первые два уровня - евстахиева труба (Tube-Associated Lymphoid Tissue - ТАLТ) и носоглотка (Nasal-Associated Lymphoid Tissue - NALT) - представлены различными миндалинами; следующий уровень - бронхи (Bronchus-Associated Lymphoid Tissue - BALT) и грудные железы (у женщин); четвёртый уровень - верхние отделы желодочно-кишечного тракта (Gut-Associated Lymphoid Tissue - GАLТ) - содержат лимфоидную ткань желудка и пейеровы бляшки тонкого кишечника, пятый уровень - это нижние отделы желудочно-кишечного тракта и мочеполовая система - аппендикс, солитарные фолликулы толстого кишечника и лимфоидная ткань мочеполовой системы;
q Лимфоидная ткань, ассоциированная с кожей (Skin-Associated Lymphoid Tissue - SАLТ).
Большой вклад в развитие иммунологии от Edward Jenner до наших дней внесли такие учёные как L.Pasteur, И.И.Мечников, P.Ehrlich, Н.Ф.Гамалея, F.McFarlane Burnet, N.K.Jerne, Р.В.Петров, S.Tonegawa и другие.
1.2. Клетки иммунной системы
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении можно разделить на четыре группы:
1. АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ (ANTIGEN-PRESENTING CELLS):
макрофаги, дендритные клетки типов 1 и 2, В-лимфоциты;
2. РЕГУЛЯТОРНЫЕ КЛЕТКИ (REGULATORY CELLS):
T-индукторы, Т-хелперы типов 1, 2 и 3, Т-регуляторы типа 1;
3. ЭФФЕКТОРНЫЕ КЛЕТКИ (EFFECTOR CELLS):
плазматические клетки (дифференцирующиеся из В-лимфоцитов);
цитотоксические Т-клетки с фенотипом CD8+ (или T-киллеры);
эффекторные Т-клетки воспаления с фенотипом CD4+ (или Т-лимфоциты, ответственные за гиперчувствительность замедленного типа);
нейтрофилы, эозинофилы, базофилы, тучные клетки, натуральные киллеры (NK-клетки), макрофаги.
4. КЛЕТКИ ПАМЯТИ (MEMORY CELLS):
Т-клетки памяти с фенотипом CD8+; Т-клетки памяти с фенотипом CD4+;
долгоживующие плазматические клетки; В-клетки памяти.
Номенклатура CD ("Сluster of Differentiation"), основана на моноклональной технологии, которая была разработана Нобелевскими лауреатами (1984)G.J.F. Kohler (Швейцария) и C.Milstein (Аргентина/Великобритания), позволяет идентифицировать клетки относительно их происхождения, стадии дифференцировки, функционального состояния и т.д. (см. Табл. 1). Данная технология, без сомнения, оказалась революционной в иммунологических и смежных областях исследований.
Taблица 1
ГЛАВНЫЕ ИДЕНТИФИКАЦИОННЫЕ CD-МАРКЁРЫ
КЛЕТОК ИММУННОЙ СИСТЕМЫ
| Обозначение кластера | Клетки |
| CD10 | Лимфоидная стволовая клетка |
| CD3 | T-лимфоцит |
| CD4 | Т-лимфоцит-хелпер/Т-индуктор |
| CD8 | Цитотоксический T-лимфоцит |
| СD72, CD79a/b и др. | B-лимфоцит |
| CD16/CD56 | Натуральный киллер (NK-клетка) |
| CD64 | Moноцит/макрофаг |
Лимфоциты как главные клетки иммунной системы имеют отличительные особенности:
1. Постоянная "патрульная" рециркуляция по кровотоку, лимфотоку, межтканевым пространствам и секретам.
2. Способность распознавать, т.е. взаимодействовать со "своим" и "несвоим" по принципу "лиганд - рецептор".
3. Клональная организация (McF. Burnet) и способность формировать сетевые элементы (N.K. Jerne).
4. Способность к непрерывным реаранжировкам в своём геноме в любом возрасте в связи с потребностями формирования специфического ответа на патоген.
5. Умение запоминать о факте встречи с каким-либо антигеном и обеспечивать в будущем экспрессный высокоэффективный ответ на него.
КЛОН (a clone)-это группа лимфоцитов, коммитированная к определённому антигену. До встречи с этим антигеном каждый лимфоцит клона называют наивным. По-видимому, в человеческом организме исходно существуют десятки миллионов клонов Т- и В-лимфоцитов. После встречи с соответствующим антигеном и в результате иммунного ответа коммитированный лимфоцит становится праймированным.
1.3. Молекулы иммунной системы
Для осуществления необходимых функций клетки иммунной системы имеют сложную молекулярную организацию своих рецепторов и способны к выработке целого ряда молекул.
1. АНТИГЕНПРЕДСТАВЛЯЮЩИЕ, АНТИГЕНРАСПОЗНАЮЩИЕ И АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ. Набор этих молекул уникален для каждого организма, для каждого лимфоцитраного клона и для каждого специфического иммунного ответа. К ним относятся:
· антигенраспознающие иммуноглобулиновые рецепторы В-клеток (B cellular receptors - BCR);
· свободные иммуноглобулины: IgM, IgG, IgA, IgE, IgD;
· антигенраспознающие рецепторы Т-клеток (T cellular receptors - TCR);
· антигенпредставляющие молекулы: лейкоцитарные антигены главного комплекса гистосовместимости (Human leukocyte antigens - HLA I и II) и молекулы CD1 (a, b, c, d, e).
2. АДГЕЗИВНЫЕ МОЛЕКУЛЫ опосредуют взаимодействия между клетками и лигандами при непосредственном контакте:
· суперсемейство иммуноглобулинподобных молекул;
· интегрины;
· селектины;
· муцины (муциноподобные васкулярные аддрессины);
· суперсемейство рецепторов к факторам некроза опухоли и фактору роста нервов - TNF/NGF (или молекулы, опосредующие апоптоз);
· линк-семейство (компоненты экстрацеллюлярного матрикса).
3. ИММУНОЦИТОКИНЫ являются гормонами иммунной системы, действующими чаще с пара- и аутокринным, реже - с эндокринным эффектами:
· интерлейкины (Interleukins - ILs);
· колониестимулирующие факторы (Colony-stimulating factors - CSFs);
· интерфероны (Interferons - IFNs);
· факторы некроза опухоли (Tumour-necrosis factors - TNFs);
· хемокины (Chemokines) и др.
4. СБОРНАЯ ГРУППА РАЗЛИЧНЫХ МЕДИАТОРОВ ИММУННОГО ВОСПАЛЕНИЯ включает белки комплемента, "острой фазы", простаноиды и лейкотриены, протеолитические ферменты и др.
Иммуноглобулины M, G, A, E и D являются эффекторными молекулами гуморального иммунного ответа. Молекула иммуноглобулина является гликопротеином; белковые цепи включают сотни aминокислотных последовательностей; углеводный компонент составляет 2-12 %. Молекула IgG (см. Рис. 1) состоит из двух идентичных лёгких (light - L) и двух идентичных тяжёлых (heavy - H) цепей (chains). Лёгкие цепи бывают двух типов: (k и l), а тяжёлые - пяти (m, g, a, e и d). Лёгкие и тяжёлые цепи содержат повторяющиеся гомологичные последовательности и образуют своеобразные клубки (домены). Существуют константные (constant) (CL, CH1, CH2 и CH3) и вариабельные (variable) домены (VL и VH). Гипервариабельные области вариабельных доменов формируют антигенсвязывающие сайты или активные центры. Молекула иммуноглобулина может быть также разделена на Fc-фрагмент (a fragment crystalline), который ответственен за неспецифическую эффекторную активность, и2 Fab-фрагмента (fragment antigen-binding), которые содержат антигенсвязывающие сайты. Химическая природа антител была подробно изучена Нобелевскими лауреатами (1972) G.M.Edelman (США) и R.R.Porter (Великобритания).
Каждый В-лимфоцит экспрессирует В-клеточный антигенраспознающий рецептор (an antigen-recognizing receptor - BCR), который состоит из мономерных имуноглобулинов IgM и IgD, имеет клональную гетерогенность и ассоциирован с молекулами CD79a и CD79b, необходимыми для проведения сигнала внутрь клетки. Наряду с этими молекулами, имеется также корецепторный комплекс (CD19, CD21(CR2), CD81), предназначенный для распознавания HLA II.
Каждый Т-лимфоцит экспрессирует Т-клеточный антигенраспознающий рецептор (an antigen-recognizing receptor - abTCR), который состоит из двух цепей, a и b, и имеет один из корецепторов - CD4 (у Т-хелперов) или CD8 (у цитотоксических Т-лимфоцитов). Эти инвариантные корецепторы CD4 и CD8 необходимы для распознавания соответственно HLA II или HLA I. Каждая цепь TCR подобно молекуле иммуноглобулина имеет вариабельный и константный домены, что обеспечивает клональную гетерогенность антигенраспознающих рецепторов. Ещё одна молекула (CD3) тесно ассоциирована c TCR и служит для проведения сигнала внутрь клетки. CD3 состоит из 5 инвариантных белков (e,g,d,x,h). Другой тип антигенраспознающего рецептора, gdTCR, экспрессируется на небольшой субпопуляции Т-клеток. Эти gdT-клетки, роль которых пока до конца не исследована, по-видимому, функционируют подобно NK-клеткам, однако они тоже имеют определённую клональную гетерогенность.
Молекулы гистосовместимостибыли открыты Нобелевскими лауреатами (1980) B.Benacerraf (США), J.Dausset (Франция) и G.D.Snell (США). Эти молекулы играют решающую роль во многих иммунных процессах, включая загрузку антигенных пептидов и их презентацию. Молекулы HLA разделяются на класс I (A, B, C, E, F, G) и класс II (DR, DP, DQ) в зависимости от их структуры и функции. Экспрессия HLA I имеет место почти на всех клетках (за исключением синцитиотрофобласта), выполняя функцию взаимной информации клеток внутри организма об аутологичности; экспрессия HLA II наблюдается почти исключительно на клетках иммунной системы: B-лимфоцитах, макрофагах, эндотелиоцитах, активированных Т-клетках и др.
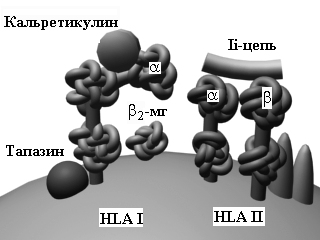
|
Не-HLA молекулы CD1 (a, b, c, d и e), которые состоят по аналогии с HLA I из a-цепи и b2-микроглобулина, также вовлечены в процессы загрузки антигенов, но небелковой природы (фосфолипиды, липополисахариды).
Имеется связь между наследованием некоторых генов HLA и высоким риском развития определённых болезней. Например, более 90 % пациентов с анкилозирующим спондилоартритом, тяжёлой аутоиммунной патологией позвоночника, имеют ген HLA-B27.
Поскольку HLA определяет гистосовместимость, необходимо, чтобы у донора и реципиента при трасплантации органа или ткани было соответствие по HLA. Карта пациента по HLA называется "full house" ("полный дом") и включает данные относительно двух аллелей каждого вида молекул (например, HLA-A, HLA-B, HLA-DR и др.). Сенсибилизация белками HLA в прошлом (при гемотрансфузиях, транплантациях или беременности) может приводить к острому отторжению пересаживаемого трансплантата или тромбоцитопении при переливании крови, поэтому необходимо обязательное тестирование на наличие антител против HLA. Типирование HLA может cлужить дополнительным критерием для диагностики таких болезней как анкилозируюзий спондилоартрит, диабет, целиакия, гемохроматоз, псориаз и нарколепсия, при которых известна высокая степень связи с определёнными гаплотипами HLA.
2. ИММУННЫЙ ОТВЕТ
2.1. Стадии иммунного ответа
Иммунный ответ - это процесс взаимодействия клеток иммунной системы, который индуцируется антигеном и приводит к образованию эффекторных клеток и молекул, которые уничтожают данный антиген. Иммунный ответ является всегда специфическим, но не изолированным процессом, который протекает только в периферических органах иммунной системы. Как правило, он сопровождается такими неспецифическими реакциями как фагоцитоз, активация комплемента, NK-клеток и т.д.
В начальных стадиях иммунного ответа участвуют, по крайней мере, три вида клеток: макрофаг (а также дендритная клетка), Т- и В-лимфоцит. В целом, все клетки, вовлечённые в этот процесс, могут быть разделены, как указывалось выше, на антигенпредставляющие, регуляторные, эффекторные и клетки памяти. Имеется два магистральных пути иммунного ответа:
1. T-клеточный ответ;
2. В-клеточный или гуморальный иммунный ответ.
Первый из них регулируется Т-хелперами типа 1 и приводит к формированию 1) эффекторных CD4+ T-клеток воспаления и 2) цитотоксических CD8+ T-лимфоцитов, а также соответствующих им Т-клеток памяти. Второй путь регулируется Т-хелперами типа 2 и заканчивается образованием плазматических клеток (продуцентов антител классов M, G, A и E) и В-лимфоцитов памяти. Переключение на синтез некоторых изотипов антител частично контролируется Т-хелперами типа1. За исключением скрытого индуктивного периода иммунный ответ в среднем продолжается около 3 недель с максимальным напряжением на 1-й неделе.
Можно выделить несколько основных стадий иммунного ответа:
1. Эндоцитоз антигена, его процессинг и загрузка на молекулы HLA I или II для презентации лимфоцитам.
2. Распознавание комплекса антигенный пептид/HLA I или II и других стимулов.
3. Сигнальная трансдукция и активация клеточного клона.
4. Клональная экспансия или пролиферация.
5. Созревание эффекторных клеток и клеток памяти.
6. Эффекторная активность.
Антигенпредставляющая клетка (макрофаг, дендритная клетка или В-лимфоцит) сталкивается с нативным антигеном и эндоцитирует его. Макрофаги фагоцитируют, главным образом, патогены, для которых характерно внутриклеточное паразитирование (вирусы, бактерии, грибы, простейшие и др.); дендритные клетки пиноцитируют вирусы; В-клетки интернализируют различные токсины. Следующее событие, процессинг(processing), представляет собой ферментативный катализ макромолекулы антигена внутри антигенпредставляющей клетки. В результате процессинга происходит высвобождение доминирующей антигенной детерминанты (иммуно-активного пептида или суперантигена), который загружается на желобки собственных молекул HLA I/II, выводится на поверхность клетки для представления(presentation) лимфоцитам. В зависимости от происхождения антигена выделяют два пути процессинга.
Экзогенные антигены презентируются в комплексе с молекуламиHLA II наивным CD4+ T-клеткам (путь, опосредуемый HLA II). Cначала эти антигены эндоцитируются и фрагментируются с помощью протеолитических ферментов в эндосомах (лизосомах). В то же самое время, молекулы HLA II, связанные с шаперонами (калнексином и инвариантной цепью Ii), синтезируются и собираются в эндоплазматическом ретикулуме. Ii-цепь необходима для защиты желобка молекулы HLA вплоть то того момента, пока сюда не будет загружен антигенный пептид. Затем комплекс HLA II/Ii-цепь транспортируется через аппарат Гольджи в эндосомы, где Ii-цепь теряется, а роль по защите желобка начинают выполнять дополнительные молекулы HLA-DM и, вероятно, HLA-DO. Наконец, антигенный пептид загружается на желобок молекулы HLA II, и этот комплекс эксспрессируется на поверхности клетки.
Эндогенные или внутриклеточно расположенные антигены микробного происхождения загружаются на молекулы HLA I (путь, опосредуемый HLA I) для представления наивным CD8+ T-клеткам. Сначала, в отличие от экзогенных антигенов, такие цитоплазматические антигены перемещаются в цитозоль, где они расщепляются в крупном протеолитическом комплексе - протеасоме. После этого антигенный пептид транспортируется через "туннель" молекул TAP-1/TAP-2 в эндоплазматический ретикулум. Одновременно здесь происходит сборка молекулы HLA I, желобок которой (по аналогии с Ii-цепью у HLA II) находится "под защитой" шаперонов (сначала калнексина, затем кальретикулина), а укладка всей молекулы HLA I в последующем стабилизируется дополнительными молекулами (тапазином и др.). После загрузки антигенного пептида на желобок HLA I этот комплекс транспортируется на поверхность клетки.
Небелковые антигены, вероятно,загружаются на не-HLA антигенпредставляющие молекулы CD1.
В целом, макрофаги и В-клетки вовлечены соответственно в Т-клеточный или гуморальный иммунный ответ по пути, опосредованному HLA II, а дендритные клетки двух типов способны к перекрёстной презентации. Дендритная клетка типа 1 осуществляет процессинг эндогенных антигенов по пути с HLA I для запуска Т-клеточного ответа, а дендритная клетка типа 2 процессирует экзогенные антигены по пути с HLA II и включает В-клеточный ответ.
Распознавание (recognition) протекает в течение нескольких часов. Однако при нарушениях клеточной миграции и межклеточных взаимодействий оно может быть более длительным. Возможно, это приводит к замедлению всего иммунного ответа на патоген. Клиническими проявлениями этой стадии являются повышение температуры тела, мышечная слабость, снижение аппетита и сонливость. По большей части они обусловлены системными эффектами цитокинов, о чём будет более подробно рассказано далее.
Для того, чтобы мог стартовать специфический иммунный ответ на конкретный антиген, необходимо, чтобы Т- и В-лимфоциты соответствующего клона встретились с антигенпредставляющей клеткой. Некоторые антигены бактерий (T-независимые антигены) распознаются с помощью BCR B-клеток и не требуют помощи со стороны Т-хелперов. Большинство нативных антигенов (так называемых T-зависимых антигенов) распознаётся по "полной программе" наивными CD4+ T-хелперами типа 1 и CD8+ T-клетками (для включения Т-клеточного ответа или пути Т-хелперов 1), а также нaивными CD4+ T-хелперами типа 2 (для включения гуморального ответа или пути Т-хелперов 2). Интересно, что для прайминга CD8+ Т-клеток необходимо участие CD4+ T-хелперов 1.
Во время распознавания лимфоциты воспринимают три типа обязательных сигналов, один специфический и два неспецифических:
1. Aнтигенный пептид/HLA I или II.
2. Цитокины.
3. Костимулирующие молекулы.
Aнтигенный пептид, загружаемый на HLA I или II в результате процессинга, служит специфическим сигналом. Это одновременное "двойное" распознавание "своего" (белков HLA) и "несвоего" (чужого антигена) было открыто Нобелевскими лауреатами (1996) P.C.Doherty (Австралия, США) и R.M.Zinkernagel (Швейцария) и оказалось довольно универсальным явлением. Секретируемые цитокины и экспрессируемые костимулирующие молекулы являются двумя обязательными неспецифическими сигналами. Более того, для обеспечения надёжного физического контакта клеток необходим также взаимодействие таких адгезивных молекул как LFA-1, ICAM-1, ICAM-2, ICAM-3.
Цитокины играют одну из ключевых ролей в неспецифической регуляции иммунного ответа. Т- и В-лимфоциты получают цитокиновые сигналы от антигенпредставляющих клеток, NK-клеток, тучных клеток и др. Обратный сигнал от лимфоцитов, например, секретируемый IFNg, способствует реэкспрессии HLA I/II на антигенпредставляющих клетках. Цитокины, дуйствующие на ранних стадиях иммунного ответа, могут быть разделены на две группы в зависимости от его направления:
1. IL12, IL2, IL18, IFNg, TNFa/b (для пути Т-хелперов типа 1).
2.IL4(для пути Т-хелперов типа 2).
Однако, на следующих стадиях иммунного ответа (клональная экспансия, созревание эффекторов, переключение синтеза изотипов антител) в процесс вовлекаются другие цитокины.
Костимулирующие молекулы также играют важную роль в неспецифической регуляции иммунного ответа (см. Табл. 2.).
Таблица 2
КОСТИМУЛИРУЮЩИЕ МОЛЕКУЛЫ ПРИ ИММУННОМ ОТВЕТЕ
| Клетка | Молекула | Функция |
| Антигенпредставляющие клетки Т-хелпер 1 Т-хелпер 2 В-лимфоцит | B7.1, B7.2 CD28 CTLA-4 (CD152) OX40L CD40 CD22 | Лиганды для CD28, CTLA-4 Активационный сигнал Ингибирующий сигнал Активационный сигнал Активационный сигнал на переключение синтеза различных классов антител Ингибирующий сигнал |
Активация клеток (activation) является результатом сигнальной трансдукции, которая осуществляется серией сложных внутриклеточных реакций. После распознавания первоначально наблюдается активация связанных с корецепторами и молекулами CD3 (на Т-клетках) или CD79 (на В-клетках) тирозинкиназ нескольких семейств (Lck, Fyn, Blk, Btk, Lyn, Zap70, Syk и др.), затем через посредничество адаптерных белков включаются сигнальные пути. Один из них связан с активацией фосфолипазы Сg, образованием инозитолтрифосфата и диацилглицерола, активацией протеинкиназы С и мобилизацией внутриклеточного Ca2+, с транскрипцией гена IL2. Данный цитокин является ключевым ростовым фактором для лимфоцитов при иммунном ответе. Второй сигнальный путь связан с обменом арахидоновой кислоты и приводит к транскрипции генов структурных белков, необходимых для осуществления митозов клеток.
Клональная экспансия (clonal expansion) лимфоцитов представляет собой их бурную пролиферацию, которая протекает в периферических органах иммунной системы. Пролиферирующие В-лимфоциты образуют вторичные фолликулы в лимфатических узлах (центробластная стадия), при этом размножение клеток регулируется рядом цитокинов: IL2, IL4, IL5, IL6, IL10, IL13, IL14, IFNg, TNF и др. В последующем центробласты начинают превращаться в центроциты, которые мигрируют на периферию фолликулов (центроцитарная стадия). В этот момент клетки вступают в период соматических гипермутаций, который является своеобразным способом селекции нужной специфичности BCR. Происходит позитивный отбор клеток с высокоспецифичным BCR и негативный отбор В-лимфоцитов с низкоспецифичным рецептором. В процессе созревания(maturation) В-клетки претерпевают морфологические изменения (иммунобласт, затем лимфоплазмоидная клетка и, наконец, плазмоцит) и мигрируют в костный мозг и MALT для синтеза антител различных классов. Синтез ранних антител IgM наблюдается уже к концу первых суток клинического инфекционного эпизода, а высокоспецифических IgG - на 5-7 сутки.
Клональная экспансия и созревание Т-клетокпротекает в паракортикальных зонах лимфатических узлов и периартериолярных пространствах селезёнки. Распознавшие антиген клетки вступают в пролиферацию и превращаются в лимфобласты. Клоны CD8+ T-клеток нарастают быстро, а клоны CD4+ Т-лимфоцитов - более медленно. В целом, клональная экспансия и диференцировка регулируются разными цитокинами (IL2, IL7, IL9, IL12, IL15, IFNg, TNF и др.) и адгезивными молекулами. В процессе дифференцировки значительно изменяется фенотип Т-лимфоцитов, но, в отличие от В-лимфоцитов, они не меняются морфологически.
Характерным клиническим эквивалентом стадий клональной экспансии и дифференцировки является увеличение периферических лимфатических узлов, миндалин, видимых лимфатических фолликулов и селезёнки. Можно наблюдать эти симптомы при респираторной, урогенитальной или значительной системной инфекциях.
По окончанию иммунного ответа наряду с эффекторными клетками формируются Т- и В-клетки памяти. В отличие от небольших сроков жизни, характерных для эффекторных лимфоцитов, клетки памяти остаются жизнеспособными в течение длительного времени (пожизненно). Существуют CD4+ и CD8+ T-клетки памяти, В-клетки памяти и долгоживущие плазматические клетки. В отличие от наивных Т-лимфоцитов Т-клетки памяти характеризуются фенотипом CD45RO+, CD44hi, быстрым HLA-независимым циклом и способностью секретировать большие количества цитокинов. Долгоживущие плазматические клетки обеспечивают дополнительный механизм поддержания синтеза иммуноглобулинов без дополнительной антигенной стимуляции в течение 1,5 лет.
|
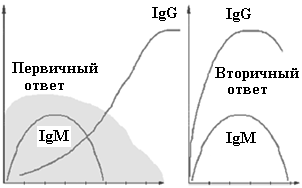 Вторичный иммунный ответ протекает в ускоренном режиме за счёт клеток памяти (см. Рис. 3). Появление IgM в сыворотке крови часто указывает на свежую инфекцию или реактивацию персистирующего патогена, а синтез IgG соответствует наличию иммунной памяти к однажды перенесённой инфекции. При таком ускоренном синтезе IgG клинические проявления инфекционной болезни обычно отсутствуют.
Вторичный иммунный ответ протекает в ускоренном режиме за счёт клеток памяти (см. Рис. 3). Появление IgM в сыворотке крови часто указывает на свежую инфекцию или реактивацию персистирующего патогена, а синтез IgG соответствует наличию иммунной памяти к однажды перенесённой инфекции. При таком ускоренном синтезе IgG клинические проявления инфекционной болезни обычно отсутствуют.
2.2. Эффекторные реакции
Физические барьеры (кожа, слизистые оболочки с их мерцательным эпителием, секреты) являются первой линией защиты, часто очень эффективной. Многие патогены могут быть уничтожены с помощью лизоцима, бактерицидных жирных кислот, b-дефензина, кислотности желудочного сока и др. Печень представляет собой метаболический барьер для патогенов за счёт моноксигеназной системы (цитохром Р450).
У здоровых людей в сыворотке крови постоянно присутствуют неспецифические натуральные антитела, представляющие собой IgM, которые направлены против антигенов условно-патогенной флоры. Существуют также каталитические антитела, обладающие протеиназной и нуклеазной активностью.
Система естественной цитотоксичности (NK-клетки и интерфероны) обеспечивает экстренную защиту против вирусов и других внутриклеточных патогенов без воспалительной реакции. NK-клетки подвергают апоптозу (apoptosis) любую клетку в организме, если она не экспрессирует на своей поверхности HLA I, поэтому мишенями для них являются собственные клетки, инфицированные вирусами, опухолевые, деградирующие и повреждённые клетки. Распознав HLA I на какой-либо встретившейся клетке, NK-клетка, напротив, получает ингибирующий сигнал и не индуцирует апоптоз этой клетки.
При попадании патогенов в ткань быстро развивается неспецифическое воспаление (nonspecific inflammation). Этот процесс включает острофазную реакцию белков сыворотки крови, активацию комплемента по альтернативному пути и неспецифический фагоцитоз нейтрофилами и макрофагами. Такое воспаление является острым, не зависит от присутствия антител и сопровождается активацией эндотелия.
Если патогену удаётся миновать неспецифический эшелон защиты, на него развивается иммунный ответ, следствием которого является включение специфических эффекторных механизмов, направленных на деструкцию данного патогена (см. Табл. 3). Следует иметь в виду, что иммунное воспаление типа IV (по Gell и Coombs) c иммунологической точки зрения является нормальной эффекторной реакцией на внутриклеточно расположенные патогены. Однако нерегулируемое иммунное воспаление с широким распространением на собственные ткани является безусловным патологическим явлением.
Taблица 3
TИПЫ СПЕЦИФИЧЕСКИХ ЭФФЕКТОРНЫХ МЕХАНИЗМОВ
| Опосредуемые B-клетками | Опосредуемые T-клетками |
| 1. Связывание антигена в иммунные комплексы и его: a) простая нейтрализация; б) деградация в связи с активацией комплемента по классическому пути; в) опсонизация антителами IgM/IgG и последующий фагоцитоз | 1. Апоптоз клеток-мишеней, индуцированный CD8+ цитотоксическими Т-клетками |
| 2. Aнтитело-зависимая клеточная цитотоксичность (AЗКЦ), например, при отторжении трансплантата | 2. Деградация антигена путём индуцированного CD4+ T-эффекторами иммунного воспаления (ГЗТ) с активацией макрофагов и других клеток |
2.3. Регуляция иммунных процессов
Иммунный ответ является хорошо регулируемым процессом. Регуляция имеет большое значение для достижения нужного уровня специфичности и иммунной памяти, включения именно тех эффекторных механизмов, которые бы наибольшим образом отвечали потребностям организма, а также для исключения нежелательных последствий гиперактивации иммунной системы (например, при чрезмерном иммунном воспалении, аллергиях и аутоиммунных расстройствах).
Регуляция иммунных процессов осуществляется с помощью механизмов иммунного самоконтроля, за счёт влияния печени, эндокринной системы, ЦНС и в связи с генетическими механизмами контроля. Система иммунной саморегуляции включает принцип отрицательной обратной связи, идиотип-антиидиотипическую сеть, баланс Тх1/Тх2, цитокиновую регуляцию, контроль со стороны костимулирующих молекул и др. Одну из ключевых ролей играют регуляторные Т-лимфоциты, которые функционируют, имея разные цитокиновые профили (см. Табл. 4).
Taблица 4
РЕГУЛЯТОРНЫЕ СУБПОПУЛЯЦИИ Т-ЛИМФОЦИТОВ
| Субпопуляция | Цитокиновый профиль | Основные функции |
| T-хелпер 1 | IL2, IFNg, TNFb | Регуляция Т-клеточного и гуморального ответа (переключение на синтез IgG2, IgG3, IgA), активация макрофагов |
| T-хелпер 2 | IL4, IL5, IL6, IL10, IL13, TGFb | Регуляция гуморального ответа, включая переключение на синтез антител IgE и IgG4 |
| T-хелпер 3 | TGFb | Функции, сходные сTх2; толерантность при беременности? |
| T-регулятор 1 | IL10, TGFb, IFNg | ? |
Печень является, главным образом, источником иммуносупрессивных факторов (a-фетопротеин, "pit" NK-клетки и др.). Гормоны оказывают дозозависимые разнонаправленные эффекты в отношении иммунных процессов. В физиологических концентрациях СТГ, ТТГ, тироксин, трийодтиронин, инсулин, пролактин стимулируют иммунный ответ, а АКТГ, глюкакортикоиды и половые гормоны - супрессируют. В последние годы интенсивно исследуется влияние на иммунную систему гормона эпифиза мелатонина, который, наряду с иммуностимулирующим действием, имеет также ритморегулирующий, снотворный, антиоксидантный и другие эффекты. ЦНС влияет на иммунную систему через посредничество нейтротрансмиттерных (допамин-, серотонин-, ГАБА- и пептидэргических) рецепторов, проявляя стереотипную координацию иммунных процессов, связывая их с разными сферами психо-эмоцианальной деятельности мозга.
Генетическая регуляция иммунитета позволяет обеспечивать многообразие антигенраспознающих рецепторов за счёт генных реаранжировок в хромосомах 2, 7, 14 и 22 не только в эмбриональном периоде, но и непосредственно в ходе иммунного ответа. Дополнительное разнообразие синтезируемых антител достигается также в связи с соматическими гипермутациями. Индивидуальная сила иммунного ответа регулируется индивидуальным набором HLA-генов (6-я хромосома), белковые продукты которых способны с разной эффективностью загружать разные антигенные пептиды.
3. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ
Иммунодефициты - это состояния, при которых отмечается выпадение одного или нескольких компонентов иммунной системы, что проявляется снижением резистентности к экзогенным (внеэпидемическим) и эндогенным (условно-патогенным) инфекциям. Присутствие инфекционного синдрома в форме острых гипертоксических или повторных, рецидивирующих, затяжных и хронических инфекционных процессов является преобладающим, но не единственным синдромом, характерном для иммунодефицитов. Другими проявлениями могут быть разнообразные аллергические реакции, аутоиммунные расстройства и даже пролиферативные процессы (в доброкачественном варианте - лимфаденопатии, гипертрофия миндалин, тимомегалия, в злокачественном - развитие лимфом, лимфосарком и др.).
Иммунодефициты подразделяются по происхождению - на первичные и вторичные, по клинической выраженности - на манифестные и минорные, по локализации дефекта - на дефициты антител или В-лимфоцитов, комбинированные дефициты Т- и В-клеток, дефекты NK-клеток, фагоцитоза, дефициты адгезивных молекул, комплемента.
Первичные иммунодефициты обусловлены дефектами в отдельном гене или целых кластерах генов, ответственных за синтез белковых молекул иммунной системы. Манифестные формы первичных иммунодефицитных состояний проявляются тяжёлыми разнообразными инфекциями, которые развиваются с раннего возраста и часто (без адекватной терапии) приводят к летальному исходу, но встречаются такие формы редко (1 случай на 100 000 новорождённых). Однако если рассмотреть проблему более широко, с учётом слабо диагностируемых минорных форм, и принять во внимание неустойчивость равновесия популяционных наборов HLA и наиболее часто встречающихся патогенов в среде обитания данной популяции (от чего зависит сила иммунного ответа), то можно констатировать, что по большей части все иммунодефициты - первичные. Классическими примерами манифестных первичных иммунодефицитов являются болезнь Брутона (Х-сцепленная агаммаглобулинемия, обусловленная дефектом гена, который кодирует тирозинкиназу Btk), синдром Луи-Бар или атаксия-телеангиэктазия (дефицит Т-лимфоцитов, связанный с аномалией одного из генов в 11-й хромосоме), хроническая грануломатозная болезнь (отсутствие "респираторного взрыва" в фагоцитирующих нейтрофилах из-за аномалий генов в Х, 1-й, 7-й или 16-й хромосомах).
Вторичные иммунодефициты обусловлены количественным и качественным голоданием (недостатком белков, витаминов, микроэлементов Fe, Zn, Cu и др.), эндокринопатиями (сахарный диабет, болезнь Иценко-Кушинга), потерей иммунокомпетентных клеток и молекул при травмах, кровотечениях, операциях, ожоговой болезни, утрате органов иммунной системы, воздействием ионизирующей радиации, полихимитерапии, гипертоксическими инфекциями и инфекциями, к которым иммунная система человека оказалась эволюционно не готовой (ВИЧ и др.).
Cиндром приобретённого иммунодефицита (Acquired Immune Deficiency Syndrome) является классическим примером такой инфекции. Возбудитель болезни, ВИЧ, имеет избирательное сродство одного из своих оболочечных белков (gp120) к молекуле CD4, которая экспрессируется Т-лимфоцитами-хелперами. При СПИДе наблюдается последовательное выключение Т-клеточного иммунитета, что приводит к активации оппортунистических инфекций и другим расстройствам со стороны иммунной системы, включая развитие опухолевого процесса (саркома Капоши).
Диагностика иммунодефицитных состояний основывается на клинико-иммунологических исследованиях. Л.В.Ковальчук, А.Н.Чередеев и соавт. (1980) предложили двухуровневое проведение лабораторных исследований иммунного статуса. 1-й (cкрининговый) уровень включает общий анализ крови, определение IgM, IgG, IgA, розеткообразующих клеток для оценки Т- и В-лимфоцитов (этот метод в настоящее время имеет историческое значение), тест на фагоцитоз (например, НСТ-тест). 1-й уровень позволяет выявлять грубые дефекты в иммунной системе и планировать дальнейшие исследования 2-го уровня (CD-маркёры, продукция цитокинов и специфических антител и аутоантител, пролиферативная способность клеток, белки комплемента, "острой фазы" и т.д.). Исследования 2-го (аналитического) уровня требуют развёртывания современной иммунологической лаборатории (с проточным цитофлюориметром, ламинарным боксом для культивирования тканей и т.д.), наличия высококвалифицированного персонала; эти анализы позволяют выявлять тонкие нарушения в функционировании иммунной системы и проводить современные научные исследования.
Перспективы лечения иммунодефицитных состояний связаны с замещением недостающих компонентов (введение иммуноглобулинов, пересадка костного мозга и т.д.), назначением иммунотропных препаратов (при минорных формах), генной терапией.
4. АУТОИММУННЫЕ РАССТРОЙСТВА
В норме в каждом организме присутствуют антитела, В- и Т-лимфоциты, направленные против антигенов собственных тканей (аутоантигенов). Аутоантигены подразделяются на обычные (к ним относится самый широкий набор белков и других макромолекул, из которых построен человеческий организм), "секвестрированные" (они присутствуют в тканях, обычно не доступных для лимфоцитов, таких, как мозг, передняя камера глаза, половые железы) и модифицированные (т.е. образующиеся при повреждениях, мутациях, опухолевом перерождении). Следует также отметить, что некоторые антигены (например, белки миокарда и почечных клубочков) являются перекрёстно реагирующими по отношению к некоторым микробным антигенам (в частности, b-гемолитического стрептококка). Исследование аутоантител, направленных против аутоантигенов, позволило разделить их на три группы:
- естественные или физиологические (их большинство, они не могут при взаимодействии с аутоантигенами повреждать собственные ткани);
- антитела-"свидетели" (они соответствуют иммунологической памяти в отношении аутоантигенов, которые когда-либо образовывались вследствие случайных повреждений тканей);
- агрессивные или патогенные (они способны в условиях эксперимента вызывать повреждение тканей, против которых направлены).
Само по себе наличие аутоантигенов, большинства аутоантител и аутореагирующих лимфоцитов не является патологическим явлением. Однако при наличии ряда дополнительных условиях может запускаться и постоянно поддерживаться аутоиммунный процесс, который способствует развитию иммунного воспаления с деструкцией вовлечённых тканей, формированием фиброза и новообразованием сосудов, что в конечном счёте приводит к утрате функции соответствующего органа. Важнейшими дополнительными условиями включения и поддержания аутоиммунного процесса являются:
- хронические вирусные, прионовые и другие инфекции;
- проникновение возбудителей с перекрёстно реагирующими антигенами;
- наследственные или приобретённые молекулярные аномалии строения важнейших структурных и регуляторных молекул иммунной системы (включая молекулы, вовлечённые в контроль апоптоза);
- индивидуальные особенности конституции и обмена веществ, предраспологающие к вялотекущему характеру воспаления;
- пожилой возраст.
Условно патогенез аутоиммунных расстройств можно разделить на два этапа: индуктивный и эффекторный.
Индуктивный этап тесно связан со срывом иммунологической толерантности. Толерантность к собственным антигенам организма является естественным состоянием, при котором деструктивная активность иммунной система направлена только на внешние антигены. Процессы старения организма с иммунологической точки зрения обусловлены медленной отменой такой толерантности.
Имеется несколько механизмов, контролирующих поддержание долгосрочной аутотолерантности:
1. Клональная делеция.
2. Клональная анэргия.
3. Иммуносупрессия, опосредованная Т-клетками.
Клональная делеция является формой центральной толерантности, которая формируется в ходе негативной селекции в тимусе и костном мозге и достигается апоптозом Т- и В-лимфоцитов, имеющих высокоспецифические антигенраспознающие рецепторы к аутоантигенам. Клональная анергия - также форма центральной толерантности которая характерна, главным образом для В-клеток, имеющих BCR к растворённым аутоантигенам в низких концентрациях. При клональной анергии клетки не погибают, а становятся функционально неактивными.
Однако некоторые Т- и В-лимфоциты нередко избегают негативной селекции и, при наличии дополнительных условий могут активироваться. Этому могут способствовать проникновение патогенов с перекрёстными антигенами или поликлональными активаторами, сильный сдвиг цитокинового профиля в сторону Тх1, затяжной воспалительный процесс с наличием множества медиаторов, которые могут модифицировать аутоантигены в очаге и др. Для сохранения толерантности периферические аутореактивные Т-лимфоциты должны быть подвержены апоптозу или стать анергичными под супрессивным влиянием цитокинов профиля Тх2. Если не проиходит включение механизмов периферической толерантности, т.е. иммуносупрессии, опосредуемой Т-клетками, начинается развитие аутоиммунных расстройств. В значительной степени аутоиммунная патология (как и опухолевая прогрессия) - это дефицитность апоптоза. Описана летальная наследственная болезнь с дефектом гена, кодирующего Fas - одного из специализированных рецепторов для индукции апоптоза, которая проявляется лимфопролиферативным синдромом с системными симптомами, типичными для аутоиммунных заболеваний. Существенная роль в патогенезе многих форм аутоиммунной патологии отводится медленным вирусным и прионовым инфекциям, которые, вероятно, могут модифировать процессы апоптоза и экспрессии важнейших регуляторных молекул.
Важным аспектом патогенеза является наличие каких-либо молекулярных аномалий. Например, при ревматоидном артрите и ряде других патологий обнаружен дефект гликозилирования Fc-фрагмента собственных антител класса IgG, когда отмечается дефицит сиаловой кислоты и галактозы. Аномальные молекулы IgG образуют между собой конгломераты с сильными иммуногенными свойствами, которые индуцируют аутоиммунный ответ. Наличие молекулярных аномалий генов, ответственных за синтез цитокинов профиля Тх2 и Тх3, приводит к тому, что начавшийся аутоиммунный ответ не заканчивается восстановлением аутотолерантности.
Аутоиммунные болезни нередко развиваются в так называемых иммунологически привилегированных органах (мозг, передняя камера глаза, мужские и женские половые железы); к таким патологиям относятся рассеянный склероз, симпатическая офтальмия, иммунологическое бесплодие. Когда аутоантигены из этих органов оказываются в несвойственных местах (например, при травме) и имеются какие-либо дополнительные условия усиления их иммуногенности (дефицит цитокинов профилей Тх2 и Тх3, присутствие адъювантов и т.д.), включается аутоиммунный процесс.
Эффекторный этап любого аутоиммунного процесса протекает по одному или чаще нескольким механизмам гиперчувствительности II, III или IV типов (по Gell и Coombs):
II тип: аутоиммунная гемолитическая анемия, пернициозная анемия, вульгарная пузырчатка, хроническая идиопатическая крапивница, тяжёлая миастения (myasthenia gravis), аутоиммунный тиреоидит и др.;
III тип: системная красная волчанка, системные васкулиты и др.;
IV тип: ревматоидный артрит, инсулинзависимый сахарный диабет (типа I), рассеянный склероз и др.
Клиническая симптоматика аутоиммунных болезней характеризуется хроническим прогредиентным течением с деструктивными проявлениями в органах-мишенях. Существует пять патогенетических классов аутоиммунных болезней:
· Класс А. Первичные аутоиммунные болезни с наследственной предрасположенностью. В зависимости от вовлечённости одного или нескольких органов в этом классе выделяют органоспецифические болезни (например, аутоиммунный тиреоидит), промежуточные (например, аутоиммунная патология печени и желудочно-кишечного тракта) и органонеспецифические (коллагенозы).
· Класс В. Вторичные аутоиммунные болезни (например, алкогольный цирроз печени, хроническая лучевая болезнь).
· Класс С. Аутоиммунные болезни на основе генетических дефектов комплемента (например, некоторые формы наследственной гемолитической анемии).
· Класс D. Аутоиммунные болезни, связанные с медленными вирусными и прионовыми инфекциями (например, вилюйский энцефалит, болезнь Альцгеймера и др.).
· Класс Е. Комбинированные формы.
Диагностика основана на выявлении специфических аутоантител и аутореактивных Т-лимфоцитов (см. Табл. 5), гистологических и специальных исследованиях.
Таблица 5
СПЕЦИФИЧЕСКИЕ МАРКЁРЫ АУТОИММУННЫХ БОЛЕЗНЕЙ
| Аутоиммунная патология | Иммунологический маркёр |
| Аутоиммунная гемолитическая анемия Пернициозная анемия Вульгарная пузырчатка Хроническая идиопатическая крапивница Тяжёлая миастения (myasthenia gravis) Аутоиммунный тиреоидит Системная красная волчанка Ревматоидный артрит Инсулинзависимый сахарный диабет (типа I) Рассеянный склероз | Аутоантитела против Rh-антигена Аутоантитела против внутреннего фактора Касла Аутоантитела против кадхерина эпидермиса Аутоантитела против FceRI Аутоантитела против ацетилхолиновых рецепторов Аутоантитела против тироидной пероксидазы Аутоантитела против ДНК, рибосом Т-клетки, специфичные к коллагену II; аутоантитела к Fc-фрагменту собственных IgG с дефектом гликозилирования Т-клетки, специфичные к эндоантигену b-клеток островков Лангерганса Т-клетки, специфичные к основному белку миелина |
Лечение аутоимунных болезней связано с попытками восстановления аутотолерантности, назначением противовоспалительных антимедиаторных препаратов, включая кортикостероиды, а также генной терапией.
5. ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА
Развитие медицины в ХХ веке привело к созданию принципиально новой технологии лечения - пересадке органов и тканей. Трансплантации почек, костного мозга, печени, лёгких, сердца стали применяться, особенно в развитых странах мира, очень широко, что позволило продлить жизнь миллионам людей.
С другой стороны, пересадка чужой ткани стало биологическим явлением, не известным в эволюции человеческого организма. Ятрогенная трансплантация ни в коем случае не может быть сведена к беременности - физиологическому процессу, когда семи-аллогенный плод находится в особых условиях с наличием полупроницаемого "HLA-негативного" барьера (плаценты) и в зоне действия мощных иммуносупрессорных факторов (TGFb, IL4, IL10, хорионический гонадотропин и др.).
Однако оказалось, что в целом механизмы отторжения трансплантата(graft rejection) соответствуют главным направлениям иммунного ответа на чужеродные антигены. Разные клоны наивных Т-лимфоцитов реципиента распознают: 1) HLA трансплантата, 2) антигенные пептиды трансплантата + HLA трансплантата, 3) антигенные пептиды трансплантата + собственные HLA. В последующем развиваются все варианты иммунного ответа, что приводит к формированию цитотоксических Т-лимфоцитов, Т-эффекторов иммунного воспаления, специфических имуноглобулинов и соответствующих Т- и В-клеток памяти. Интересно, что существенную роль в инициации иммунного ответа на антигены трансплантата имеют Т-лимфоциты, избежавшие положительной селекции в тимусе и не отличающие "свои" HLA от "несвоих".
Существует две формы отторжения трансплантата в эксперименте (на примере кожного лоскута): первичная и вторичная. Острая первичная реакция развивается в течение 10-11 дней за счёт, главным образом, эффекторных Т-клеток и макрофагов. В первые 4-5 дней лоскут выглядит как прижившийся, но к 6-7 дням появляются отёчность, геморрагии, лимфоцитарно-моноцитарная инфильтрация, а к 10-11 дням происходит отторжение. Острая вторичная реакция является ускоренной по времени и наступает в период 1-5 дней от момента пересадки, кожный лоскут при этом не успевает даже васкуляризироваться и выглядит как "белый трансплантат". Хроническая реакция отторжения развивается спустя месяцы и годы и опосредуется как иммунными механизмами (лимфоциты, антитела, комплемент, цитокины, адгезивные молекулы), так и неиммунными (нарушения кровообращения в пересаженном органе). Существует также сверхострая реакция отторжения (например, при ABO-несовместимости), которая обусловлена наличием у реципиента гуморальной памяти в отношении антигенов донора; эта форма развивается в течение нескольких минут после трансплантации (или трансфузии крови) и может быть фатальной для пациента.
Проблема эффективности пересадок органов связана прежде всего с эффективной иммуносупрессивной терапией, т.е. достижением таких подходов в этой области, которые бы имели минимальные побочные эффекты.
Если пересаживаемая ткань содержит иммунокомпетентные аллогенные клетки, то при наличии у реципиента иммунодефицита может включиться реакция "транплантат против хозяина" (graft-versus-host). Такое явление наблюдается при пересадке костного мозга и при некоторых иммунодефицитах.
Американские учёные J.E.Murray и E.D.Thomas были удостоены Нобелевской премии (1990) за работы в области трансплантологии, которые стали важным подходом к лечению многих болезней человека.
Дата добавления: 2018-04-04; просмотров: 720; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
