Натрия бромид (Natriibromidum)
NаВr(М.м. 102,90)
Получение
1.Метод, основанный на использовании смеси йодидов железа (II) и (III):
3 Fe + 4Br2 → FeBr2 + 2 FeBr3
Fe3Br8 + 4 K/Na2CO3 + 4 H2O → 8 K/NaBr + 2 Fe(OH)3↓ + Fe(OH)2↓ + 4 CO2↑
2.Вторым по значимости является метод, основанный на реакции:
K/Na2CO3 + 2 HCOONa + 2 Br2 → 4 K/NaBr + 3 CO2 + H2O
Описание
KBr: Бесцветные или белые кристаллы или белый мелкокристаллический порошок без запаха, солёного вкуса.
NaBr: Белый кристаллический порошок без запаха, солёного вкуса. Гигроскопичен.
Растворимость
KBr: растворим в 1,7 частях воды, мало растворим в спирте.
NaBr: легко растворим в воде, трудно растворим в спирте.
Подлинность
1.Препарат KBr дает характерные реакции на калий:
2.Препарат NaBr дает характерные реакции на натрий:
3.Препарат дает характерные реакции на бромид-ион:
· C раствором хлорамина в хлороформе, хлороформный слой окрашивается в желто-бурый цвет:
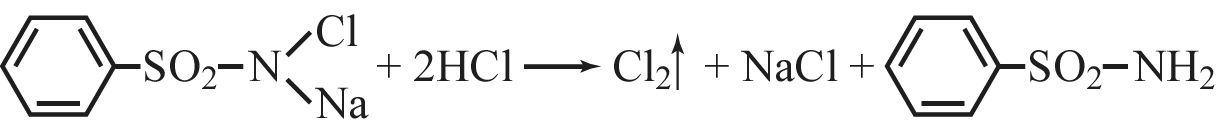
2КВг + С12®Вr2 + 2КС1
· С раствором кислоты азотной разведенной и серебра нитрата, образуется желтоватый творожистый осадок, трудно растворимый в растворе аммиака:
NaBr + AgNО3®AgBr¯+ NaNО3
AgBr + 2NH4OH®[Ag(NH3)2]Br + 2H2O
Чистота
1.Прозрачность и цветность раствора: 1 г препарата растворяют в 10 мл свежпрокипяченной и охлажденной воды. Раствор должен быть прозрачным и бесцветным.
2.Щелочность: к раствору препарата добавляют 0,1 мл 0,1 М раствора кислоты соляной, от прибавления 1 капли раствора фенолфталеина не должен окрашиваться в розовый цвет ни на холоду, ни при кипячении.
|
|
|
3.Проверяют на сульфаты (не более 0,01%); иодиды; барий; кальций; броматы; тяжелые Me (не более 0,001%); железо (не более 0,001%); мышьяк (не более 0,0001%).
4.Потеря в весе при высушивании KBr: 1 г (точная навеска) растертого в мелкий порошок препарата сушат при 120°С до постоянного веса. Потеря в весе не должна превышать 1%.
Потеря в весе при высушивании NaBr: 0,5 г (точная навеска) растертого в мелкий порошок препарата сушат при 110°С в течение 4 часов. Потеря в весе не должна превышать 4%.
Количественное определение
Прямая аргентометрия, индикатор – хромат калия, титруют до оранжево-желтого окрашивания.
K/NaBr + AgNO3 → AgBr↓ + K/NaNO3
2 Ag+ + CrO42- →Ag2CrO4↓
Хранение
В хорошо укупоренной таре, предохраняющей от действия света, в сухом месте.
Применение
Успокаивающее средство. Порошок и таблетки по 0,5г.
Калия хлорид (Kaliichloridum)
КСl (М.м. 74,56)
Натрия хлорид (Natriichloridum)
NaСl (М.м. 58,44)
Получение
KCl: источники – минералы: сильвинит (KCl.NaCl) или корналлит (KCl · MgCl2 · 6H2O. Калия хлоридвыделяют флотацией (метод основан на различии в смачиваемости частицмелкоизмельчённой смеси веществ вследствие различной степени гидрофильности).Дальнейшая очистка основана на следующих реакциях:
|
|
|
От сульфатов:K2SO4 + BaCl2 →BaSO4 + 2 KCl
От фосфатов:K2HPO4 + BaCl2 →BaHPO4 + 2 KCl
От магния:MgCl2 + K2CO3 → MgCO3 + 2 KCl
От кальция:CaCl2 + K2CO3→CaCO3 + 2 KCl
От бария:BaCl2 + K2CO3 →BaCO3 + 2 KCl
Затем отфильтровывают, фильтрат выпаривают и охлаждают,осадок собирают на фильтре, промывают водой и сушат. Последующая очистка осуществляетсяперекристаллизацией из воды.
NaCl: получают из природных источников – каменной соли, воды солёных озер, и после соответствующей очистки перекристаллизовывают.
Описание
KCl: бесцветные кристаллы или белый кристаллический порошок, без запаха, соленого вкуса.
NaCl: белые кубические кристаллы или белый кристаллический порошок без запаха, соленого вкуса.
Растворимость
KCl: растворим в 3 частях воды, практически нерастворимв 95% спирте.
NaCl: Растворим в 3 частях воды (его растворимость почти не зависит от температуры), мало растворим в спирте.
Подлинность
KCl: препарат даёт характерные реакции на ион калия и хлориды.
NaCl: препарат даёт характерные реакции на ион натрия и хлориды.
Чистота
1.Раствор препарата (16 г в 160 мл воды) должен быть прозрачным и бесцветным.
2.Кислотность/щелочность: при добавлении 0,1 мл 0,02 М раствора едкого натра, должно появиться голубое окрашивание; при добавлении 0,1 мл 0,02 М раствора соляной кислоты, должно появиться желтое окрашивание (индикатор – бромтимоловый синий).
|
|
|
3.KCl проверяют на соли аммония; кальций (не более 0,006%); магний; барий; железо (не более 0,0003%); тяжелые металлы (не более 0,0005%); сульфаты (не более 0,005%); натрий; мышьяк (не более 0,00005%).
NaCl проверяют на соли аммония (не более 0,004%); кальций (не более 0,006%); магний; барий; железо (не более 0,0003%); тяжелые металлы (не более 0,0005%); сульфаты (не более 0,005%); калий; мышьяк (не более 0,00005%).
Количественное определение
Прямая аргентометрия, индикатор– хромат калия, до оранжево-желтого окрашивания
K/NaCl + AgNO3→ AgCl↓ + K/NaNO3
2 Ag+ + CrO42- →Ag2CrO4↓
Хранение
В хорошо укупоренной таре.
Применение
KCl: источникионов калия (применяют при гипокалиемии); антиаритмическое средство.
NaCl: выпускают в форме порошка, таблеток и ампульного раствора.
Дата добавления: 2018-04-04; просмотров: 941; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
