Г) Производные угольной кислоты
ЭЛЕМЕНТЫ IVА ГРУППЫ
Общая характеристика
Углерод
Соединения углерода
А) оксид углерода (II)
б) оксид углерода (IV) СО2
в) Угольная кислота Н3СО3 и ее соли
Г) Производные угольной кислоты
Д) Циан и его производные
Кремний
5. Соединения кремния. (Диоксид кремния SiO2 и другие соединения кремния)
Кремниевые кислоты и силикаты
A) Кремниевые кислоты и их соли
Б) Природные силикаты
в) Искусственные силикаты (самостоятельно: стекла и керамика)
Германий и его соединения
Олово
Соединения олова
Свинец
Соединения свинца
ОБЩАЯ ХАРАКТЕРИСТИКА
Элементы и их символы: углерод С, кремний Si, германий Gе, олово Sn, свинец Pb.
Степень окисления. Для элементов IVА группы характерны степени окисления (+2) и (+4), реже реализуется степень окисления (-4). Устойчивость состояния окисления (+4) понижается с ростом порядкового номера элемента (от С к Рb), для свинца более устойчива степень окисления (+2).
Свойства (табл. 1).
Таблица 1.
Свойства элементов IVа группы
| Углерод С | Кремний Si | Германий Ge | Олово Sn | Свинец Pb | |||
| Порядковый номер элемента | 6 | 14 | 32 | 50 | 82 | ||
| Относительная атомная масса | 12,011 | 28,086 | 72,61 | 118,711 | 207,2 | ||
| Содержание в земной коре, % | 8,7*10-2 | 25,8 | 5,6*10-4 | 3,5*10-3 | 1,8*10-3 | ||
| Температура плавления, °С | 3850 | 1423 | 959 | 232 | 327 | ||
| Плотность, г/см3 | 3,51ал, 2,22гр | 2,33 | 5,35 | 7,28 | 11,34 | ||
| Электро отрицательность | 2,5 | 1,8 | 1,82 | 1,8 | 1,6 | ||
| Степень окисления | +4, +2, -4 | +4, (+2), (-4) | +4, (+2) | +4, +2 | +4, +2 | ||
| Гидроксиды элементов (IV) | H2CO3 | H4SiO4(SiO2*nH2O) | GeO2*nH2O | SnO2*nH2O | PbO2*nH2O | ||
| Средн.кислота | Слаб кислота | Амфотерные с преобл. кисл. свойств
| |||||
| Гидроксиды элементов (II) | -- | -- | Ge(OH)2 | Sn(OH)2 | Pb(OH)2 | ||
| Амфотерные с преобл. основных. свойств | |||||||
| Название аниона | Карбонат | Силикат | Германат | Станнат | Плюмбат | ||
Металлический характер простых веществ увеличивается от углерода к свинцу. По физическим свойствам простые вещества углерода — алмаз и графит — неметаллы (у графита обнаруживаются некоторые признаки металлов), кремний и германий проявляют промежуточные свойства, являясь полупроводниками; олово и свинец — типичные металлы. По химическим свойствам С и Si — неметаллы; в ряду Gе, Si, Рb увеличивается химическая активность их как металлов, причем у Gе преобладают еще неметаллические свойства, а у Рb — металлические.
Гидроксиды углерода и кремния в степени окисления (+4) отвечают кислотам, а гидроксиды германия (+4), олова (+4) и свинца (+4) — амфотерные соединения, кислотные свойства которых выражены сильнее, чем у гидроксидов соответствующих элементов IIIА группы. Гидроксиды элементов в степени окисления (+2) известны только для германия, олова и свинца, они более основны, чем гидроксиды соответствующих элементов в степени окисления (+4), но в целом все же амфотерны.
|
|
|
Устойчивость водородных соединений элементов IVА группы понижается от углерода к свинцу. Поскольку атомы углерода могут практически неограниченно соединяться друг с другом в цепи и циклы, может быть получено также практически неограниченное число углеводородов. Для атомов кремния соединение в цепи и циклы выражено уже достаточно слабо, а для атомов германия, олова, и свинца это явление совсем не характерно.
УГЛЕРОД
Открытие. Углерод С известен с древнейших времен; признан химическим элементом в 1775 г. (Лавуазье, Франция).
Распространение в природе. Углерод — основная составная часть всех организмов; тринадцатый элемент по распространенности на Земле (в литосфере, атмосфере и гидросфере). Встречается как в свободном виде (алмаз, графит), так и в связанном состоянии (диоксид углерода, карбонаты, уголь, нефть, природный газ, сланцевое масло, битумы). Масса углерода, содержащегося в атмосфере в виде СО2, составляет »6,0*1011 т, что примерно только в два раза больше, чем масса углерода в живой материи.
|
|
|
Минералы:магнезит MgCO3, кальцит (известковый шпат, известняк, мел, мрамор) СаСО3, доломит СаМg(СО3)2, стронцианит SrСO3, витерит ВаСО3, родохрозит (марганцевый шпат, малиновый шпат) МnСО3, сидерит (железный шпат) FеСО3, малахит Сu2СО3(ОН)2, смитсонит (цинковый шпат) ZnСО3, церуссит (белая свинцовая руда) РbСО3.
Многообразие углеродсодержащих соединений. В противоположность атомам других элементов, атомы углерода в практически неограниченном числе могут соединяться в цени и циклы. Поэтому известно огромное число углеродсодержащих соединений (около пяти миллионов), в то время как число соединений, не содержащих углерода, относительно невелико (»300000). В настоящее время ежегодно синтезируют около 250000 новых соединений углерода. Большинство соединений углерода относятся к органическим веществам. К неорганическим соединениям углерода относят простейшие из них: оксиды, сульфиды, угольную кислоту, карбонаты, карбиды, цианиды и некоторые др.
Аллотропные модификации. В свободном состоянии углерод находится в виде двух модификаций — алмаза и графита. Ранее называли аморфным углеродом получаемые в особых условиях сажу, ретортный графит, активный уголь и другие мелкокристаллические разновидности графита, которые по реакционной способности и некоторым другим свойствам сильно отличаются от крупнокристаллического графита.
|
|
|
Свойства. Все разновидности углерода не имеют вкуса и запаха. Химически растворяются в расплавленных металлах.
При обычных температурах химически инертны. Углерод при избытке кислорода сгорает до диоксида углерода СО2 (полное сгорание), а при недостатке кислорода — до монооксида углерода СО (неполное сгорание). Угольная пыль в воздухе может оказаться взрывчатой. При повышенных температурах углерод реагирует с различными металлами и неметаллами. Оксиды многих металлов при взаимодействии с углеродом восстанавливаются до металлов. Некоторые свойства алмаза и графита представлены в табл. 2.
Таблица 2
Свойства алмаза и графита
| Алмаз | Графит | |
| Окраска | Белая | Серо-черная |
| Твердость | Наивысшая | Низкая |
| Кристаллическая решетка | Кубическая | Гексагональная |
| Плотность, г/см3 | 3,51 | 2,22 |
| Электропроводимость | Отсутствует (изолятор) | Высокая (проводник) |
| Поведение при нагревании | При 1500°С ® графит | Выше 3800°С сублимирует |
Алмаз — благородный камень, имеет наибольшую твердость среди всех природных веществ, шлифуется только собственным порошком. В чистом состоянии представляет собой прозрачные бесцветные или белые кристаллы с сильным преломляющим эффектом. После обработки (огранка, шлифовка) получают бриллианты, массу которых выражают в каратах (1 карат = 200 мг). Менее чистые алмазы обычно окрашенные и мутные, например серо-голубой и черный карбонадо,
Месторождения алмазов встречаются в Южной и Экваториальной Африке, Сибири, Бразилии, Индии. Разработано искусственное получение алмазов (1955 г.) из графита при температуре 2000°С и давлении 5300 МПа, обычно образуются мелкие кристаллы массой в несколько каратов. Применяют для изготовления режущих инструментов (сверл и др.), предназначенных, в частности, для резки стекла, при волочении проволоки, как опора для подшипников и других движущихся частей в точных измерительных инструментах.
Графитсостоит из углеродных слоев, связанных друг с другом, но достаточно подвижных (слоистая решетка), поэтому графит достаточно мягок, легко расщепляется на слои и пачкает почти любую поверхность. Может быть искусственно получен из угля. Применяют для изготовления стержней для карандашей, электродов, плавильных тиглей (материал — прессованная смесь графита с глиной), в качестве пигмента, как добавку в антикоррозионные краски; служит замедлителем в ядерных реакторах.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при неполном сгорании соединений углерода, в технике ее получают из ацетилена или из нафталина. Применяют в качестве наполнителя для резин (повышает устойчивость автопокрышек к абразивному износу; сажа составляет приблизительно одну треть массы автомобильной покрышки), как компонент сухих гальванических элементов, печатных красок, крема для обуви, туши и др.
Активный уголь получают из органических материалов (древесины, кости,
сахара, крови, ореховой скорлупы) путем пропитывания раствором хлорида цинка (II) или карбоната калия и последующего нагревания при недостатке воздуха. Содержит огромное количество пор и поэтому обладает очень большой поверхностью (1 г угля имеет поверхность 800 м2), вследствие чего обладает очень высокой способностью адсорбировать многие газы и растворенные вещества. Применяют для очистки, разделения и извлечения различных веществ, например для извлечения бензола из светильного газа, ксилола из отходов текстильных печатных паст, дисульфида углерода из отходов производства вискозного волокна, растворителей из отходов лакокрасочной промышленности, для обесцвечивания паточного сиропа, для очистки этанола от сивушных масел, как наполнитель в противогазах, сорбирующее средстве в медицине.
СОЕДИНЕНИЯ УГЛЕРОДА
А) оксид углерода (II) СО
Строение. В рамках метода валентных связей молекула СО имеет строение :СºО:. Можно считать, что третья связь образована по донорно-акцепторному механизму (кислород — донор электронной пары, углерод — акцептор).
Физиологическое действие. Очень ядовит, смертельная доза СО в воздухе составляет 0,2%. С гемоглобином крови СО связывается прочнее, чем кислород, тем самым блокирует перенос кислорода в организме. Признаки отравления малыми дозами: кровь необычно яркой окраски, сильная головная боль, иногда потеря сознания.
Получение. 1. Сжигание углерода в свободном виде или соединений углерода (кокс, уголь, бензин) при температурах выше 1000 °С и при недостатке кислорода: 2C + O2 = 2CO.
Вследствие протекания этой реакции выхлопные газы автомобильных двигателей обязательно содержат СО; также содержат СО отходящие газы печей при плохой тяге и табачный дым (до 4%).
2. Восстановление диоксида углерода при помощи раскаленного кокса, например, в доменных печах (равновесие Будуара): СО2 + С « 2СО.
3. Восстановление водяного пара раскаленным коксом или другими носителями углерода:
С + Н2О = СО + H2
4. Действие концентрированной серной кислоты на муравьиную кислоту (лабораторный способ): HCOOH  со + н2о.
со + н2о.
Свойства. Бесцветный газ без запаха. По плотности тяжелее воздуха, Сжижается только при очень низких температурах, т. кип. -192°С. На воздухе сгорает (синеватое пламя). Очень мало растворим в воде. Поглощается активным углем, а также твердым фильтрующим слоем, содержащим I2О3.
Химически инертен, однако при участии катализаторов реагирует с кислородом с образованием углеводородов (синтез Фишера — Тропша) или спиртов (синтез метанола). С переходными металлами оксид углерода образует очень летучие, ядовитые и горючие карбонилы, например [Ni(СО)4], [Со2(СО)9], [Fе (СО)5].
Технические газы, содержащие СО. Воздушный газ (генераторный газ) — смесь СО + 2К2. Образуется по экзотермической реакции при газификации угля или кокса с использованием воздуха в специальных генераторах: 2С + О2 + 4N2 = 2СО + 4N2.
Применяют в качестве горючего газа и в синтезе аммиака.
Водяной газ —смесь СО + Н2.
Смешанный газ —это СО, Н2 и N2. Получают при газификации порошкообразного угля смесью водяного пара и воздуха, обогащенного кислородом; аналогичный по составу газ образуется также при риформинге газообразных углеводородов и газификации жидких углеводородов под давлением. Применяют при синтезе аммиака.
Коксовый газ и бытовой газ —смесь Н2, СН4, СО и др. Получают при коксовании угля; при газификации бурого угля (под давлением 2,2 МПа) с помощью водяного пара и кислорода образуется сходный, но более бедный метаном сжатый газ. Применяют в качестве горючего газа.
Б) оксид углерода (IV) СО2
Тривиальное название: углекислый газ.
Распространение в природе. В воздухе содержится 0,03 % (об.). Входит в состав технических горючих газов, вулканических газов, природных (минеральных) вод. Атмосфера Венеры на »95 % состоит из СО2.
Физиологическое действие. Диоксид углерода ассимилируется в процессе фотосинтеза зелеными растениями с помощью имеющегося в них хлорофилла при поглощении солнечной энергии. При этом в растениях образуются органические вещества (в первую очередь — глюкоза), а кислород освобождается и выделяется в атмосферу. Поглощенная энергия при диссимиляции в организмах животных и растений снова высвобождается, этим замыкается элементарный цикл развития живого организма. Диссимиляция органических веществ в организмах — это процесс их окисления с помощью усвоенного при дыхании кислорода в присутствии ферментов с образованием диоксида углерода и воды:
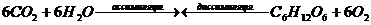
Из всей падающей на Землю солнечной энергии »0,12 % фотохимически усваивается растениями. Зеленые листья площадью 1 м2 за время освещения Солнцем в течение 1 ч производят из СО2 1 г виноградного сахара.
Известно, что люди выдыхают воздушную смесь, содержащую 4 % СО2. Чистый СО2 действует удушающее, при содержании в воздухе 15% СО2 возникает головокружение, а иногда возможна потеря сознания.
Получение.
1. Полное сгорание кокса: С + О2 == СО2
Для очистки СО2 от примесей газ пропускают через раствор К2СO3 иа холоду, СО2 поглощается и в результате в растворе образуется КНСО3. Примеси проходят через раствор, а СО2 выделяют из раствора кипячением (термическое разложение гидрокарбоната).
2. Обжиг известняка и других карбонатов: СаСО3 = СаО + СО2
3. Обработка карбонатов (например, мрамора) сильной кислотой:
СаСО3 + 2НС1 = СаС12 + Н2О + СО2
4. Спиртовое брожение: С6Н12О6 = 2С2Н5ОН + 2СО2.
Физические свойства. Бесцветный газ со слабым кислым вкусом и запахом, в 1,5 раза тяжелее воздуха. Его можно «переливать» из сосуда в сосуд; обычно собирается на дне подвалов, колодцев и пещер. СО2 — негорючий газ (гасит пламя). Достаточно хорошо растворим в холодной воде, особенно под давлением.
При 20 °С под давлением 5 МПа (» 50 атм) диоксид углерода сжижается.
Жидкий СО2 хранят в стальных баллонах. При отборе из баллона газообразного СО, часть жидкости испаряется и давление в системе поддерживается постоянным до тех пор, пока в баллоне не израсходуется вся жидкость. Поэтому остаток СО2 в баллоне нельзя определить по манометру (расход СО2 находят по изменению массы баллона). При вытекании жидкого СО2 из баллона (в наклонном состоянии) происходит мгновенное испарение газа при быстром охлаждении и часть жидкости замерзает, образуя снегообразную массу. Спрессованный твердый СО2 (сухой лед) используется для временного поддержания охлажденного состояния продуктов; сухой лед не плавится, а сублимирует при -78 °С. Смесь сухого льда с ацетоном используется в лаборатории как охлаждающая смесь до температуры -90 °С.
Химические свойства. Диоксид углерода с водой образует угольную кислоту (см. ниже); с основными гидроксидами — карбонаты и гидрокарбонаты (на этом основано затвердевание известкового строительного раствора). Восстанавливается магнием до углерода:
СО2 + 2Мg = С +MgO
Обнаружение. По помутнению водного раствора гидроксида бария (или кальция) при контакте с СО2: Ва(ОН)2 + СO2 = ВаСО3 + Н2О.
Газ пропускают через баритовую (или известковую) воду или над каплей этой воды, помещенной на часовое стекло.
Применение. Диоксид углерода используется для промышленного синтеза карбамида, салициловой кислоты и других химических продуктов; в огнетушителях; как инертная среда для хранения легковоспламеняющихся жидкостей, для сварки в атмосфере этого газа, для отверждения содержащей воду формовочной земли, для приготовления газированных напитков, как охлаждающий агент (сухой лед и его смеси).
В) Угольная кислота Н3СО3 и ее соли
Угольная кислота в чистом виде не получена, хотя молекулы состава Н2СО3 существуют в газовой форме и в водном растворе. В водном растворе имеет место равновесие:
со2 + н2о « н2со3 « н+ + нсо3- « 2н+ + со32-
Этим объясняются кислотные свойства Н2СО3. При комнатной температуре равновесие сильно смещено в направлении образования СО2 и Н2О, и в связанном состоянии оказывается только 1 % молекул СО2 и Н2О, причем большая часть продукта имеет полигидратный состав СО2*nН2О, а не Н2СО3. Полигидрат обладает очень слабыми кислотными свойствами, а Н2СО3 — кислота средней силы, но так как содержание Н2СО3 в растворе мало, то в целом кислотность такого раствора весьма мала. Полигидрат СО2*nН2О и молекулы Н2СО3 термически неустойчивы, поэтому при подкислении растворов карбонатов выделяется СО2. Вместе с тем при пропускании диоксида углерода через растворы солей более слабых кислот последние могут быть выделены в свободном виде или в виде кислотных оксидов (SiO2, НСN, С6Н5ОН и др.).
Соли (и эфиры) угольной кислоты называются карбонатами. Существуют средние карбонаты с анионом СО32- и кислые карбонаты с анионом НСО3- (гидрокарбонат-ион, ранее назывался бикарбонат-ион).
Наибольшее практическое значение имеют карбонат натрия Nа2СО3 (тривиальное название кальцинированная сода) и его кристаллогидрат Nа2СО3*10Н2О (сода), гидрокарбонат натрия NаНСО3 (натрон, питьевая сода), карбонат калия К2СО3 (поташ), гидроксид-карбонат свинца (II) 2РbСO3•Рb(ОН)2 (свинцовые белила).
Карбонаты при нагревании разлагаются на оксид металла и диоксид углерода, например:
СuСО3 = СuО + СО2
Чем сильнее основные свойства оксида металла, тем выше температура разложения соответствующего карбоната. Карбонат алюминия А12(СО3)3 полностью неустойчив уже при комнатной температуре.
При подкислении растворов карбонатов или при обработке твердых карбонатов сильными кислотами неустойчивая в свободном виде угольная кислота выделяется в виде соответствующего ей оксида СО2, например:
Nа2СО3 + 2НС1 = 2NаС1 + Н2О + СО2, СаСО3 + 2НNO3 = Са(NО3)2 + Н2О + СО2
Способ обнаружения карбонатов основан на обработке их сильной кислотой и последующем пропускании отходящего газа через баритовую воду.
Карбиды — это соединения между углеродом и более электроположительными (более металличными) элементами. Существуют карбиды, которые при гидролизе чистой или подкисленной водой образуют углеводороды. Так, карбид кальция СаС2 выделяет ацетилен С2Н2, а карбид алюминия А14С3 — метан СН4:
СаС2 + 2Н3О+ = Са2+ + 2Н2О + С2Н2, А14С3 + 12Н2О = 4А1(ОН)3 + 3СН4
Известны взрывоопасные, термически малоустойчивые карбиды, такие как карбид серебра Аg2С3 и меди Сu2С2, они разлагаются на металл и уголь. Особой твердостью отличаются карбид бора В4С, карбид кремния SiС и карбид вольфрама W2С. Карбид железа Fе3С (цементит) является компонентом железоуглеродных сплавов (сталь, чугун).
г) Производные угольной кислоты
Фосген (оксид-дихлорид углерода) СС12О — бесцветный газ со слабым сенным запахом, т. кип. +8°С Очень ядовит, в первую мировую войну использовался как удушающее отравляющее вещество. Получают из монооксида углерода СО и хлора С12. Применяют в синтезе полиуретанов.
Сероуглерод (дисульфид углерода) СS2 — полное тиопроизводное диоксида углерода. Получают из метана (природного газа) обработкой паром серы при 600°С с участием катализатора: CH4 + 4S = CS2 + 2H2S или из продукта полукоксования бурого угля и парообразной серы при 900°С: С + 2S=СS2.
Представляет собой бесцветную жидкость с запахом редьки или прелого сена. Т. пл. -109°С, т. кип. 46°С, очень быстро улетучивается уже при комнатной температуре. Не растворим в воде. Растворяет жиры, смолы, каучук, фосфор, серу, йод. Ядовит.
Сероуглерод сильно огнеопасен, при поджигании на воздухе (горит голубым пламенем) образует диоксиды серы и углерода:
При недостатке воздуха получается свободная сера. При действии спиртового раствора гидроксида калия образуется ксантогенат калия: С2Н5ОН + КОН + СS2 = 3С(ОС2Н5) (SК) + Н2О.
Применяют для получения вискозного волокна, флотоагентов (ксантогенаты), тетрахлорметана, для дезинфекции почвы.
Оксид-сульфид углерода СОS — неполное тиопроизводное угольной кислоты. Бесцветный воспламеняющийся газ без запаха, т. кип. -50,2°С. Получается как побочный продукт в производстве синтез-газа.
Карбамид (мочевина) СО(NН2)2 — диамид угольной кислоты. Моноамидпроизводное ОНСОNН3 называют карбаминовой кислотой, она в свободном состоянии не получена, но известны ее эфиры — уретаны состава ОRСОNН2, где R — углеводородный радикал.
Карбамид был обнаружен в моче, впервые синтезирован в 1828 г. (Вёлер, Германия) по реакции перегруппировки цианата аммония при нагревании: NН4ОСN ® СО(NН2)2.
Эта реакция явилась исторически первым синтезом органического соединения из неорганического реагента.
Карбамид получают из аммиака и диоксида углерода при 150 – 200°С и 10—20, реакция протекает в жидкой фазе: 2NН3 + СО2 = СО(NН2)2 + Н2О.
После снижения давления смесь карбамида и воды выпаривается, образующийся расплавленный карбамид гранулируют, а неиспользованные реагенты возвращают в производственный цикл.
Карбамид представляет собой бесцветное кристаллическое вещество без запаха, с горьким вкусом, т. пл. 133°С. Хорошо растворим в воде и этаноле, водный раствор имеет нейтральную реакцию, но несмотря на это образуются соли (типа аммониевых) с сильными кислотами, например малорастворимый (Н2N—СО—NН3+) (NО3-) нитрат урония. Карбамид при нагревании сначала переходит в биурет Н2N—СО—NН—СО—NН2, а затем при 350 – 400°С — в ме-ламин. С неразветвленными алканами карбамид образует кристаллические клатраты.
Карбамид применяют в качестве азотного удобрения и добавки в корма, для получения меламинных и карбамидных смол, для выделения из углеводородных смесей и нефти неразветвленных алканов (с С10 и более), используемых для производства моющих средств.
Д) Циан и его производные
Циан, точнее дициан, С2N2, структурная формула NºС—СºЫ, бесцветный газ, т. кип. -21,4°С. Ядовит. Образуется при нагревании цианида ртути(П) Нg(СN)2. Сгорает красно-фиолетовым пламенем, при этом развивается очень высокая температура (с О2 при нормальном давлении температура пламени достигает 4500°С): С2N2 + 2O2 = 2СО2 + N2.
Еще более высокую (и наивысшую) температуру пламени можно получить при сгорании динитрида тетрауглерода (дицианоацетилена) С4N2, или NºO—СºС—сºN. При сгорании этого соединения в озоне при 4 МПа температура достигает почти 6000°С.
Циан можно назвать «псевдогалогеном», а соединения циана — «псевдогалогенидами», поскольку цианидион СN- и галогенидионы очень похожи по свойствам.
Циановодород НСN — бесцветная жидкость с характерным запахом горького миндаля, т. кип. »26°С. Чрезвычайно ядовит. Смертельная доза — 50 мг НСN, продолжительность действия — несколько секунд, циановодород блокирует дыхательные ферменты и вызывает удушье. Хорошо растворим в воде. Водный раствор НСN называется циановодородной (синильной) кислотой; кислотные свойства НСN выражены слабо.
В лаборатории НСN получают из цианидов по реакции обмена с сильными кислотами; техническое получение основано на взаимодействии метана с аммиаком в присутствии воздуха с участием платино-родиевого катализатора при 800—1000°С (способ Андрусова): СН4 + NН3 = НСN + 3Н2
Реакция эндотермическая; необходимую теплоту поставляет образующийся водород, который сгорает и нагревает реакционную смесь.
Циановодород — промежуточный продукт в производстве органического стекла и полиакрилнитрильных волокон, а также некоторых ядохимикатов. НСN присоединяется к ненасыщенным органическим соединениям, таким как альдегиды и кетоны, с образованием нитрилов, которые омыляются и переходят в карбоновые кислоты.
Цианиды — соли циановодорода, например цианид натрия NаСN и цианид калия КСN. Цианиды щелочных элементов хорошо растворимы в воде, Очень ядовиты (смертельная доза 150 мг), при хранении во влажном воздухе переходят в карбонаты с выделением циановодорода: 2КСN + Н2О + СО2 = К2СО3 + 2НСN отравляя тем самым атмосферу помещений. Применяют для приготовления гальванических электролитов, для выделения золота и серебра цианидо-щелочными способами, для получения синильной кислоты, а также красной кровяной соли, берлинской лазури и других цианокомплексов. Распространенные комплексные цианиды:
К4[Fе(СN)6] — гексацианоферрат (II) калия, желтая кровяная соль;
К3[Fе(СN)6]— гексацианоферрат (III) калия, красная кровяная соль;
КFе3+[Fе2+(СN)6] — гексацианоферрат (II) железа (III)-калия, растворимая берлинская лазурь (турнбулева синь);
Fе43+[Fе2+(СN)6]3 — гексацианоферрат (II) железа (III), нерастворимая берлинская лазурь;
Nа2[Fе(NО+) (СN)5] — пентацианонитрозилийферрат (II) натрия, нитропруссид натрия.
В гальванотехнике используются:
Nа3[Сu(СN)4] — тетрацианокупрат (I) натрия;
Nа2[Zn(СN)4] — тетрацианоцинкат (II) натрия;
Nа2[Сd1(СN)4] — тетрацианокадмат (II) натрия;
К[Аg(СN)2] — дицианоаргентат (I) калия;
К[Аg(СN)2] — дицианоаурат (I) калия.
Из других соединений циана практическое значение имеют циановая кислота НОСN и ее соли — цианаты; гремучая кислота НСNО и ее соли — фульминаты, например Нg(СNО)2 — фульминат ртути (II), используемый в качестве детонатора; цианамид NН2СN, или NºС — NН2, цианамид кальция СаСN2 и дициандиамид NH = C(NH2)—NH—СºN, это соединение и NН2СN используются в производстве аминопластов.
Тиоциан и его производные
Тиоциан (NСS)2, или NCS—SСN, — белые кристаллы. По свойствам представляет собой аналог галогенов, но очень неустойчивый. Устаревшее название диродан.
Тиоцианат водорода НNСS (устаревшее название роданистоводородная кислота) получают при кипячении растворов цианидов с серой: KCN + S = KNCS.
Образует соли — тиоцианаты (ранее — роданиды).
Тиоцианат калия KNCS — белое кристаллическое вещество. Реагент на ионы Fе3+, с которыми образует тиоцианатные комплексы железа (III), в частности нейтральный тиоцианат железа (III) Fе(NСS)3, имеющие интенсивную красную окраску.
КРЕМНИЙ
Открытие. Кремний Si впервые выделен в свободном виде в 1822 г. (Берцелиус, Швеция) при восстановлении тетрафторида кремния с помощью калия.
Распространение в природе. Кремний — второй элемент по распространенности в литосфере Земли (16,3 %. Находится только в связанном виде в различных горных породах и продуктах их выветривания, в частности в виде оксида и силикатов, из которых на 90 % состоит земная кора.
Получение.
1. Прокаливание смеси кварца и кокса или дикарбида кальция в электрической печи в небольших количествах.
2. Из кремнезема алюмотермическим методом.
3. Очень чистые кристаллы кремния выращивают методом зонной плавки технического кремния.
Свойства. Темно-серый со слабым металлическим блеском. Твердое хрупкое кристаллическое вещество. Имеет темно-серую окраску со слабым металлическим блеском.
Кремний не реагирует с кислотами и в раствор не переходит; только так, называемый аморфный кремний, измельченный в очень тонкий порошок, реагирует со фтороводородной кислотой и дает растворимые соединения. Взаимодействует с щелочами в горячем растворе, образуя силикаты и водород: Si + 4NаОН = Na4Si O4 + 2Н2, Si + 2NаОН + Н2О = Nа2Si O3 + 2Н2.
В присутствии порошка меди кремний реагирует с хлорметаном СН3С1 (аналогично с хлорэтаном С2Н5С1), переходя в соответствующие диалкилхлорсиланы, например:
Si + 2CH3Cl = (CH3)2 SiCl2 (диметилдихлорсилан).
Диалкилдихлорсиланы способны частично разлагаться, давая моноалкилтрихлорсиланы и триалкилмонохлорсиланы, например СН SiС13 и (СН3)3SiСl. Эти соединения являются промежуточными продуктами в производстве силиконов.
Применение. Технический кремний используется для получения силиконов; особо чистый кремний — материал в полупроводниковой технике, микроэлектронике и в производстве солнечных батарей. Сплав с железом — ферросилиций — служит добавкой для легирования сталей.
СОЕДИНЕНИЯ КРЕМНИЯ
Диоксид кремния SiO2 Тривиальное название: кремнезем.
Распространение в природе. Кристаллический SiO2 находится в виде минерала кварца, который является основной составной частью гранитов, гнейсов, песчаников и морского песка. Хорошо образованные кристаллы кварца, часто с окрашивающими его примесями, представляют собой следующие минералы:
горный хрусталь (белый, прозрачный);
дымчатый кварц или раухтопаз (от серого до коричневого);
розовый кварц.
Кроме того, к разновидностям кварца относятся водосодержащие минералы: опал, халцедон (агат, карнеол, яшма) и кремень (давший название элементу).
Диоксид кремния входит в осадочную горную породу — кизельгур (диатомит, инфузорная земля), который состоит из опаловых панцирей диатомовых водорослей.
Кристаллы SiO2 содержатся в некоторых растительных и животных организмах (отдельные злаки, камыш, бамбук, кремнистые губки и водоросли).
Получение. Большие кристаллы (монокристаллы) кварца искусственно выращивают гидротермальным методом из водных растворов SiO2 при температуре 300 – 400°С и давлении 100 –200 МПа.
Свойства. Белый порошок или белые (часто прозрачные) кристаллы. В зависимости от вида полиморфной модификации (кварц, тридимит, кристобалит) плавится в области 1500 – 1705°С. Расплавленный кремнезем затвердевает в аморфную стеклообразную массу (кварцевое стекло). Разрушается только фтороводородной (плавиковой) кислотой, при недостатке кислоты образуется тетрафторид кремния SiF4, а при избытке — гексафторосиликат (IV) водорода (гексафторокремниевая кислота) Н2[SiF6]. С расплавленными щелочами и с карбонатами щелочных элементов при нагревании диоксид кремния образует различные силикаты.
Применение. Чистый кварцевый песок используется для изготовления прозрачного кварцевого стекла и непрозрачного плавленого кварца. Песок разной степени чистоты идет на производство обычного стекла, растворимого стекла, фарфора, строительных растворов, применяется как формовочная земля в металлургии, для получения кремния. Горный хрусталь — драгоценный камень в ювелирном деле и материал для изготовления оптических инструментов. Кизельгур служит предохранительным и упаковочным материалом, обладающим хорошей поглотительной способностью. Кристаллы кварца используются в кварцевых часах, в кварцевых резонаторах для получения ультразвука.
Кварцевое стекло по сравнению с обычным стеклом размягчается при более высокой температуре, более устойчиво к большим перепадам температур и к действию различных химических реагентов, прозрачно для УФ-излучения. Используется для изготовления специальной химической посуды и различных лабораторных установок, в том числе УФ-ламп.
Другие соединения кремния
Силаны — водородные соединения кремния, например моносилан SiН4, дисилан Si2Н6. По строению силаны соответствуют аналогичным алканам. Почти все силаны малоустойчивы и самовоспламеняются на воздухе. Низшие силаны — газы, остальные — летучие жидкости.
Силициды — соединения кремния с металлами. Силицид магния Мn2Si получается при нагревании SiO2 (кварцевого песка) с порошкообразным магнием, при обработке хлороводородной кислотой дает силаны, которые на воздухе тотчас же воспламеняются.
Тетрафторид кремния SiF4 — бесцветный газ. Образуется при взаимодействии силикатов с фтороводородной кислотой. При избытке фтороводородной кислоты в водном растворе образуются гексафторосиликаты (IV) металлов. Фторосиликаты натрия, калия, кальция и бария очень мало растворимы в воде; их используют для пропитки древесины против огня и гниения, а также как замутнители для эмалей. Растворимый в воде гексафторосиликат (IV) аммония применяется для отверждения и уплотнения известьсодержащих строительных материалов, образующийся гексафторосиликат (IV) кальция Са[SiF6] закупоривает поры в строительных камнях и кирпичах.
Тетрахлорид кремния SiСl4 — бесцветная жидкость, т. кип. 57,6°С. Во влажном воздухе дымит вследствие протекания полного гидролиза: SiСl4 + 2Н2O = SiO2 + 4HCl.
Разлагается в воде с осаждением гидратированного диоксида кремния и в хлороводородной кислоте.
Монокарбид кремния (карборунд) SiС — очень твердые, белые, непрозрачные кристаллы, т. пл. более 2600°С. Технический продукт окрашен в серый цвет. Получают сплавлением песка и угля в электрической печи. Применяют как шлифовальное и полировальное средство, а также для изготовления сопротивления.
Силиконы — кремнийорганические полимеры, состоящие из цепей, а также более сложных образований (трехмерные сетки), боковые связи атомов кремния насыщены органическими остатками (алкильными и другими группами).
Дата добавления: 2018-04-04; просмотров: 536; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
