ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ И ИХ СОЕДИНЕНИЯ
ЭЛЕМЕНТЫ IIIА ГРУППЫ
Общая характеристика
Бор гидроксид бора
Другие соединения бора
Алюминий
Соединения алюминия
Галлий, индий, таллий и их соединения
ОБЩАЯ ХАРАКТЕРИСТИКА
Элементы и их символы: бор В, алюминий А1, галлий Gа, индий In, таллий Т1.
Степень окисления. Для всех элементов IIIА группы в их соединениях характерна общая степень окисления (+3), для таллия более устойчива и распространена степень окисления (+1).
Свойства (табл. 1). Металлический характер элементов возрастает от В к Т1: бор — типичный неметалл, индий и таллий — металлы.
Таблица 1.
Свойства элементов IIIА группы
| Бор В | Алюминий Al | Галлий Ga | Индий In | Таллий Tl | |||
| Порядковый номер | 5 | 13 | 31 | 49 | 81 | ||
| Отн. атомная масса | 10,811 | 26,982 | 69,723 | 114,82 | 204,383 | ||
| Содержание в земной коре, % | 1,6*10-3 | 7,57 | 1,4*10-3 | 1*10-5 | 3*10-5 | ||
| Темпер. Плавления, °С | »2400 | 660 | 29,8 | 156 | 305 | ||
| Плотность, г/см3 | 2,33 | 2,80 | 5,91 | 7,31 | 11,84 | ||
| Степень окисления | +3 | +3 | +3; (+1) | +3; (+1) | +1; +3 | ||
| Возрастание | |||||||
| Реакционная способность | ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾® | ||||||
| Гидроксиды | B(OH)3 | Al(OH)3 | Ga(OH)3 | In(OH)3 | ¾ | ||
| Возрастание | |||||||
| ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
| |||||||
Гидроксиды элементов IIIА группы мало растворимы в воде. Гидроксид бора В(ОН)3 (ранее формулу записывали как Н3ВО3) обладает слабыми кислотными свойствами в водном растворе, гидроксиды алюминия, галлия и индия амфотерны в уменьшающейся степени, а гидроксид таллия(I) ТiOН — сильное основание. По сравнению с соответствующими соединениями элементов IIА группы основные свойства гидроксидов элементов IIIА группы выражены в меньшей степени.
Все бораты (производные бора), кроме боратов щелочных элементов, мало растворимы в воде. Из солей А13+, Gа3+, In3+ и Т13+ хорошо растворимы в воде хлориды, сульфаты и нитраты, мало растворимы — фториды и ортофосфаты. Карбонаты этих же элементов малоустойчивы и при комнатной температуре разлагаются на оксид соответствующего металла и диоксид углерода, а при попытке их получения по реакции обмена в водном растворе выпадает осадок соответствующего гидроксида и выделяется диоксид углерода.
БОР, гидроксид бора
Открытие. Бор В впервые выделен в свободном виде в 1808 г. (Гей-Люссак и Тенар, Франция) путем восстановления оксида бора калием (продукт получился сильно загрязненным). Чистый кристаллический бор получен только в начале XX века.
|
|
|
Распространение в природе. Относительно редкий элемент. Находится только в химически связанном виде. Гидроксид бора содержится в воде некоторых минеральных вулканических источников. Минералы: борацит (стассфуртит) Мg3(В7О13)С1; кернит Na2В4О7-4Н2O; тинкал (бура) Nа2В4О7*10Н2О; сассолин В(ОН)3.
Получение.
1. Восстановление В2О3 с помощью магния или алюминия.
2. Электролиз расплава смеси К[ВF] + В(ОН)3 + КС1.
Свойства. Аморфный бор — коричневый порошок, не имеющий запаха. Сгорает на воздухе при температуре выше 700°С до В2О3. С водой не реагирует. Окисляется концентрированной азотной кислотой: В + 3HNO3 = В(ОН)3 + 3NО2.
Кристаллический бор образует очень твердые, серо-черные, блестящие кристаллы. Химически более инертен, чем аморфный бор.
Применение. В виде ферробора (железа с 10—20 % бора) используется для получения специальных сплавов и борирования поверхности стальных изделий с целью повышения их механической прочности и коррозионной стойкости.
Гидроксид бора В(ОН)3. Формулу Н3ВО3 и соответственно название "борная кислота" применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т.е. молекулы В(ОН)3 не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
|
|
|
Обнаружение. Переводят гидроксид бора (или любые бораты) по реакции с этанолом и серной кислотой в триэтилборат В(ОС2Н5)3, который при горении дает характерное пламя, окрашенное в зеленый цвет.
Физиологическое действие. Доза в 5г В(ОН)3 может привести к смерти человека, очень малые дозы, периодически вводимые в организм, вызывают сильное исхудание.
Получение. Обработка серной кислотой тетрабората натрия: Nа2В4О7 + Н2SО4 + 5Н2О = 4В(ОН)3 + Nа2SO4.
Свойства. Белые, не имеющие запаха чешуйки. Очень мало растворим в холодной, лучше — в горячей воде. Водный раствор имеет слабокислую реакцию вследствие протекания обратимой реакции с образованием устойчивого комплекса — тетрагидроксоборат (III) иона: В(ОН)3 + Н2O = [В(ОН)4]- + Н+; Н+ + Н2О = Н3О+
Применение. Наружное дезинфицирующее средство (борная вода, борная мазь). Используется для получения эмалей и устойчивых к перепаду температур сортов стекла, например йенского стекла, как буферная среда в никелевых электролитах, в качестве удобрения, поставляющего в почву бор.
Другие соединения бора
|
|
|
Тетраборат натрия (бура) Nа2В4О7*10Н2О— белый кристаллический порошок. Умеренно растворим в холодной, очень хорошо — в горячей воде. При нагревании буры образуется безводный тетраборат натрия (т. пл. 878°С), в расплаве которого растворяются с химическим взаимодействием оксиды многих металлов.
Буру применяют как сырье для синтеза других соединений бора, при паянии и сваривании металлов, для получения глазурей, эмалей и специальных сортов стекла, в качестве микрокомпонента в удобрениях.
Получены также ортобораты М3ВО3 и полимерные метабораты (МВО2)n.
Пероксобоат натрия NаВО(О2)*4Н2О, или NаВО2*Н2О2*3Н2О; первая формула отражает, что соль является пероксосоединеиием, а вторая формула показывает существование пероксида водорода в растворе этой соли. Используется в качестве моющего и отбеливающего средства, действие основано на разложении пероксида водорода в горячей воде с выделением атомного («активного») кислорода.
Тетрафтороборат (III) водорода Н[ВF4]— сильная кислота в водном растворе (тетрафтороборная кислота). Получают по реакции гидроксида бора с концентрированной фтороводородной (плавиковой) кислотой: В(ОН)3 + 4НF = Н[ВF4] + 3Н2О.
Соли этой комплексной кислоты — тетрафторобораты (III) металлов обычно хорошо растворимы в воде, применяются в гальванотехнике для приготовления электролитов.
Бораны — бороводороды ВnНn+4 и ВnНn+6 (n = 2 — 20), например В2Н6 — диборан (6), В5Н9 — пентаборан (9), В6Н10 — гексаборан (10), В10Н14— декаборан (14), В4Н10 — тетраборан (10), В5Н11 — пентаборан (11). Газообразные, жидкие и твердые вещества, имеющие очень неприятный запах. Быстро разлагаются на воздухе часто с воспламенением и реагируют с водой, выделяя водород, например: В2Н6 + 6Н2О = 2В(ОН)3 + 6Н2.
Трифторид бора ВF бесцветный газ со стойким запахом, т. кип. -101°С. Трихлорид бора ВС13 — бесцветные жидкость или газ, т. кип. +12°С. Сильно дымит во влажном воздухе вследствие протекания гидролиза: ВС13 + 3Н2O = В(ОН)3(Т) + 3НС1(Г).
Оксид бора В2О3 — белый гигроскопичный порошок или хрупкая стекловидная масса, т. пл. 577°C. Получается при сжигании бора на воздухе или при термическом обезвоживании гидроксида бора.
Боразин В3Н6N3, тривиальные названия боразол, неорганический бензол, изоэлектронен бензолу и имеет одинаковое с ним строение.
Карбид бора (карбид тетрабора) В4С — черные кристаллы с глянцевым блеском, по твердости приближается к алмазу, т. пл. 2350°С.
Нитрид бора ВN существует в двух аллотропных формах: белый графит — мягкое как графит вещество и боразон, уступающий по твердости только алмазу, окрашенный в цвета от желтого до черного. Обе формы нитрида бора термически устойчивы, т. пл. »3000°С. Нитрид бора химически инертен. Образуется при взаимодействии в условиях высокой температуры бора с азотом или бора с аммиаком.
Белый графит используется как высокоогнеупорный конструкционный материал в ракетостроении, а боразон — как абразив со сверхвысокой твердостью.
АЛЮМИНИЙ
Открытие. Алюминий А1 в виде соединений (квасцов) известен с глубокой древности. В свободном виде впервле получен в 1825 г. (Эрстед, Дания) восстановлением хлорида алюминия калием, взятым в виде амальгамы (однако получение алюминия было доказано неточно), в 1827 г. для этой реакции был применен чистый калий и выделен чистый алюминий (Вёлер, Германия).
Распространение в природе. Алюминий — третий элемент по распространенности в литосфере Земли (считают, что содержание алюминия велико и на больших глубинах). Находится всегда в связанном состоянии, в основном в форме различных алюмосиликатов.
Минералы:
Силикаты: полевые шпаты (в гранитах, порфирах, базальтах, гнейсах, сланцах)
Слюды: глины — продукты выветривания силикатных пород и минералов каолин — чистая глина мергель и суглинки.
Гидроксиды: бокситы различного состава, в частности А12О3*Н2О, А1(ОН)3, АlO(ОH), А12О(ОН)4.
Оксиды: корунд (глинозем) А12О3, наждак — загрязненный корунд, окрашенный примесями корунд (драгоценные камни) — красный рубин (0,3% Сr2О3), синий сапфир (0,2% Т1203 и следы Fе2О3).
Фторид: криолит Nа3[А1F6]
Получение. Промышленный способ (с 1886 г.)—электролиз расплава смеси глинозема с криолитом. Приблизительно 10%-ный раствор-расплав А12О3 в криолите Nа3[А1F6] подвергают электролизу при 950°С, напряжении 6 – 7 В и силе тока 15 – 30 кА. Протекаемые процессы:
Диссоциация на ионы А12О3 « 2А13+ + 3О2-
на катоде А13+ + 3е- = А1
на аноде 2О2- - 4е- = О2
Катодом служит графитовая футеровка электролизера. Аноды также угольные, что приводит к побочной реакции с кислородом, и в выделяющемся газе, кроме О2, присутствуют СО и СО2. Расплавленный алюминий собирается на дне аппарата и извлекается порциями по 1 т каждые 2 дня; получают алюминий чистотой 99,75 %, который при необходимости можно рафинировать. Процесс рафинирования проводят в трехслойном электролизере — специальном аппарате для электролиза расплава. Очищенный металл содержит 99,99% А1.
Физические свойства. Серебристо-белый, блестящий, легкий металл. Глянец на его поверхности исчезает под действием воздуха, так как образуется матовая оксидная пленка; у оксидированного алюминия блеск его поверхности сохраняется. Алюминий — мягкий и ковкий, его можно прокатывать в тончайшую пленку (алюминиевая фольга). Очень хорошо проводит электрический ток (его электропроводность составляет »62 % от электрической проводимости меди). При красном калении плавится.
Химические свойства. Очень неблагородный металл, который не удается получить в свободном виде при электролизе водного раствора солей или при восстановлении оксида алюминия углем (поэтому его получают только электролизом расплава). Алюминий активно реагирует с хлороводородной кислотой и гидроксидом натрия, переходя в водный раствор в виде тетрагидро-ксоалюмината (III) натрия (проявление амфотерности):
2А1 + 6НС1 = 2А1С13 + 3Н2; 2А1 + 2NаОН + 6Н2О = 2Nа[А1(ОН)4] + 3Н2.
Менее активно реагирует с серной кислотой, а концентрированная азотная кислота вообще пассивирует алюминий, так как на его поверхности образуется оксидная пленка, препятствующая дальнейшему взаимодействию.
Применение.В виде сплавов — конструкционный материал, особенно широко используемый в судо- и самолетостроении. Особо чистый алюминий — проводник в электротехнике. Чистый алюминий применяется для изготовления деталей различных аппаратов и бытовой посуды, в виде гранул — для термитной сварки и для алюминотермического получения ценных металлов, в синтезе алюминийорганических катализаторов, в производстве полимеров (например, полиэтилена низкого давления), в виде порошка—для получения пенобетона (пена образуется в результате выделения Н2 из щелочной бетонной массы), в пиротехнике и как серебряноподобный пигмент для красок.
Алюминий широко применяется в металлургии для получения многих металлов методом алюминотермии, или алюмотермии. Метод основан на том, что гранулированный алюминий восстанавливает при воспламенении оксиды многих металлов, например: Сr2О3 + 2А1 = 2Сr + А12O3; 3V2О5 + 10А1 = 6V + 5А12O3
При этом образуется очень чистый, свободный от углерода металл (Fе, Сr, Ni, Со, V, Тl, Мn и др.). Реакция сильно экзотермическая, получаемый металл плавится и собирается на дне тигельного реактора.
Смесь порошкообразных алюминия и оксидов железа Fе2Оз или Fе3О4 используется для термитной сварки (эта смесь известна под названием термит). При поджигании смеси образуется жидкое железо, которое обеспечивает сварку металлов.
СОЕДИНЕНИЯ АЛЮМИНИЯ
Оксид алюминия А12О3 Тривиальные названия: глинозем (мелкокристаллический), корунд (крупнокристаллический).
Получение. Переработка бокситов — руды, содержащей АlО3 (технология выделения алюминия из глины, содержащей очень много различных примесей, отсутствует). Вскрытие бокситной руды проводят двумя способами: мокрым и сухим.
1. Мокрый способ (способ Бауэра)—нагревание руды в автоклаве с 40%-ным раствором гидроксида натрия (условия процесса: 0,5 МПа, 160°С, 6 – 8 ч). Продукт — щелочной раствор, содержащий Na[А1(ОН)4]; красный шлам — нерастворимые примеси, главным образом FеО(ОН), а также ТiO2 (который выделяют как ценный побочный продукт, он используется для очистки городского горючего газа от серы).
Из щелочного раствора Nа[А1(ОН)4] выделяют аморфный осадок А1(ОН)3 введением при перемешивании затравки кристаллического гидрок-сида алюминия (минерал гиббсит, или гидраргиллит). Маточный раствор после отделения примесей V2О5, Gа2О3 и концентрирована возвращают на стадию вскрытия боксита.
Конечный продукт А12О3 получают прокаливанием А1(ОН)3 во вращающихся трубчатых печах при 1300 °С.
2. Сухой способ (для силикатосодержащих бокситов) — прокаливание руды со смесью Nа2СО3 и СаСО3 во вращающихся печах. Алюминий переводят в раствор в виде тетрагидроксоалюминат (III)-ионов [А1(ОН)4]-, которые разлагают, пропуская через раствор диоксид углерода: [А1(ОН)4]- + СO2 = А1(ОН)3 + НСО3-.
Из полученного гндроксида алюминия прокаливанием выделяют Аl2Оз.
Свойства.Белый порошок или очень твердые белые кристаллы; т. пл. 2055°С. После прокаливания не реагирует ни с кислотами, ни с основаниями.
Применение.Основная область применения — производство алюминия. Используется также как полировальный порошок для металлов, катализатор и носитель катализаторов, адсорбент в хроматографическом анализе, абразивный материал (так называемый электрокорунд).
Синтетические монокристаллы оксида алюминия — чистейший А12Оз — используются в качестве опоры осей в часах, для изготовления лазеров. Некоторые из них, окрашенные примесями других оксидов металлов, применяются в ювелирном деле как синтетические драгоценные камни (синтетические рубины, сапфиры и др.). Монокристаллы А12О3 получают плавлением глинозема в водородно-кислородном пламени; расплав стекает по шамотному стержню, на конце которого он кристаллизуется.
Гидроксид алюминия А1(ОН)3
Получение и свойства. Осаждается из растворов солей алюминия при добавлении гидрата аммиака: А1С13 + 3(NH3*Н2О) = А1(ОН)3 + 3NH4С1 или гидроксида натрия, взятого в недостатке: А12(SО4)3 + 6NаОН = 2А1(ОН)3 + 3Nа2SО4.
При добавлении избытка NаОН амфотерный гидроксид алюминия снова переходит в раствор (в виде аниона): А1(ОН)3 + NaОН = Ка[А1(ОН)4].
При осторожном подкислении полученного раствора снова выпадает осадок гидроксида, который исчезает при введении избытка кислоты алюминий переходит в гидратированный катион [А1(Н2О)6]3+. В этом проявляется амфотерность гидроксида алюминия:
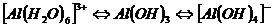
Применение.Промежуточный продукт при получении алюминия, при синтезе органических лаковых красок (содержащих органические красители и пигменты), в медицине как средство против повышенной кислотности желудочного сока.
Сульфат алюминия А12(SО4)3*18Н2О – белые кристаллы. Хорошо растворим в воде, водный раствор имеет (из-за гидролиза по катиону) кислую реакцию. Применяется как коагулирующее средство при очистке воды, причем одновременно устраняется временная жесткость воды: А12(SО4)3 + 3Са(НСО3)2 = 3СаSО4 + 2А1(ОН)3 + 6СО2.
Используется также в процессе проклейки бумаги, например, канифольным мылом — натриевой солью абиетиновой кислоты Nа(С19Н29СОО), в крашении и других производствах.
Сульфат алюминия-калия КА1(SО4)2*12Н2О, тривиальное название алюмокалиевые квасцы (часто просто квасцы) — белая, легко кристаллизующаяся двойная соль. Применение такое же, как и сульфата алюминия.
Ацетат алюминия А1(СН3СОО)3 — водный раствор этой соли (с примесями продуктов гидролиза) имеет традиционное название уксуснокислый глинозем. Применяется для огнезащитной и водонепроницаемой пропитки тканей.
Хлорид алюминия А1С13 — белое кристаллическое вещество, сильно раздражающее кожу. Сублимируется при 183°С. «Дымит» во влажном воздухе вследствие гидролиза. Из воды кристаллизуется гексагидрат А1С13*6Н2O. Используется как катализатор, например, в синтезах Фриделя – Крафтса, в реакциях дегидрирования и конденсации, в качестве переносчика галогена в органической химии.
Аланаты — групповое название гидридокомплексов алюминия. К ним относится, например, аланат лития Li[А1Н4], широко использующийся в органической химии как мягкий восстановитель.
Триэтилалюминий А1(С2Н5)3 — жидкость, т. кип. 194°С. Самозоспламеняется на воздухе. Получают из алюминия, водорода и этилена. Реагирует со взрывом с водой: А1(С2Н5)3 + 3Н2O = А1(ОН)3 + 3С2Н6
Используется в виде комплексов с соединениями d-элементов, например с хлоридом титана (IV) Т1С14, в качестве катализаторов Циглера при получении полиэтилена низкого давления.
ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ И ИХ СОЕДИНЕНИЯ
Галлий Gа был предсказан Д. И. Менделеевым в 1870г., открыт в 1875 г. (Лекок де Буабодран, Франция) спектроскопически в цинковой обманке — минерале сфалерите ZnS. Очень редкий элемент, по стоимости дороже золота. Получают в качестве побочного продукта в производства алюминия из бокситов; из цинковых промышленных концентратов и летучей части золы в процессе газификации углей; при электролизе щелочного раствора, полученного выщелачиванием медистых сланцев (выделяется на ртутном катоде).
Галлий — блестящий серебристо-белый металл. Имеет низкую температуру плавления (30°С, т. е. плавится при нагревании в руке) и высокую температуру кипения (2403°С), поэтому может использоваться как термометрическая жидкость в широком температурном интервале.
Применяют как примесь для легирования полупроводников. Галлий-алюминиевые сплавы, содержащие немного алюминия, представляют собой жидкости и реагируют с водой так же агрессивно, как натрий.
Арсенид галлия GаАs— важнейший представитель полупроводниковых соединений элементов IIIА и VА групп). Атомы Gа и Аs в сумме имеют столько же валентных электронов (3е + 5е = 8е), что и два атома элемента IVА группы — германия (4е- + 4е- = 8е-), кристаллические решетки GаАs и Gе совпадают, а следовательно, должна быть одинакова их электрическая проводимость.
Другие соединения — это антимониды алюминия, галлия и индия А1Sb, GаSb и InSb, монофосфиды галлия и индия GаР и InР. Их получают сплавлением стехиометрических количеств особо чистых простых веществ, дополнительной глубокой очисткой методом зонной плавки и целенаправленным легированием добавками магния, теллура и т. п.
Индий In открыт в 1863 г. (Райх и Рихтер, Германия) по синей (окрашенной как индиго) линии спектра в цинковой обманке (сфалерите) ZnS (куб.). Очень редкий элемент. Получают попутно из руд цинка и свинца.
Индий — блестящий серебристо-белый металл, очень мягкий (режется ножом). Имеет низкую температуру плавления. Применяют в качестве примеси для легирования полупроводников и для получения соединений с полупроводниковыми свойствами (см. выше, арсенид галлия). Гальванические покрытия свинца индием из расплава используются при изготовлении подшипников скольжения и авиационных моторах.
Таллий Т1 открыт в 1861 г. (Крукс, Англия) по светло-зеленой линии в спектре. Содержится в шламах свинцовых камер сернокислотных заводов. Получается как побочный продукт из пирита и медистых сланцев.
Таллий — блестящий мягкий тяжелый металл с окраской, как у свинца. В отличие от галлия и индия таллий на воздухе быстро тускнеет в результате образования оксидной пленки. Хорошо реагирует с серной и азотной кислотами. В технике почти не применяется.
Соединения таллия очень ядовиты! Соединения таллия (I) устойчивее соединений таллия (III), соединения таллия (I) сходны по свойствам с соединениями щелочных элементов, серебра и свинца. Оксид таллия (I) ТiО — черное вещество, реагирующее с водой с образованием бесцветного раствора щелочи — гидроксида таллия (I) Т1ОН, который в твердом состоянии имеет желтую окраску. Карбонат таллия (I) Т12СО3 хорошо растворим в воде; раствор Тl2СО3 вследствие гидролиза сильнощелочной. Галогениды таллия (I) различаются по растворимости в воде, ТlF хорошо растворим, а Т1С1, Т1Вr и Тl I— малорастворимы. Таллий и его соединения обнаруживают по зеленому окрашиванию пламени горелки.
Дата добавления: 2018-04-04; просмотров: 2664; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
