II. БИОХИМИЯ ЖИДКОСТЕЙ ПОЛОСТИ РТА И ЗУБНОГО НАЛЕТА
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
БИОХИМИЯ ПОЛОСТИ РТА
Учебное пособие
Чита – 2004 г.
Рекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов, обучающихся по специальности 040400 – стоматология (УМО-216 от 13.04.04)
Пособие составлено сотрудниками кафедры биологической химии с курсами биоорганической химии и клинической биохимии ГОУ ВПО Читинской государственной медицинской академии заведующим кафедрой, профессором, д.м.н. Б.С.Хышиктуевым и профессором, д.м.н. Н.А.Хышиктуевой.
Рецензенты: заведующий кафедрой биохимии Московского медицинского стоматологического университета, профессор, д.м.н. Т.П.Вавилова, заведующий кафедрой биохимии Российской медицинской академии последипломного образования, профессор, д.м.н. Г.А.Яровая.
ОГЛАВЛЕНИЕ
Введение
I. Биохимия твердых (минерализованных) тканей зуба
1.1. Эмаль
1.2. Дентин
1.3. Цемент
1.4. Пульпа
1.5. Пародонт
II. Биохимия жидкостей полости рта, зубной камень и зубной налет
2.1. Слюна
2.2. Десневая жидкость
2.3. Общая характеристика и особенности химического состава зубного налета
|
|
|
2.4. Зубной камень
III. Метаболические функции фтора, кальция и фосфора в ротовой полости
IV. Патология: биохимический аспект
4.1. Кариес
4.2. Флюороз
4.3. Пародонтит
Список литературы
ВВЕДЕНИЕ
Гомеостаз полости рта во многом определяется структурно-функциональным состоянием тканей и микроорганизмов ротовой полости. Фундаментальные и прикладные исследования последнего десятилетия в области стоматологии расширили представления о биохимических аспектах твердых тканей зуба, слюны, десневой жидкости, метаболических особенностях жизнедеятельности микроорганизмов и ксенобиотиков в норме и патологии.
В настоящем учебном пособии освещены вопросы биохимии полости рта в физиологических условиях и кратко изложены сведения о биохимических нарушениях, при наиболее часто встречающихся патологических состояниях полости рта. Данное руководство составлено в соответствии с рекомендуемой программой ВУНМЦ МЗ РФ по биологической химии для студентов стоматологического факультета по разделу «Биохимия тканей зуба», «Биохимия ротовой жидкости» и «Метаболические функции фтора». Авторы надеются, что настоящее пособие будет интересно и полезно не только студентам, но и практическим врачам-стоматологам и с благодарностью примут все пожелания и замечания.
|
|
|
I. БИОХИМИЯ ТКАНЕЙ ЗУБА
В составе зуба выделяют минерализованные и неминерализованные ткани. К первым относятся эмаль, дентин и цемент. Вообще в организме человека в норме имеется четыре вида минерализованных тканей: эмаль, дентин, цемент и кость, которые отличаются по химическому составу и происхождению. Последние три происходят из стволовых клеток мезодермы, тогда как эмаль является производным эктодермы. В их химическом составе преобладают неорганические компоненты, а также присутствуют органические соединения и вода (табл.1).
Мягкая (неминерализованная) ткань в составе зуба одна, она называется пульпой и находится в полости коронки и корня зуба.
Таблица 1
Химический состав эмали, дентина и кости (в % от массы)

1.1. ЭМАЛЬ
Эмаль, покрывающая коронку зуба, - самая твердая ткань в организме (сравнимая с алмазом), что объясняется высокой концентрацией в ней неорганических веществ (до 97%), главным образом, кристаллов апатитов: гидроксиапатита (до 75%), карбонатапатита, фторапатита, хлорапатита и др. Здоровая эмаль содержит 0,8-1,0% свободной воды и 1,2% органических соединений, представленных белками, липидами и углеводами. Углеводы эмали в основном представлены глюкозой, маннозой и галактозой. Вода занимает свободное пространство в кристаллической решетке апатитов и органической основе, а также располагается между кристаллами.
|
|
|
Неорганический компонент эмали. Мельчайшими структурными единицами эмали являются кристаллы апатитоподобного вещества, формирующие эмалевые призмы. Минеральную основу составляют кристаллы апатитов и восьмикальциевый фосфат - Са8Н2(РО4)6*5Н2О; формула основного гидроксиапатита - Са10(РО4)6(ОН)2, в этом случае молярное соотношение Са/Р равно около 1,67. Однако, как это установлено в настоящее время, соотношение этих компонентов может изменяться как в сторону уменьшения(1,33), так и в сторону увеличения (2,0). При соотношении Са/Р 1,67 разрушение кристаллов происходит при выходе 2 ионов Са2+, при соотношении 2,0 гидроксиапатит способен противостоять разрушению до замещения 4 ионов Са, тогда как при соотношении 1,33 его структура разрушается. По современным представлениям данный параметр можно использовать для оценки состояния эмали зуба. Гидроксиапатит имеет гексагональную форму (рис. 1). Длинная ось кристаллов-призм расположена по основному направлению давления на кость или зуб. Каждый кристалл покрыт гидратной оболочкой около 1 нм. Связанная вода, образующая эту оболочку, составляет примерно 3,0-3,3% массы эмали. Кроме связанной воды (гидратная оболочка) в эмали имеется свободная вода, располагающаяся в микропространствах. Общий объем воды в эмали составляет 3,8%. Первое упоминание о жидкости, находящейся в твердых тканях зуба, относится к 1928 году. В дальнейшем стали дифференцировать зубную жидкость, которая находится в дентине от эмалевой жидкости, заполняющей микропространства, объем которых составляет 0,1-0,2% от объема эмали. В исследованиях на удаленных зубах человека с использованием специальной методики подогрева показано, что через 2-3 часа после начала опыта на поверхности эмали образуются капельки «эмалевой жидкости». Движение жидкости обусловлено капиллярным механизмом, а по жидкости диффундируют молекулы и ионы. Эмалевая жидкость играет важную биологическую роль не только в период развития эмали, но и в сформированном зубе, обеспечивая ионный обмен.
|
|
|
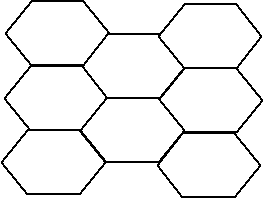
Рис. 1. Строение молекулы гидроксиапатита
Состояние эмали зуба во многом определяется соотношением Са/Р как элементов, составляющих основу эмали зуба. Это соотношение непостоянно и может изменяться под воздействием ряда факторов. Здоровая эмаль молодых людей имеет более низкий коэффициент Са/Р, чем эмаль зубов взрослых; этот показатель уменьшается также при деминерализации эмали. Более того, возможны существенные различия соотношения Са/Р в пределах одного зуба, что послужило основанием для утверждения о неоднородности структуры эмали зуба, и, следовательно, о неодинаковой подверженности различных участков эмали поражению кариесом. В кристаллической решетке гидроксиапатита имеются вакантные места, поэтому даже в уже сформированном кристалле при химических и физических воздействиях возможны изоморфные замещения. При этом любое проникновение веществ на поверхность или внутрь кристалла связано с преодолением гидратной оболочки. Результатом подобных явлений и образования вакансий является варьирование свойств кристаллов, что выражается в изменении проницаемости эмали, ее резистентности к растворению, адсорбционных свойств. Однако, только некоторые ионы могут включаться в структуру апатитов. Если общую формулу апатита представить как А10В6Х2, то по положению Амогут включаться ионы Са2+, Mg2+, Ва2+ , Cr2+, Sr2+ и другие, по положению В - РО43- и другие, по положению Х - НО- , F-, Cl- и другие.
Примером реакции изоморфного замещения является следующая:
Са10(РО4)6(ОН)2 + Mg2+ à Са9 Mg(РО4)6(ОН)2 + Са2+
Известно, что приведенное выше взаимодействие является неблагоприятным, так как снижает резистентность эмали к действию кариесогенных факторов.
Замещение в гидроксиапатитах ионов Са на Sr сопровождается формированием стронциевых апатитов - Ca9Sr(РО4)6(ОН)2. При этом стронций, поступая в избыточном количестве, хотя и вытесняет из кристаллической решетки кальций, но сам в ней не удерживается, что приводит к порозности костей. Этот эффект усугубляется недостатком кальция. В результате проводимых как в нашей стране, так и за рубежом, исследований установлено, что микроэлементы в эмали располагаются неравномерно. В наружном слое отмечается большое содержание фтора, свинца, цинка, железа при меньшем содержании в этом слое натрия, магния, карбонатов. Равномерно по слоям распределяются, как правило, стронций, медь, алюминий, калий.
Такие изменения характерны для болезни Кашина-Бека (“уровская болезнь”), которая поражает людей, преимущественно в раннем детстве, живущих в долине реки Уров Читинской и Амурской областей. Страдание начинается с болей в суставах, затем возникает поражение костной ткани, размягчение эпифизов, нарушаются процессы окостенения. В эндемичных районах в почве и воде содержится в 2 раза меньше кальция и в 1,5-2 раза больше стронция, чем в норме. В настоящее время существует и другая теория патогенеза “уровской болезни”, согласно которой патология развивается в результате дисбаланса фосфатов в окружающей среде.
Изоморфное замещение в гидроксиапатите на фтор приводит к образованию гидроксифторапатитов и фторапатитов - Са10(РО4)6F(ОН) и Са10(РО4)6F2:
Са10(РО4)6(ОН)2 + F- à Са10(РО4)6F(ОН) + (ОН)-
Фторапатиты, которых в норме в эмали около 0,66%, обладают значительно большей резистентностью к растворению в кислой среде, чем гидроксиапатиты. Было установлено, что при замещении фтором даже одной из 50 гидроксильных групп растворимость эмали резко понижалась. Именно с этим связано профилактическое действие небольших концентраций фтора. Однако при высоком его содержании образуется фторид кальция - СаF2 - практически нерастворимое соединение, которое быстро исчезает с поверхности зубов в результате выщелачивания:
Са10(РО4)6(ОН)2 + 2F- à 10СаF2 + 6(РО4)3- + 2(ОН)-
В связи с этим не следует применять высокие концентрации фторидов, особенно в кислых растворах.
В эмали зуба также содержатся хлорапатит - Са10(РО4)6Cl2 (4,4%) и карбонатапатиты - Са10(РО4)5СО3(ОН)2. Они составляют 19% и их количество увеличивается при употреблении пищи, богатой углеводами. Рост концентрации карбонатапатитов грозит снижением резистентности эмали и способствует развитию кариозного процесса.
Большая часть кристаллов гидроксиапатита в эмали ориентирована и упорядочена в виде сложных образований - эмалевых призм. Элементарная ячейка гидроксиапатита (структура 1 порядка) имеет молекулярную массу около 1000, в составе кристалла гидроксиапатита (структура 2 порядка) находится около 2500 таких ячеек (М=2 500 000). Эмалевая призма (структура 3 порядка) в свою очередь составлена из тысяч и миллионов кристаллов. Эмалевые призмы начинаются у эмалево-дентинной границы и идут к поверхности эмали, многократно изгибаясь в виде спирали, которые собраны в пучки (структура 4 порядка).
Органические соединения эмали. В процентах сухой массы они составляют: белки – 0,25-0,45%, липиды – 0,6%, цитраты – 0,1%. Наибольшее количество протеинов содержится в области эмалево-дентинного соединения. Белки эмали нельзя причислить к группе коллагеновых, так как в протеинах эмали нет гидроксипролина, а количество пролина составляет 166-187 аминокислотных остатков на 1000.
В эмали имеются белки, участвующие в амелогенезе - амелогенины и не являющиеся амелогенинами (энамелины). Амелогенин (первая группа белков эмали) представлен 5 соединениями с молекулярной массой 25; 15; 9,5; 7,5 и 6 кДа. Энамелины (вторая группа белков эмали) также являются гетерогенной фракцией и состоят из 5 классов с молекулярной массой, равной 72, 56, 42, 30, 21 кДа. Белки этого семейства способны агрегироваться и дезагрегироваться. Оба класса протеинов относятся к сложным – гликофосфопротеидам, причем амелогенины содержат до 75% органического фосфата, а энамелины – 25%.
Основой формирования и функционального построения эмали служит ее белковая матрица, элементарной функциональной единицей которой является кальций-связывающий белок эмали (КСБЭ). Последний способен к олиго- и полимеризации посредством кальциевых мостиков с образованием трехмерной белковой сетки, нерастворимой в нейтральной среде. Эта структура в дальнейшем выступает в роли центров кристаллизации, обеспечивая упорядоченность и регулярность минерализации, на этапах которой мы подробно остановимся ниже.
По мере созревания меняется белковый профиль эмали. На начальном этапе формирования этой ткани соотношение амелогенинов и энамелинов составляет 9:1, а среди аминокислот превалируют такие как пролин и гистидин; в зрелой наряду с уменьшением количества белка оно становится 1:1 и в аминокислотном составе начинают преобладать аспартат, серин, глицин и аланин.
Изменение белкового состава эмали связано с различием функций, осуществляемых протеинами на разных стадиях формирования зуба: вначале с транспортом и депонированием минеральных компонентов, а затем с инициацией минерализации. Еще в эмали обнаружен уникальный гидроксипролинсодержащий гликофосфопептид с Мr=3 кДа, он прочно связан с гидроксиапатитом и возникает в результате деградации коллагеноподобного белка зуба или попадает в процессе выделения его из дентина.
Третья группа белков эмали – это растворимые белки с Мr 20 кДа. Однако они не обладают сродством к минеральной фазе, не способны к образованию комплексов с кальцием и имеют менее регулярную структуру. Роль этих белков в эмали и в процессе минерализации неясна. Вполне вероятно, что они являются остаточными белками “эмалевого органа”.
Процессы минерализации. До восьмого месяца развития плода происходит формирование зачатка зуба, а к моменту рождения ребенка образуется зрелая эмаль.
Начало минерализации совпадает с разрушением полипептидов эмалевого матрикса.
I этап – протеолиз высокомолекулярных белков до низкомолекулярных с помощью катепсинов (тканевых протеаз) и плазмина.
II этап – обогащение матрикса ионами кальция и неорганическим фосфатом. Источником первого является преимущественно цитрат (см. ниже), а второй поступает за счет активации щелочной фосфатазы, которая гидролизует органические эфиры фосфорной кислоты.
III этап – фосфорилирование остатков серина в низкомолекулярных белках в результате действия протеинкиназы (рис. 2).
IV этап – с фосфорилированными остатками серина реагируют ионы кальция и неорганического фосфата (рис. 2). В конечном итоге формируется первичная ячейка гидроксиапатита (первичный кристалл).
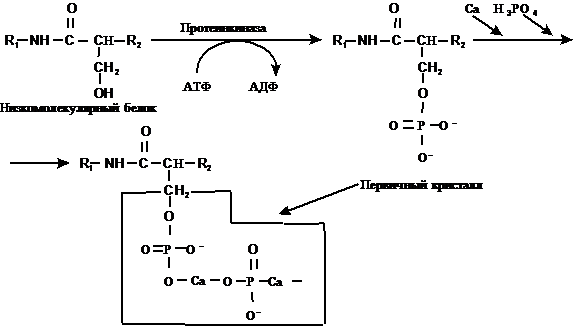
Рис. 2. Схема некоторых этапов минерализации.
Дальнейшее формирование решетки протекает по типу эпитаксии, представляющей собой рост последующих кристаллов на базе предыдущего. При этом вновь образующиеся кристаллы ориентированы по первичному и не связаны с белком.
Наличие большого количества глутамата и аспартата в эмалевых белках и других протеинах минерализованных тканей позволяет присоединять кальций непосредственно к карбоксильной группе этих аминокислот. Кроме того, лизин коллагена способен также взаимодействовать с неорганическим фосфатом путем образования фосфамидной связи (рис.3). В костной ткани преципитация кальция и фосфата возможна не только на белках, но и на углеводах и липидах.
Амелогенез во многом определяется белковой матрицей. Ингибирование протеолиза, согласно гипотезы Robinson и Kirkham (1984), способствует сохранению белка и нарушает амелогенез, что может быть причиной гипоплазии эмали и флюороза.
После прорезывания зубов процесс созревания эмали продолжается и он тесно связан с поступлением минеральных компонентов через приобретенную пелликулу зуба из смешанной слюны.

Рис. 3. Возможные варианты формирования первичного кристалла.
С возрастом происходит накопление Са2+ в поверхностном слое эмали, при этом меняется соотношение Са/Р с 1,51 до 1,86. Это процесс динамичный и зависит от анатомической принадлежности зуба, места его расположения, топографии участка зуба и других факторов. Так, наиболее быстро созревает эмаль в области режущих краев и бугров (в течение 4-6 месяцев после прорезывания). От степени созревания эмали в определенной мере зависит кариесрезистентность зубов.
Регуляция процессов минерализации. Для минерализации костей, твердых тканей зуба необходимо поддержание определенных концентраций ионов кальция и неорганического фосфата в плазме крови, слюне и надкостнице. В организме взрослого человека содержится в среднем 1000 г кальция. Основным его депо в организме (99%) являются кости. В костях около 99% кальция присутствует в виде малорастворимой формы кристаллов гидроксиапатита. Другой фонд кальция – это кальций плазмы крови. В плазму крови кальций поступает из кишечника (с водой и пищей) и из костной ткани (в прцессе резорбции). Нормальное протекание процессов минерализации обеспечивается тем, что концентрация Са2+ в крови варьирует в очень узких пределах (2,12-2,60 ммоль/л – у взрослых; 2,74-3,24 ммоль/л – у детей), более широкие колебания характерны для цифр неорганического фосфата (0,64-1,29 ммоль/л – у взрослых; 1,29-2,26 ммоль/л – у детей). В механизм регуляции гомеостаза этих ионов включены три гормона – паратироидный (паратгормон), кальцитонин и кальцитриолы (1,25(ОН)2D3 и 24,25(ОН)2D3).
Паратироидный гормон (ПТГ) продуцируется околощитовидными железами и по механизму действия является антагонистом тирокальцитонина. Паратгормон – это полипептид, состоящий из 84 аминокислотных остатков, синтезируется в виде препрогормона (115 аминокислот). От последнего в результате частичного гидролиза в эндоплазматической сети отщепляется 25 аминокислотных остатков и образуется прогормон; далее в комплексе Гольджи от него отщепляется гексапептид и образуется активный гормон. Паратгормон упаковывается и хранится в секреторных гранулах (везикулах). В крови он транспортируется в связанном с белком состоянии. Основной стимул секреции данного гормона – низкий уровень Са2+ во внеклеточной жидкости (менее 2,0 ммоль/л). Вид рецепции данного гормона трансмембранный, через ц-3`,5`-АМФ. Органы-мишени: костная ткань, почки и кишечник. В клетках почек и костной ткани локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, приводящий к активации аденилатциклазы. Внутри клеток органов мишеней возрастает концентрация молекул цАМФ, действие которых стимулирует мобилизацию ионов кальция из внутриклеточных запасов. Ионы кальция активируют киназы, которые фосфорилируют особые белки, индуцирующие транскрипцию специфических генов.
Биологические эффекты. В костной ткани рецепторы ПТГ локализованы на остеобластах и остеоцитах, но не обнаружены на остеокластах. При связывании паратгормона с рецепторами клеток-мишеней остеобласты начинают усиленно секретировать инсулиноподобный фактор роста 1 и цитокины. Эти вещества стимулируют метаболическую активность остеокластов. В частности, ускоряется образование ферментов, таких как щелочная фосфатаза и коллагеназа, которые воздействуют на компоненты костного матрикса, вызывают его распад, в результате чего происходит мобилизация Са и фосфатов из кости во внеклеточную жидкость.
В почках ПТГ стимулирует реабсорбцию кальция в дистальных извитых канальцах и тем самым снижает экскрецию кальция с мочой, уменьшает реабсорбцию фосфатов.
Кроме того, паратгормон способствует гидроксилированию 25-гидроксихолекаль-циферола в кальцитриол (1,25 (ОН)2D3). Последний усиливает всасывание Са в кишечнике.
Таким образом, паратгормон восстанавливает нормальный уровень ионов Са во внеклеточной жидкости как путем прямого воздействия на кости и почки, так и действуя опосредованно (через стимуляцию синтеза кальцитриола) на слизистую оболочку кишечника, увеличивая в этом случае эффективность всасывания Са. Снижая реабсорбцию фосфатов из почек, паратгормон способствует уменьшению концентрации фосфатов во внеклеточной жидкости.
Кальцитриолы (1,25(ОН)2D3 и 24,25(ОН)2D3) оказывают воздействие на тонкий кишечник, кости и почки. Подобно другим стероидным гормонам, витамин D связывается с внутриклеточным рецептором клетки-мишени. Образуется комплекс гормон-рецептор, который взаимодействует с хроматином и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки, опосредующие действие кальцитриола.
Так, в клетках кишечника кальцитриол индуцирует синтез Са-переносящих белков, которые обеспечивают всасывание ионов кальция и фосфатов из полости кишечника в эпителиальные клетки кишечника и далее транспорт из клетки в кровь, благодаря чему концентрация ионов кальция во внеклеточной жидкости поддерживается на уровне, необходимом для минерализации органического матрикса костной ткани.
В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. При недостатке витамина D нарушается образование аморфного фосфата кальция и кристаллов гидроксиапатитов в органическом матриксе костной ткани, что приводит к развитию рахита и остеомаляции. Обнаружено также, что при низкой концентрации ионов Са кальцитриол способствует мобилизации кальция из костной ткани. Кальцитриол способен также усиливать действие паратгормона на реабсорбцию кальция в почках.
Кальцитонин - полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желез в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации Са и уменьшается при снижении концентрации Са в крови. Кальцитонин – функциональный антагонист паратгормона. Он ингибирует (через ц-3,5-АМФ) высвобождение Са из кости, снижая активность остеокластов. Кроме того, кальцитонин подавляет канальцевую реабсорбцию ионов кальция в почках, тем самым стимулируя их экскрецию почками с мочой. Скорость секреции кальцитонина у женщин сильно зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает ускорение мобилизации кальция из костной ткани, что приводит к развитию остеопороза.
Паротин – гормон белковой природы с молекулярной массой 100 кДа, вырабатывается в околоушных слюнных железах. Впервые выделен из бычьих околоушных желез. Белки, сходные с паротином, выделены также из подчелюстных слюнных желез (S-паротин), слюны (паротин А, В и С), крови, мочи. Все эти соединения способствуют развитию и росту мезенхимальных тканей, усиливают пролиферацию и кальцинацию дентина зуба. Паротин снижает содержание кальция в крови за счет стимуляции его поступления в ткани зуба, наряду с фосфатом и натрием.
В регуляции роста кости то или иное участие принимают почти все другие гормоны, медиаторы и модуляторы. Простагландины, особенно ПГЕ1, снижают фосфатуритическую реакцию клеток почечных канальцев на паратгормон. Глюкокортикоиды необходимы для роста костей. В физиологических концентрациях они стимулируют обмен веществ в костной ткани, повышая чувствительность клеток к паратгормону и кальцитриолам. Инсулин активирует остеобласты и всасывание кальция в кишечнике. Поэтому при сахарном диабете I типа нарушается рост скелета и минерализация костей. Йодтиронины (Т3 и Т4) также необходимы для нормального роста костей. При их избытке активируются остеокласты и возникает гиперкальцемия. Эстрогены и андрогены принимают участие в механизмах бурного роста в пубертатном периоде. В детстве и в период полового созревания они обеспечивают преобладание процессов костеобразования над резорбцией.
Процессы минерализации находятся также под контролем некоторых витаминов.
Витамин С способствует созреванию коллагена через образование гидроксипролина. Зрелый протеин способен связывать ионы кальция и фосфатов, формируя кристаллы гидроксиапатита. Витамин А влияет на скорость биосинтеза гликозаминогликанов – одного из органических компонентов дентина и цемента. Из холестерола в коже под воздействием ультрафиолетовых лучей синтезируется провитамин D (кальцитриол).
Функции эмали зуба. Эмаль – это бессосудистая и самая твердая ткань организма. Кроме того, эмаль остается относительно неизменной в течение всей жизни человека. Указанные свойства объясняются функцией, которую она выполняет – защищает дентин и пульпу от внешних механических, химических и температурных раздражителей. Только благодаря этому зубы выполняют свое назначение – откусывают и измельчают пищу. Структурные особенности эмали приобретены в процессе филогенеза.
Явление проницаемости эмали зуба осуществляется благодаря омыванию эмали снаружи ротовой жидкостью, а со стороны пульпы – тканевой и наличию пространств в эмали, заполненных жидкостью. Возможность проникновения в эмаль воды и некоторых ионов известна с конца прошлого и начала нынешнего столетия. Так, C.F.Bedecker (1996) утверждал, что зубная лимфа может проходить через эмаль, нейтрализуя молочную кислоту и постепенно увеличивая плотность за счет содержащихся в ней минеральных солей.
В настоящее время проницаемость эмали изучена довольно подробно, что позволило пересмотреть ряд ранее существовавших представлений. Если считалось, что вещества в эмаль поступают по пути: пульпа – дентин – эмаль, то в настоящее время не только установлена возможность поступления веществ в эмаль из слюны, но и доказано, что этот путь является основным. Эмаль проницаема в обоих направлениях: от поверхности эмали к дентину и пульпе и от пульпы к дентину и поверхности эмали. На этом основании эмаль зуба считают полупроницаемой мембраной. Некоторые авторы считают, что проницаемость – это главный фактор созревания эмали зубов после прорезывания.
ДЕНТИН
Дентин составляет основную массу зуба. Его коронковая часть покрыта эмалью, корневая – цементом.
Дентин, как ткань, относится к группе специализированных костных тканей. Поэтому в его формировании выделяют две стадии: 1. Образование межклеточного вещества – или органической фазы, которая называется предентином. 2. Минерализация предентина и превращение его в дентин. На первой стадии процесс начинается с синтеза сложных углеводов – гликозамингликанов, которые связываются с водой за пределами клеток между отростками Томса и образуют основное гомогенное вещество – обязательную часть межклеточного вещества. После этого одонтобласты начинают синтезировать молекулы коллагена I типа, которые также выходят вне клеток между отростками Томса. Таким образом, межклеточное вещество, которое выделили одонтобласты, содержит только соединения органической природы, является по консистенции мягким, податливым и называется предентином.
Вторая стадия (минерализации) начинается с того момента, когда предентин достигает толщины 20-30 мкм, а затем эти стадии идут попеременно до тех пор, пока не образуется необходимая толщина дентина. Процесс минерализации регулируют сами клетки одонтобласты, которые активно захватывают из кровеносных сосудов зубного сосочка многие ионы (Са2+, Mg2+, Na+, F-, PO43- и др.). Последние транспортируются по отросткам одонтобластов в предентин, где включаются в структуру апатитов. Параллельно с этим клетки начинают выделять матриксные пузырьки, которые содержат ферменты – щелочную фосфатазу и пирофосфатазу, гидролизующие органические эфиры фосфорной кислоты и таким образом пополняющие пул неорганического фосфата в участках минерализации.
Образование дентина происходит в течение всего периода функционирования зуба при наличии жизнеспособной пульпы. Дентин, образующийся после прорезывания зубов, называют вторичным. Он характеризуется меньшей степенью минерализации и большим содержанием коллагеновых фибрилл.
В дентине содержится до 72% неорганических веществ и около 28% органических и воды. Неорганические соединения представлены, наряду с гидроксиапатитами и карбонатапатитами, фосфатом, карбонатом и фторидом кальция, органические - коллагеном и другими белками. Дентин построен из основного вещества и проходящих в нем канальцев, в которых расположены отростки одонтобластов и окончания нервных волокон, проникающих из пульпы. Основное вещество содержит коллагеновые фибриллы, собранные в пучки, и аморфное склеивающее вещество, химический состав которого изучен недостаточно, известно лишь, что оно включает большое количество минеральных солей.
Органическая основа дентина. В отличие от эмали дентин содержит большее количество органических веществ. В основном это белки:

 БЕЛКИ ДЕНТИНА
БЕЛКИ ДЕНТИНА
нерастворимые (90%) растворимые (10%)
– коллаген – собственно белки дентина
– структурные гликопротеины – сывороточные белки
Нерастворимые протеины в основном представлены коллагеном. Последний имеет особое строение, он не набухает в воде, устойчив к воздействию коллагеназы, содержит до 12% гидроксипролина, 2,0-3,5% лизина и гидроксилизина. В его составе также присутствует большое количество глутаминовой и аспарагиновой кислот, аргинина, лейцина, изолейцина и валина, мало циклических аминокислот, отсутствует триптофан.
Растворимые – это белки крови, проникающие через кровеносные сосуды. Они представлены сывороточными альбуминами, b и g-глобулинами, ферментами гликолиза, цикла трикарбоновых кислот, фосфатазами и трансаминазами. Из собственных белков дентина следует упомянуть Са-связывающие белки с молекулярной массой 11 кДа.
Физиологическая роль протеинов дентина заключается в инициации минерализации, ее упорядоченности и регулируемости. Возможность влияния одонтобластов на минерализацию обусловлена тем, что проксимальный отросток этих клеток содержит митохондрии, эндоплазматический ретикулум, рибосомоподобные гранулы, т.е. элементы, характеризующие метаболическую активность.
Уровень проницаемости дентина корня для большинства минеральных компонентов значительно ниже, чем дентина коронки. Данное явление можно объяснить с учетом структуры этой ткани. Известно, что дентинных канальцев в области бугров зубов человека значительно больше, чем в дентине, прилежащим к фиссурам. Ранее существовало мнение, что жидкость из пульпы поступает в дентин по отросткам одонтобластов и, выделяясь через них в пространство между отростком и стенкой трубочки, возвращается обратно. В настоящее время считают, что анатомической основы для подтверждения дентинной циркуляции нет. Состав дентинной жидкости близок к интерстициальной и включает ионы хлора, калия, натрия.
В дентине также содержится около 1% лимонной кислоты, роль которой заключается в способности образовывать хелатные комплексы с кальцием для передачи его во внутрь гидроксиапатита (рис. 4).
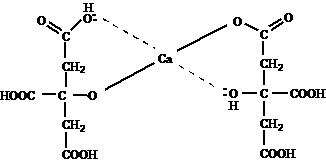
Рис. 4. Хелатный комплекс цитрата с ионами кальция.
ЦЕМЕНТ
Цемент зуба рассматривают как вариант грубоволокнистой костной ткани. В его состав входят около 70 % неорганических, 20% органических веществ и 10% приходится на воду. Из неорганических соединений преобладают гидроксиапатиты, а также соли фосфата и карбоната кальция, органические вещества представлены главным образом коллагеном, а также гликозамингликанами, липидами. В костной ткани содержится большое количество цитрата, его уровень превышает таковой в печени более, чем в двести раз.
Различают клеточный цемент, расположенный в верхушечной части корня и в области его бифуркации, и бесклеточный, покрывающий остальную часть корня. Клеточный цемент содержит цементоциты, в которых выявляются достаточно большое количество РНК, гликогена и ферментов. Это свидетельствует об интенсивных обменных процессах по сравнению с другими минерализованными тканями зуба. Бесклеточный цемент не имеет цементоцитов и состоит из коллагеновых волокон и аморфного склеивающего вещества. Цемент тесно связан с дентином.
В течение жизни постоянно происходит отложение цемента. При некоторых заболеваниях, например, пародонтите и периодонтите, а также при повышении нагрузки на зуб происходит интенсивное отложение цемента, при этом формируется гиперцементоз (анкилоз зуба).
Поскольку наиболее часто нами упоминается коллаген, белок, имеющий довольно оригинальную структуру мы считаем уместным более подробно остановиться на его строении. Из всех белков, обнаруженных у высших позвоночных, коллаген наиболее распространенный: количество его в организме составляет около одной трети всего уровня белков. Сухожилия построены из параллельных пучков молекул коллагена. В отличие от a-кератинов коллаген растягивается с трудом. В настоящее время известны 19 типов коллагена, различающиеся по первичной структуре пептидных цепей, функциям и локализации в организме. Наиболее распространен 1 тип (кожа, кости, сухожилия, связки, роговица, дентин, пульпа, периодонт); 2-ой тип этого белка находится в хряще, стекловидном теле, передней части роговицы; 3-ий тип - в почках, печени, лимфатических узлах, аорте и других сосудах; 4-ый - локализуется в базальных мембранах. Отличие костного коллагена от других его видов в соединительной ткани заключается в том, что в первом имеются остатки фосфорной кислоты и дикарбоновых кислот. Характерной чертой коллагена является также то, что одну треть всех его аминокислотных остатков составляет глицин, а одну четвертую часть и более - пролин, гидроксипролин и гидроксилизин. Исключительно высокое содержание в коллагене таких аминокислот, которые нарушают a-спиральную структуру, дает основание предполагать, что коллаген не образует классическую альфа-спираль. В коллагене каждые три полипептидных цепи скручены и образуют тройную спираль (Рис. 4), при этом под влиянием регулярно располагающихся остатков пролина и оксипролина цепь принимает форму как бы ломаной спирали; это обусловливается жесткостью R-групп пролина, а также тем обстоятельством, что пептидные связи, в образовании которых участвуют пролин и оксипролин, не могут образовать водородных связей. NH-группы пептидных связей, в образовании которых участвуют остатки глицина, образуют межцепочечные водородные связи, которые также способствуют сохранению прочности структуры коллагена и делают ее устойчивой к растягиванию. Каждая полипептидная цепь коллагена имеет молекулярную массу 120000 и содержит около 1000 аминокислотных остатков. Полная трехспиральная единица называется тропоколлагеном. Тропоколлагеновые единицы уложены в волокнах коллагена в сухожилиях ступенчатым образом, чем и объясняется характерное для фибрилл коллагена расстояние между повторяющимися единицами (в зависимости от степени гидратации 600-700 А).
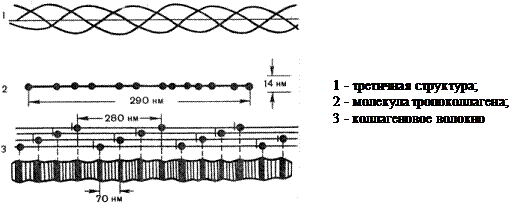 |
Рис. 4. Схема строения молекулы коллагена.
Прочность коллагеновых волокон (нить сечением около 1 мм выдержавает нагрузку более 10 кг) во многом достигается за счет дополнительных ковалентных «сшивок» между молекулами тропоколллагена. Установлено, что в образовании «сшивок» участвуют главным образом, остатки лизина и гидроксилизина.
Биосинтез данного протеина, осуществляемый в остео-, хондро- и фибробластах, протекает весьма сложно. Сначала его цепи синтезируются на полисомах в виде предшественников, образуя проколлаген. Затем пептидные цепочки посттрансляционно гидроксилируются и гликозилируются. Гидроксилирование проколлагена осуществляется с участием фермента протоколлаген-гидроксилазы, который в качестве кофермента использует витамин С (аскорбиновую кислоту). Негидроксилированный белок плохо секретируется из клеток, а если секретируется, то сразу же атакуется коллагеназой. Следовательно при гиповитаминозах С и Р содержание коллагена в тканях уменьшается, что в конечном итоге приводит к остепорозу.
Выделяют два пути распада коллагена - специфический и неспецифический. В первом случае коллаген разрушается коллагеназой на два фрагмента, которые в дальнейшем гидролизуются лизосомальными протеазами. Во втором - протеин денатурируется продуктами свободнорадикального окисления липидов, а затем подвергается действию протеаз. Продукты специфического распада коллагена стимулируют образование новых остео-, хондро-, фибробластов, то есть обусловливают регенерацию на клеточном уровне.
В костной ткани, разновидностью которой является цемент, содержится до 1% белков, регулирующих остеогенез. К ним относятся морфогены, митогены, факторы хемотаксиса и хемоаттракции.
Морфогены – это гликопротеиды, выделяющиеся из разрушающейся костной ткани и действующие на полипотентные клетки, вызывая в нужном направлении их дифференцировку. Важнейший из них – морфогенетический белок кости, состоящий из четырех субъединиц с общей молекулярной массой 75,5 кДа. Остеогенез под влиянием этого белка протекает по энхондальному типу, т.е. сначала образуется хрящ, а из него затем кость. Следует отметить, что этот протеин получен в чистом виде (США, 1983) и применяется при плохой регенерации кости. Выделен, но мало изучен фактор Тильманна (Мr=500-1000 Да), который быстро вызывает интрамембранозный остеогенез (без образования хряща), но в малом объеме. Так развивается кость нижней челюсти. Из дентина также получен морфогенетический фактор (белок), стимулирующий рост дентина. В эмали морфогенов не обнаружено.
Митогены – чаще всего гликофосфопротеиды – действуют на преддифференцированные клетки, сохранившие способность к делению, увеличивают их митотическую активность. В основе биохимического механизма действия лежит инициация репликации ДНК. Из кости выделено несколько таких факторов (костно-экстрагируемый фактор роста, фактор роста скелета). В дентине и эмали митогенов пока не обнаружено.
Факторы хемотаксиса и хемоаттракции – это гликопротеиды, определяющие движение и прикрепление новообразованных структур под действием морфо- и митогенов. Наиболее известны из них: фибронектин, остеонектин и остекальцин. За счет первого осуществляется взаимодействие между клетками и субстратами, этот белок способствует прикреплению ткани десны к челюсти. Остеонектин (кислый белок, богатый цистеином), являясь продуктом остеобластов, определяет миграцию преостеобластов и фиксацию апатитов на коллагене, то есть при его помощи происходит связывание минерального компонента с коллагеном. Остеокальцин – белок, маркирующий участки кости, которые должны подвергаться резорбции (распаду). Этот протеин содержит g-карбоксиглутаминовую кислоту и является витамин-К-зависимым, он вырабатывается в старом участке кости, к которому прикрепляется остеокласт и происходит разрушение этого участка. Остеокальцин принадлежит к группе, так называемых, гла-белков, являющихся инициаторами минерализации и создающими ядра кристаллизации. В эмали аналогичные функции выполняют амелогенины.
Морфогены, митогены, факторы хемотаксиса и хемоаттракции выполняют важную биологическую функцию, объединяя процесс деструкции и новообразования ткани. Разрушаясь, клетки выделяют их в среду, где воздействуя на разные стадии дифференцировки, эти факторы вызывают образование новых тканей.
Обнаружены соединения, действие которых противоположно влиянию морфо- и митогенов, называющиеся кейлонами. Они прочно связываются с морфо-, митогенами и препятствуют регенерации кости. В связи с этим возникает важная проблема разработки приемов регуляции синтеза морфо-, митогенов, факторов хемотаксиса. Известно, что синтез морфогенов кости активируется активными формами витамина D – кальцитриолами и тирокальцитонином, а подавляется глюкокортикостероидами (ГКС) и половыми гормонами. Следовательно, применение ГКС уменьшает регенерационные возможности кости и способствует развитию остеопороза. Осложнения течения консолидации переломов возможно в тех случаях, когда уже больному проводили курс лечения ГКС или анаболическими стероидами. Кроме того, длительное использование последних может спровоцировать перелом, так как масса мышц будет сопровождаться уменьшением прочности скелета. Также необходимо отметить, что скорость и полнота замещения дефекта при костной пластике определяется количеством морфогенов в подсаженной ткани. Поэтому, чем старше возраст донора, тем меньше вероятность успешного замещения дефекта. Кость, взятая у молодых доноров, будет замещаться плохо, если им проводили лечение ГКС и анаболическими гормонами.
ПУЛЬПА
Пульпа зуба – это соединительнотканное образование, состоящее из клеток и основного вещества.
Одонтобласты – это высокодифференцированные клетки пульпы, основная функция которых – образование дентина. В субодонтобластическом слое располагаются малодифференцированные клетки – пульпоциты, которые могут превращаться в одонтобласты. Обязательным компонентом пульпы являются фибробласты, которые создают рыхлую волокнистую соединительную ткань, которая замещает мезенхиму зубного сосочка. Защитную функцию в мякоти зуба выполняют макрофаги и плазматические клетки, при воспалительных процессах протективные свойства также может проявить и эндотелий кровеносных сосудов. Макрофаги секретируют факторы, индуцирующие продукцию коллагена фибробластами, а также лизоцим, интерферон, простагландины, циклические нуклеотиды, лизосомальные (кислые гидролазы, ДНК-азы и другие) и нелизосомальные (коллагеназа, эластаза и другие) ферменты.
В молодой пульпе меньше волокон коллагена и больше клеточных элементов. По мере ее старения количество клеток начинает уменьшаться.
Основное вещество (межклеточной матрикс) соединительной ткани состоит из представителей четырех классов: коллагена, протеогликанов, неколлагеновых структурных гликопротеидов и эластина. В матрикс наряду с нерастворимыми фибриллярными структурами погружены и клеточные образования (фибро-, дентинобласты, пульпоциты и др.).
На строении коллагена мы подробно останавливались в предыдущем разделе. Эластин, как и коллаген, содержит много глицина и пролина, количество гидроксипролина невелико, совсем отсутствует гидроксилизин, однако много в его составе валина. По механическим свойствам эластин отличается от коллагена высокими растяжимостью и эластичностью. Процент «сшивок» в молекуле данного белка исключительно высок, встречаются и многокомпонентные «сшивки» в виде узлов, как, например, в случае образования производных десмозина (рис. 5). Эластин преобладает в тканях, подвергающихся периодическому «растяжению – сокращению»: крупные кровеносные сосуды, связки, легкие. В связи с этим среди волокнистых структур пульпы этот протеин практически отсутствует, однако он имеется в тканях пародонта.

Рис. 5. Внутримолекулярная окислительная конденсация в эластине, приводящая к образованию десмозина.
Протеогликаны состоят из углеводного и белкового компонентов. Первый представлен гликозамингликанами – линейными полисахаридами, построенными из повторяющихся дисахаридов. Важнейшими из них являются:
а) Гиалуроновая кислота, состоящая из дисахаридных фрагментов, соединенных b-1,4-гликозидными связями. В свою очередь в состав фрагмента входят D-глюкуроновая кислота и N-ацетил-D-глюкозамин, связанные b-1,3-гликозидными связями. Молекулярная масса гиалуроновой кислоты равняется 105-107 Да. Растворы ее обладают высокой вязкостью за счет ее большой способности связывать воду (1 г может связать 0,5 л воды), поэтому они участвуют в регуляции проницаемости соединительной ткани, обеспечивая ее защиту от действия болезнетворных бактерий.
б) Хондроитин-сульфаты, отличающиеся от гиалуроновой кислоты тем, что в них N-ацетил-D-глюкозамин заменен на сульфатированный (в 4 или 6 положении) N-ацетил-D-галактозамин. Мr=10-60 кДа.
Поскольку гликозамингликаны в организме человека в чистом виде не встречаются, а всегда связаны с белком, то пептидный компонент протеогликанов синтезируется на полирибосомах, связанных с эндоплазматическим ретикулумом: пептидная цепь пронизывает мембрану и наращивается в сторону полости эндоплазматической сети, где начинается синтез углеводной части протеогликанов. Гликозамингликаны связываются с белком через гидроксильные группы серина. Здесь же в полости ретикулума происходит и сульфатирование углеводного компонента. В процессе синтеза вновь образованные молекулы перемещаются к аппарату Гольджи, где они включаются в секреторные гранулы и происходит экзоцитоз в составе этих гранул.
К одной полипетидной цепи последовательно прикрепляются цепи хондроитинсульфатов, образуя фигуру, напоминающую щеточку («ершик») (рис. 6).

Рис. 6. Строение протеогликана: 1 – полипептидная цепь; 2 – молекулы хондроитинсульфатов.
В межклеточном веществе протеогликаны образуют комплексы, в составе которых к молекуле гиалуроновой кислоты прикреплены полюсами хондроитинсульфатные протеогликановые единицы, образуя ствол с разветвленными ветвями или щетку, состоящую из малых щеточек (рис. 7).

Рис. 7. Фрагмент комплекса гиалуроновой кислоты с протеогликанами: 1– хондроитинсульфатные протеогликаны; 2 – молекула гиалуроновй кислоты.
Одноименные заряды сульфатированных цепей протеогликанов и гидратация обусловливают их взаимооталкивание. Поэтому комплексы занимают максимально возможное пространство. По тем же причинам комплексы отталкиваются друг от друга и их общий объем оказывается значительно большим, чем объем собственно молекул, если бы они были плотно уложены в пространстве.
При увеличении внешнего давления молекулы сближаются, выжимая воду из межмолекулярных промежутков, по прекращении давления восстанавливаются исходные расстояния. Это обеспечивает всей совокупности описываемых комплексов в матриксе роль амортизаторов.
Связанная гликозаминогликанами вода представляет собой гель, который ограничивает диффузию и проницаемость межклеточного вещества. Проницаемость и соответственно диффузия повышаются при разрушении гиалуроновой кислоты гиалуронидазой. Этот фермент выделяют некоторые микроорганизмы, и он рассматривается как фактор агрессии, дающий способность патогенным микроорганизмам распространяться в тканях (возбудители газовой гангрены, гнойных инфекций).
Способность гликозаминогликанов как поливалентных анионов связывать большие количества ионов натрия определяет их участие в водно-солевом обмене.
Важную роль в структурной организации межклеточного матрикса играют неколлагеновые структурные гликопротеины, из которых детальнее изучен фибронектин, упомянутый нами в разделе 1.3. Кроме того, этот белок участвует в объединении между собой неклеточных структур основного вещества и клеток, погруженных в него. Фибронектин синтезируется и выделяется в межклеточное пространство многими клетками. Он находится на поверхности плазматических мембран, в базальных мембранах, глубине межклеточного вещества соединительной ткани и плазме крови. Его роль как фактора, объединяющего (наряду с другими менее изученными белками) компоненты межклеточного матрикса в единую систему (ткань), обеспечивается своеобразной структурой. Молекула фибронектина включает в себя две почти одинаковые пептидные цепи, соединяющиеся вблизи С-конца дисульфидными связями. Каждая цепь содержит 7-8 доменов, между которыми находятся неструктурированные гибкие участки. Молекула фибронектина располагает специфическими центрами связывания для некоторых компонентов плазматической мембраны (ганглиозидов и сиалопротеидов), для коллагена, гиалуроновой кислоты и сульфированных гликозаминогликанов. Это дает возможность фибронектину связывать в одну систему клетки и неклеточные компоненты матрикса. Нековалентные связи закрепляются благодаря наличию у молекулы фибронектина центра связывания для трансглутаминазы. Этот энзим катализирует реакцию между остатками глутамина и лизина в разных белках, соединяя их между собой. Так происходит сшивка молекул фибронектина друг с другом, коллагеном и другими неклеточными элементами матрикса или плазматических мембран.
Таким образом, межклеточный матрикс пульпы выполняет разнообразные функции: влияет на распространение инфекционного процесса в ткани, обменные реакции в клетках, устойчивость кристаллоидов, на рецепцию гормонов, витаминов и других веществ, участвующих в обмене. Метаболизм в клетках и волокнах пульпы проходит через основное вещество. Для того чтобы проникнуть из кровеносных сосудов в клетки, питательные вещества проходят через основное вещество, предварительно растворяясь в нем. Точно также соединения, выделенные клеткой, должны пройти через основное вещество, чтобы попасть в концевые сосуды. Таким образом обменная роль основного вещества влияет на жизнеспособность пульпы.
ПАРОДОНТ
Пародонт объединяет комплекс тканей, имеющих генетическую и функциональную общность: периодонт, кость альвеолы, цемент корня зуба, десна с надкостницей и зубодесневое соединение.
Десна делится на свободную и прикрепленную, которая неподвижно соединена с подлежащими тканями за счет соединения волокон собственной оболочки с надкостницей альвеолярных отростков челюстей. У шейки зуба в нее вплетаются волокна циркулярной связки зуба, которая вместе с другими волокнами образует толстую мембрану, предназначенную для защиты периодонта от механических повреждений. Свободная десна прилежит к поверхности зуба, отделяясь от нее десневой бороздкой, которая заполнена десневой жидкостью (см. раздел 2.2.). Основную массу ткани десны составляют коллагеновые волокна, но кроме них обнаруживаются ретикулярные и эластические волокна. Десна хорошо иннервирована и содержит различные виды нервных окончаний.
Периодонт построен двумя видами соединительной ткани (плотной волокнистой и рыхлой неоформленной), постоянно подвергается воздействию внешних средовых и внутренних факторов и несмотря на большие перегрузки повреждения не происходит. Это свидетельствует о больших адаптационных возможностях периодонта. Он обладает следующими функциями: барьерной, трофической, рефлекторной регуляции жевательного давления, пластической, амортизирующей, опорно-фиксирующей.
Возрастные изменения тканей пародонта. Инволютивные изменения десны сводятся к следующему: склонность к гиперкератозу, истончение базального слоя, атрофия эпителиальных клеток, гомогенизация волокон субэпителиального слоя десны, снижение числа капилляров, расширение и утолщение стенки сосудов, уменьшение количества коллагена, исчезновение гликогена в клетках шиповидного слоя, уменьшение уровня лизоцима в тканях десны, дегидратация их. Большую роль в старении тканей играют изменения сосудов, коллагена, активности ферментов, иммунобиологической реактивности, когда процессы распада клеток начинают преобладать над процессами их восстановления.
В костной ткани отмечается уменьшение прободающих волокон цемента, усиление гиалиноза, увеличение активности и количества протеолитических энзимов, расширение костномозговых пространств, утолщение кортикальной пластины, расширение каналов остеонов и заполнение их жировой тканью. Разрушение костной ткани с возрастом может быть связано со снижением анаболического действия половых гормонов при относительном преобладании глюкокортикостероидов.
Инволютивные сдвиги в периодонте характеризуются исчезновением волокон промежуточного сплетения, деструкцией части коллагеновых волокон, уменьшением числа клеточных элементов.
Описанные выше особенности строения и возрастные изменения позволят врачам более точно и своевременно диагностировать поражения пародонта. На биохимических сдвигах при его патологии мы остановимся в 4 разделе.
II. БИОХИМИЯ ЖИДКОСТЕЙ ПОЛОСТИ РТА И ЗУБНОГО НАЛЕТА
СЛЮНА
В последнее десятилетие возросло внимание исследователей к изучению свойств слюнного секрета у человека. Это связано не только с бурным развитием аналитическрй техники, но и с растущим интересом к уникальным свойствам слюны и диагностическим возможностям, связанным с ней. Особенности настоящего времени (социально-демографические причины, рост случаев инфицирования через кровь СПИДом и другими опасными заболеваниями, распространение наркомании и т.п.) делают остро необходимым поиск новых, неинвазивных и безопасных методов диагностики и контроля состояния пациентов. В этом отношении анализ слюны представляет собой одну из наиболее значимых альтернатив анализу крови, в ряде случаев не только дополняя его, но, даже, заменяя. Медиков вообще, и стоматологов, в частности, привлекают также простота взятия и анализа проб слюнной жидкости, возможность частого взятия проб, и полная безопасность при этом для здоровья пациента. Основное же внимание исследователей привлекают возможности диагностирования патологических состояний разнообразных систем организма.
Слюна является одной из шести биологических жидкостей организма и играет жизненно важную роль в сохранении интеграции тканей полости рта, а именно: в отборе, проглатывании и подготовке пищи к перевариванию; в нашей способности общаться друг с другом. Функции слюны в поддержании целостности тканей полости рта обеспечиваются, прежде всего, нестимулированной (в состоянии покоя) ее секрецией, которая происходит в отсутствии внешней стимуляции (например, жевания или вкусовых раздражителей). Скорость ее выделения может быть подвержена довольно значительным суточным и сезонным колебаниям. Пик нестимулированной секреции приходится на середину дня, а в ночное время выделение слюны резко снижается. Пищеварительные функции обеспечиваются стимулированным током слюны в ходе самого приема пищи или при жевании. Стимулированная слюна отличается от нестимулированной как по скорости секреции, так и по составу. Первая характеризуется заметным преимуществом по сравнению с нестимулированной по нейтрализующей способности, минерализующему потенциалу, содержанию факторов местного иммунитета.
Слюна осуществляет много функций в защите и поддержании целостности слизистой оболочки полости рта, а именно:
n принимает участие в очищении полости рта от остатков пищи, налета и бактерий;
n благодаря буферным свойствам, она нейтрализует отрицательное действие сильных кислот и щелочей в пределах емкости буфера;
n обеспечивает поступление ионов, необходимых для реминерализации зубов;
n со слюной выделяются низкомолекулярные азотсодержащие соединения (мочевина и др.), катионы, анионы, метаболиты гормонов, лекарственных препаратов и другие;
n обладает противобактериальными, противогрибковыми и противовирусными свойствами.
В дополнение к этому, некоторые компоненты слюны усиливают моторные функции жевания, проглатывания и произнесения звуков, а также сенсорные и хемосенсорные функции в полости рта (табл. 2).
Таблица 2
Основные функции слюны в организме (Inter.Dental.J., 1992, v. 42, P. 291)

Как заметил Клод Бернар, мы распознаем функции органа, выявляя последствия его отсутствия. Важность слюны наилучшим образом демонстрируется у тех пациентов, у которых фактически слюнной секрет не поступает в полость рта. Такую отягощенную ситуацию мы находим у больных с поздними стадиями синдрома Сьегрена, который является аутоиммунным заболеванием, а также у страдающих раком, получивших в качестве лечения большие дозы облучения. У таких людей отмечается резко выраженная сухость полости рта и горла. Им очень трудно принимать пищу, они должны постоянно “потягивать” воду при жевании, у них много проблем с проглатыванием. Они жалуются на жжение в полости рта, необычные вкусовые ощущения, трудности в разговоре, на языке образуются щели и дольки. Постоянными проблемами становятся кариес и эрозия. Кариес начинает поражать нетипичные для этого заболевания поверхности зубов. Скорость секреции слюны у таких больных минимальна и иногда невозможно получить сколько-нибудь заметное количество слюны из Стенонова и Вартонова протоков. Эти изменения характерны для заключительной стадии прогрессивной гипофункции слюнных желез. Жизнь таких пациентов продолжается без секреции слюны, и становится значительно менее приятной, а для некоторых больных она становится просто непереносимой. В настоящее время стоматологи выделяют новое заболевание – «жвачную болезнь», при котором наблюдается атрофия слюнных желез вследствие неправильного использования жевательных резинок.
Слюна является комплексным секретом. Ротовую жидкость обычно называют «смешанной слюной». Она первично состоит из секретов больших и малых слюнных желез. В дополнение к этому смешанная слюна содержит ряд компонентов неслюнного происхождения. К ним относятся: жидкость зубодесневой бороздки, сывороточные составляющие и клетки крови, бактерии и продукты их жизнедеятельности, слущенный эпителий и клеточные элементы, вирусы и грибки, остатки пищи и выделения из бронхов. И даже чистые секреты из больших желез, при сборе непосредственно из отверстий основных протоков околоушных, подчелюстных и подъязычных желез, содержат не только синтезированную слюну, но также и некоторые вещества, разносимые током крови, например, лекарственные препараты, гормоны и вирусы. Они достигают слюны и могут быть обнаружены в ней.
Целый ряд физиологических факторов влияет на состав смешанной слюны. Важными среди них являются источник, метод сбора и степень стимулирования.
Большие слюнные железы построены из разных железистых или секреторных клеток, которые запрограммированы на синтез совершенно различных секретов. Околоушные железы имеют серозные (белковые) секреторные клетки и образуют белковосодержащий водянистый секрет; слюна из подъязычных желез – мукозная (слизеподобная) и поэтому более вязкая. Подчелюстные железы имеют оба типа секреторных клеток (серозные и слизистые) и образуют слюну с более низким содержанием белка и более высокой вязкостью, чем секрет околоушных желез. Малые слюнные железы разбросаны по всей полости рта и являются чисто слизистыми железами. Они вырабатывают особенно вязкую слюну с высоким содержанием секреторного иммуноглобулина А. В ответ на стимулирование, количество выделяемой слюны может увеличиться многократно, но при этом происходит существенное изменение ее консистенции и концентрации многих компонентов.
Объем и состав слюны, выделяющейся за сутки, зависит от многих факторов, в частности, от особенностей пищи. В среднем у взрослого человека суточное количество слюны составляет около 1500 мл. Однако, скорость секреции меняется в зависимости от ряда факторов: возраста (после 55-60 лет слюноотделение замедляется), нервного возбуждения («сухость во рту»), пищевого раздражителя. Во время сна слюны выделяется в 8-10 раз меньше – от 0,5 до 0,05 мл/мин, чем в период бодрствования, а при стимуляции 2,0-2,5 мл/мин. С уменьшением слюноотделения увеличивается степень поражения зубов кариесом. В практической деятельности стоматолог имеет дело только с ротовой жидкостью, так как она является средой, в которой постоянно находятся органы и ткани полости рта.
Состав слюны, общая характеристика. На 99% слюна состоит из воды. Оставшийся 1% сухого остатка приходится на белки, липиды, глюкозу, мочевину и электролиты, в основном, катионы натрия, кальция, анионы хлоридов и фосфатов.
Большую часть молекул органических соединений продуцируют железистые клетки, меньшую – синтезируют клетки протоков, некоторые из них транспортируются в слюну из крови. Составные вещества слюны представлены в таблице 3.
Неорганические компоненты слюны. Неорганические соединения в смешанной слюне составляют 0,22% и представлены макро- и микроэлементами: Na, K, Ca, Mo, Cu, Fe, P, F, S и др. Минеральные вещества могут находиться как в ионизированной форме в виде простых ионов, так и в составе органических и неорганических соединений – солей, хелатов, белков.
Важно то, что качественный и количественный состав электролитов в слюне определяет рН и буферную емкость. В то же время содержание электролитов в слюне меняется во времени и имеет циркадные ритмы. Существует тесная взаимосвязь между количеством электролитов, скоростью слюноотделения, временными колебаниями рН и температурой полости рта.
Смешанная слюна имеет рН, близкий к нейтральному (6,8-7,4), что зависит от соотношения NaHPO4-/NaH2PO4, аммонийных групп (NH4+), CO2 и белка. рН слюны покоя отличается от рН стимулированной слюны. Так, нестимулированный секрет из паротидной и подчелюстной слюнных желез имеет умеренно кислый рН (5,8), который увеличивается до 7,4 при последующей стимуляции. Интересно, что этот сдвиг совпадает с увеличением в слюне ионов НСО3- и уменьшением NaH2PO4.
В смешанную слюну ионы натрия и калия поступают с секретом околоушных и подчелюстных слюнных желез. Слюна из подчелюстных слюнных желез содержит 8-14 ммоль/л калия и 6-13 ммоль/л натрия. Паротидная слюна содержит больше калия - около 25-49 ммоль/л и значительно меньше натрия, всего 2-8 ммоль/л, то есть по соотношению электролитов секреты желез больше напоминают тканевую жидкость, а не сыворотку крови.
Таблица 3
Компоненты слюны (Inter.Dental.J., 1992, v. 42, P. 292)

Слюна перенасыщена ионами кальция и фосфора. В ней фосфат содержится в двух формах: свободный неорганический и связанный с белками и другими соединениями. Уровень общего фосфата в слюне достигает до 7,9 ммоль/л, из них 70% приходится на долю неорганического фосфата (5,0-5,6 ммоль/л). В свою очередь неорганический фосфат представлен в виде НРО42- и Н2РО4-, которые образуют фосфатную буферную систему.
Содержание ионов кальция в слюне близко к его концентрации в плазме – 2,1-2,3 ммоль/л. Этот щелочноземельный металл, как и фосфаты находится в ионизированной форме (около 50%), а остальная часть в соединении с белками, фосфатами, цитратом, карбонатом и другими анионами. Существует коэффициент отношения Са2+/Са общий, который равен 0,54.
Такая концентрация кальция и фосфатов необходима для поддержания постоянства состава тканей зуба. Данный механизм поддерживается тремя основными процессами: регуляция рН, препятствие растворению зуба и внедрение ионов в минерализованные ткани. Кальций и фосфаты не выпадают в осадок, потому что основу слюны составляют мицеллы, связывающие большое количество воды, в результате чего все водное пространство оказывается связанным и поделенным между ними (Рис. 8).

А Б
Рис. 8. Строение мицеллы фосфата кальция в физиологических условиях (А) и при патологии полости рта (Б).
1 – ядро; 2 – потенциалопределяющие ионы; 3 – противоионы; 4 – диффузный слой (Леонтьев В.К. и соавт., 1991).
Молекулы фосфата кальция – [Са3(РО4)2]n - образуют нерастворимое ядро. На поверхности ядра сорбируются находящиеся в слюне в избытке молекулы гидрофосфата – НРО42-. В адсорбционном и диффузном слоях мицеллы будут находиться ионы Са2+, являющиеся противоионами. Белки, связывающие огромное количество воды (в частности муцин), способствуют распределению всего объема слюны между мицеллами, в результате чего она структурируется, приобретает высокую вязкость, становится малоподвижной. Таким образом, состав мицелл можно представить в следующем виде:
{[n(Ca3PO4)2]mHPO42- (m-x)Ca2+}2х- Са2+
В кислой среде заряд мицеллы может уменьшиться вдвое и снизится устойчивость мицеллы, а ионы дигидрофосфата такой мицеллы не участвуют в процессе реминерализации. При понижении рН до 6,2 слюна становится недонасыщенной кальцием и неорганическим фосфатом и превращается в деминерализующую. Появляются ионы Н2РО4- вместо НРО42-. Подщелачивание сопровождается увеличением ионов РО43-, которые участвуют в образовании труднорастворимого соединения Са3(РО4)2, осаждающегося в виде зубного камня.
Микрокристаллизация слюны. Еще в 1977г. П.А. Леус показал, что на предметном стекле после высушивания капли ротовой жидкости остается осадок, имеющий различное микроскопическое строение. Микрокристаллизация слюны имеет индивидуальные особенности и это может быть связано с общим состоянием организма, полости рта, нагрузкой питательными веществами. Образование микрокристаллов может характеризовать реминерализующую способность слюны, а интенсивность кариеса связана с типом микрокристаллизации. Различают три вида:
I тип – четкий рисунок удлиненных кристаллопризматических структур, сросшихся между собой и занимающих всю поверхность капли. Этот тип присущ для компенсированной формы течения кариеса.
II тип – в центре капли видны отдельные дендритные кристаллопризматические структуры меньших размеров, чем при I типе. Характерен для субкомпенсированной формы течения кариеса.
III тип – по всей капле просматривается большое количество изометрически расположенных кристаллических структур неправильной формы. Этот тип микрокристаллизации характерен для декомпенсированной формы кариеса.
Вместе с тем, микрокристаллизация слюны отражает состояние организма в целом, поэтому данный параметр можно использовать для экспресс-диагностики некоторых соматических заболеваний.
Органические компоненты слюны, характеристика. Как видно из таблицы 2 смешанная слюна содержит белки, полипептиды, липиды, витамины, гормоны, органические кислоты. Количество их зависит от состояния организма, ротовой полости и различается по количественным оценкам в осадке слюны и надосадочной жидкости.
В слюне определяется от 1,5 до 4,0 г/л белка. Методом двумерного электрофореза определено около 500 пятен, характеризующих различные протеины, но только 120-150 являются продуктом слюнных желез, а остальные имеют бактериальное и клеточное (чаще лейкоцитарное) происхождение. Большая часть белков слюнных желез вырабатывается секреторными клетками и делится на несколько классов. Каждый класс имеет определенное число отличающихся, но близко связанных членов (генетический полиморфизм). Они включают: богатые пролином белки; гистатины; пептиды богатые тирозином; муцины – низко- и высокомолекулярные; амилазы (альфа и гамма); а также несколько пероксидаз слюны. Содержание общего белка в слюне практически здоровых людей составляет в среднем 187,71+10,9 мг/дл, тогда как у больных язвенной болезнью желудочно-кишечного тракта до лечения этот показатель достоверно повышается.
Другие протеины слюны существуют в гомогенной форме. Некоторые белки продуцируются секреторными клетками, остальные – клетками протоков. К железистым белкам относятся фактор роста эпителия, секреторный компонент и лактоферрин. Лизоцим продуцируется клетками протоков. Вместе с тем точное место происхождения многих компонентов до сих пор неизвестно. К компонентам, транспортируемым прямо из кровотока в слюну, относится альбумин, иммуноглобулины G, А и М, витамины, лекарственные препараты, гормоны, электролиты и вода. Отмечена хорошая корреляция по уровням ряда гормонов и лекарств между плазмой крови и слюной. Это обстоятельство явилось основой предложений использовать анализы слюны как неинвазивный метод динамического контроля уровня гормонов, терапевтических средств и запрещенных к употреблению препаратов. Многие белки и другие компоненты слюны защищают мягкие и твердые ткани полости рта. Муцины слюны покрывают и смазывают поверхности слизистой оболочки. Их крупные молекулы предотвращают прилипание бактерий и колонизацию, защищают ткани от физического повреждения и позволяют им устоять перед тепловыми перепадами. Некоторые из протеинов, такие как лизоцим, обладают способностью разрушать стенку бактериальных клеток; другие, как гистатин, лактоферрин и лактопероксидаза угнетают рост микробов; третьи – антитела слюны, например, секреторный иммуноглобулин А и липаза слюны, могут защищать зубы от кариеса. Ниже мы остановимся на характеристике наиболее значимых соединений.
Гликопротеины слюны. Большинство белков слюны относится к данному классу, причем углеводная компонента довольна вариабельна как в количественном (от 4 до 40%), так и в качественном отношении. Синтез протекает в две стадии: вначале образуется белковое ядро, к которому присоединяется углеводная цепь. Последних может быть несколько. В условиях стимуляции могут синтезироваться неполноценные гликопротеины и слюна становится менее вязкой. Наиболее изучены из данных макромолекул муцин, иммуноглобулины и группоспецифические вещества.
Муцин. С ним прямо связана вязкость слюны. Муцины входят также в состав секретов бронхов и кишечника, семенной жидкости и выделений шейки матки. Все они играют роль смазки и защищают подлежащие ткани от повреждений как механических, так и химических. В полипептидной цепи муцина из подчелюстной слюнной железы содержится большое количество треонина и пролина. К радикалам треонина через образование О-гликозидной связи присоединяются молекулы N-ацетилнейраминовой кислоты, N-ацетилгалактозамина, фукозы и галактозы. Сам белок напоминает по своему строению гребенку (так называемые щеточные структуры): короткие углеводные цепи, как зубья торчат из жесткой, богатой пролином полипептидной цепи, которые соединяются между собой дисульфидными мостиками и образуются большие молекулы с особыми вязкими свойствами. Муцин способен адсорбироваться на поверхности зуба, образуя нерастворимую пленку, имеющую слабый отрицательный заряд. Муцин легко преципитируется на зубах, особенно при низком значении рН. Кроме того, он может образовывать комплексы с липидами и при взаимодействии с мембранами эпителиальных клеток участвовать в построении пелликулы. Последняя выполняет роль селективного фильтра и барьера, обеспечивающего защиту подлежащих клеток, предотвращающего высушивание и контролирующего проницаемость слизистой оболочки. Защитные качества пелликулы зависят от размера мукоидного геля. Однако муцин также легко адсорбирует на своей поверхности и микроорганизмы, метаболиты которых, в конечном итоге, могут привести к деминерализации эмали. Содержание муцина в слюне здоровых людей составляет 75,4+8,8мг/дл.
Иммуноглобулины слюны. В ней присутствуют все 5 классов: IgA, IgG, IgD, IgM, IgE, которые различаются по молекулярной массе, конфигурации и углеводной компоненте, но вторичная структура у всех этих соединений одинакова: 2 легких (L) и 2 тяжелых (Н) цепи, аминокислоты в которых упакованы в домены. Иммуноглобулины как правило поступают из сыворотки и с секретом слюнных желез. Исключение составляет IgA2 (IgAs), который синтезируется в околоушных (90%) и подчелюстных (10%) слюнных железах. Его концентрация в слюне в 100 раз выше по сравнению с IgG и IgM. Он отличается от других более высокой молекулярной массой, что связано с появлением дополнительных пептидов. Два четырехцепочечных мономера Н и L цепей образуют димер, в состав которого также входят секреторный гликопротеид (SP) и добавочный полипетид (J-цепь) (рис. 9). Показано, что H, L и J цепи синтезируются в плазменных клетках интерстициальной ткани слюнных желез. При поступлении белка в ацинарные клетки он соединяется с гликопротеидом SP, который синтезируется серозными эпителиальными клетками. Такая структура предохраняет молекулу иммуноглобулина от разрушающего действия многочисленных ферментов, находящихся в секретах слизистых оболочек. Механизм действия IgAs заключается в том, что он активирует альтернативным путем комплемент, что в свою очередь приводит к лизису микроорганизмов. IgAs препятствует адгезии бактерий к эпителиальным клеткам, затрудняя тем самым колонизацию их на слизистой.
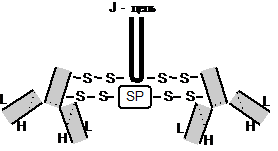
Рис. 9. Схема строения секреторного иммуноглобулина А:
Н – тяжелая цепь; L – легкая цепь; SP – секреторный компонент.
Группоспецифические вещества слюны в отличие от эритроцитарных содержат 85% углеводов и 15% белка. Антигенная специфичность веществ определяется конформацией некоторых остатков сахаров, расположенных на концах углеводных цепей. Концентрация группоспецифических веществ в слюне равна 10-130 мг/л. Они в основном поступают с секретом слюнных желез и точно соответствуют группе крови. Исследование группоспецифических веществ в слюне используется в судебной медицине для установления группы крови в тех случаях, когда это невозможно сделать иначе.
Кроме того, в слюне обнаружено несколько специфических белков, характеризующихся преобладанием одной или нескольких аминокислот. К ним относятся белки, богатые пролином (PRP), пептиды, богатые тирозином – стайзерины, белки, богатые гистидином – гистатины и цистатины – белки, богатые цистеином.
Белки, богатые пролином (PRP), были открыты Оппенгеймером в 1971 году в паротидной слюне и составляют до 70% от общего количества всех белков в этом секрете. Молекулярная масса их колеблется от 6 до 12 кДа, 75% от всего числа аминокислот в данных соединениях приходится на пролин, глицин, глутаминовую и аспарагиновую аминокислоты. В полости рта PRP выполняют несколько функций. Они легко адсорбируются на поверхности эмали и являются компонентами приобретенной пелликулы зуба, задерживая его деминерализацию и ингибируя излишнее осаждение минералов. Таким образом поддерживают постоянство кальция и фосфора в эмали зуба. Они могут связывать определенные микроорганизмы и участвуют тем самым в формировании микробных колоний бляшки. PRP необходимы для смачивания пищевого комка.
Гистатины – основные олигопептиды, включающие 12 подклассов. Полностью установлена их первичная структура и показано, что они состоят из 7-38 аминокислотных остатков. Сравнение последовательности аминокислот в различных гистатинах выявило большую степень сходства между ними и только гистатины подклассов 1 и 2 значительно отличаются от других членов этого семейства белков. Считается, что гистатин 2 является фрагментом гистатина 1, а гистатины 4-12 образуются при гидролизе гистатина 3. Этот ограниченный протеолиз протекает при участии слюнного калликреина и некоторых других протеиназ. Это образование происходит либо в секреторных везикулах, либо при прохождении белков через железистые протоки.
Гистатин 1 участвует в образовании приобретенной пелликулы зуба. Он также является мощным ингибитором роста кристаллов гидроксиапатита, что необходимо для стабилизации растворенных минералов в жидкостях полости рта. Смесь частично очищенных гистатинов вызывала усиление гликолитической активности части выделенных бактерий полости рта и подавляла рост некоторых видов Str. mutans. Гистатин 5 вовлечен в процесс подавления слюной вируса иммунодефицита и грибков (Candida albicans). Одним из механизмов такого антимикробного и антивирусного действия является взаимодействие гистатина 5 с различными протеиназами, выделенными из микроорганизмов ротовой полости.
Стайзерины – группа пептидов, богатых тирозином. Эти соединения представляют собой фосфопептиды, состоящие из 40-43 аминокислот. Они ( от англ. sthaiser - прилипать) вместе с другими секреторными протеинами ингибируют спонтанную преципитацию фосфорнокальциевых солей на поверхности зуба, в ротовой полости и в слюнных железах.
Цистатины были открыты в 1984 году. Они синтезируются в серозных клетках околоушных и подчелюстных слюнных желез. Всего обнаружено 8 типов, из них 6 белков охарактеризовано – это цистатин S, удлиненные его формы – S-HSP-12, SA, SN, SAI, SAIII. Цистатины – это кислые белки с молекулярной массой 9,5-13 кДа. Они ингибируют активность цистеиновых протеиназ, к которым относятся катепсины В, Н, L и другие протеиназы, у которых в активном центре присутствует остаток цистеина.
Помимо ингибирующей активности цистатин SAIII содержит 4 остатка фосфосерина и предполагается, что они вовлекаются в связывание фосфорнокальциевых соединений с эмалью зуба. Часть этих белков находится в приобретенной пелликуле зуба. Высокая адгезивная способность цистатинов SАI и SAIII связана с тем, что они имеют сходство в аминокислотной последовательности с фибронектином и ламинином. Через ингибирование активности цистеиновых протеиназ слюнные цистатины выполняют свою антимикробную и антивирусную функцию. Кроме того, они защищают белки слюны от энзиматического расщепления ферментами микроорганизмов.
Альбумин. В смешанной слюне этот белок определяется в небольшом количестве, его происхождение пока остается неясным.
Из слюнных желез в слюну поступают биологически активные соединения, к ним относятся фактор роста эпидермиса, фактор роста нервов, фактор роста мезодермы, эритропоэтин, ренин и некоторые другие.
Ферменты слюны. В смешанной слюне представлены пять оcновных групп ферментов: карбоангидразы, эстеразы, протеолитические, переноса и смешанная группа. Всего определяется активность более 100 ферментов. По происхождению ферменты делятся на три группы: секретируемые паренхимой слюнной железы, образующиеся в процессе ферментативной деятельности бактерий и образующиеся в процессе распада лейкоцитов в полости рта. В связи с обнаружением в слюне и ротовой жидкости человека секретируемых из крови ферментов (пепсиноген, трипсиноген) было обнаружено, что слюна и кровь содержат несколько изоформ амилазы, доказано их происхождение из разных желез-продуцентов и существенные изменения при многих гастроэнтерологических заболеваниях. Полученные результаты свидетельствуют о гетерогенности a-амилазы ротовой жидкости и слюны и о повышении саливадиагностической информативности определения в них не только общей амилолитической активности, но и s- и p-a-амилазы с применением высокоселективного ингибитора s-a-амилазы человека.
Гликозидазы: a-амилаза и лизоцим.
Слюнная a-амилаза расщепляет 1-4 гликозидные связи в крахмале и гликогене. По своим иммунохимическим свойствам и аминокислотному составу слюнная альфа-амилаза очень сходна с панкреатической. У обеих определяется 94% сходства в аминокислотной последовательности, но кодируются они различными генами (АМУ1 и АМУ2). Амилаза является сложным белком с четвертичной структурой. Ее изоферменты из 11 белков можно объединить в 2 семейства. Белки семейства А имеют молекулярную массу 62 кДа и содержат остатки углеводов, а изоэнзимы В лишены углеводного компонента и имеют М.м. 56 кДа. В смешанной слюне идентифицирован фермент, который путем дегликозилирования изоамилаз А превращает их в семейство В. Амилаза выделяется с секретом паротидной железы, где концентрация ее составляет 648-803 мкг/мл и не зависит от возраста, но меняется в течение суток и в зависимости от чистки зубов и приема пищи.
Лизоцим гидролизует гликозидную связь между С-1 N-ацетилмурамовой кислоты и С-4 N-ацетилглюкозамина, которые формируют полисахарид клеточной стенки бактерий. Фермент представляет собой одну полипептидную цепь из 129 аминокислотных остатков и массой 14,6 кДа. Стабильность фермента обеспечивают четыре поперечных дисульфидных мостика. Лизоцим определяется также в десневой жидкости, слезах, курином белке, что обеспечивает формы неспецифической антибактериальной защиты. Активность этого фермента в ротовой полости может уменьшаться при тяжелых формах пародонтита.
Другие гликозидазы. В смешанной слюне определяется активность нескольких гликозидаз – это a-L-фукозидаза, a- и b-гликозидаза, a- и b-галактозидаза, a-D-маннозидаза, b-глюкуронидаза, b-гиалуронидаза, нейраминидаза, b-N-ацетилгексозаминидазы. Все они имеют различное происхождение и свойства. a-L-фукозидаза выделяется с секретом околоушной железы и расщепляет a-1,2 связи в коротких олигосахаридных цепях. b-N-ацетилгексозаминидаза содержится в секретах больших слюнных желез, а также образуется смешанной культурой микрофлоры полости рта.
Остальные имеют бактериальное происхождение и наиболее активны в кислой среде.
Пероксидазы. В цельной смешанной слюне определяются две разных группы слюнной пероксидазы. Ферменты с изоэлектрической точкой в щелочной среде образуются в околоушной и подчелюстной слюнных железах, и представлены множественными формами с молекулярной массой 78, 80 и 28 кДа. Это гемопротеиды, однако в своем составе содержат и углеводы (4,6%). Энзимы находятся в комплексе с одним из белков, богатых пролином.
Бактерии зубной бляшки, мелкие слюнные железы и эпителиальная выстилка слизистой оболочки полости рта вообще лишены этого фермента.
Данная пероксидаза катализирует окисление роданидов (тиоцинатов, -SCN) в присутствии Н2О2 с образованием НOSCN и гипотиоцината (-OSСN). Антибактериальная активность последнего в 10 раз выше, чем у Н2О2. Из гипотиоцианта в дальнейшем спонтанно генерируются активные формы кислорода, которые разрушают липиды клеточных мембран микроорганизмов. Наибольшее окисление роданидов протекает при рН=5-6. При этом создается опасность деминерализации твердых тканей зуба.
Миелопероксидазапоступает в слюну преимущественно из азурофильных гранул полиморфноядерных лейкоцитов. Этот фермент, образуя энзим-субстратный комплекс с пероксидом водорода, окисляет анионы галогена (Cl-, Br-, I-) и образует ионы гипохлорита (-OCl), хлоридиума (Cl+) и молекулы хлора. При взаимодействии гипохлорита с Н2О2 образуется активная форма кислорода – синглентный (1О2), обладающая антибактериальным и антивирусным эффектами. Повышение уровня миелопероксидазы в слюне отражает, в основном, процесс развития лейкоцитарно-эндотелиального дисбаланса в его крайнем выражении, прорыве гисто-гематического барьера и имбибиции тканей пародонта активированными лейкоцитами, активно высвобождающими миелопероксидазу в окружающую среду. Значение изменений активности миелопероксидазы для диагностики тяжести поражения пародонта подтверждается и наличием зависимости ее содержания в слюне от степени тяжести пародонтита. При этом регистрируется отчетливая зависимость между тяжестью пародонтита и профилем активности фермента в слюне. Отражая степень лейкоцитарной инфильтрации в ткань и степень поражающего эффекта на тканевые структуры, активность миелопероксидазы в слюне может считаться одним из критериев, позволяющих оценить прогрессирование деструктивных процессов в тканях пародонта.
Щелочная и кислая фосфатазы отщепляют неорганический фосфат от органических соединений. Кислая фосфатаза в смешанную слюну попадает с секретом больших слюнных желез, а также бактерий, лейкоцитов и эпителиальных клеток. В слюне определяется до 4 изоферментов кислой фосфатазы.
Щелочная фосфатаза, оптимум рН которой 9,1-10,5, также определяется в смешанной слюне. Активность фермента очень низка в секретах слюнных желез и ее происхождение в слюне связывают с клеточными элементами.
Активность обоих энзимов в слюне, как правило, увеличивается при пародонтите, гингивите. Противоречивые данные об изменении скорости гидролиза фосфорных эфиров получены при кариесе. Вместе с тем выявлено, что повышенная растворимость эмали при использовании реминерализующей терапии совпадает с высокой активностью щелочной фосфатазы.
В слюне определяется невысокая активность протеиназ и их ингибиторов, оптимум рН которых находится и в кислой и в слабощелочной среде. К ним относятся калликреин и другие трипсиноподобные протеиназы, катепсины D, В, а также a1-ингибитор протеиназ, a2-макроглобулин и другие. Основная их функция – регулируемый ограниченный протеолиз белков с образованием активных форм белка или активных олигопептидов.
Нуклеазы ротовой жидкости (ДНК-аза, РНК-аза) участвуют в расщеплении нуклеиновых кислот. Биологическая роль данных ферментов заключается в деградации полинуклеотидов бактерий и вирусов, что играет существенную роль в защите организма от проникновения инфекционного фактора через полость рта.
В слюне также содержатся ферменты, участвующие в свертывании крови и фибринолизе: плазмин, активаторы плазминогена, ингибиторы фибринолиза, факторы обладающие тромбопластической активностью. Полагают, что все эти энзимы играют роль в образовании фибрина и регенерации ран слизистой полости рта.
Липиды. Их общее содержание невелико. Оно колеблется и считается, что большая их часть поступает с секретом околоушной и подчелюстной желез и только 2% из плазмы и клеток. Количество общих липидов в нестимулированном секрете околоушной железы не превышает 60-70 мг/л. Часть липидов представлена свободными насыщенными и ненасыщенными высшими жирными кислотами – пальмитиновой, стеариновой, олеиновой, эйкозапентаеновой. Кроме того, в слюне присутствует свободный холестерин и его эфиры (около 28% от общего количества), триацилглицеролы (примерно 50%) и, в очень небольшом количестве, глицерофосфолипиды.
Углеводы в слюне находятся в комплексе с белками. Уровень глюкозы в слюне в норме составляет 0,06-0,17 ммоль/л.
Слюна содержит также мочевину (1,7-6,7 ммоль/л), лактат, пируват, тиоцинаты (роданиды), нитраты, нитриты. Последние два поступают в слюну с пищей, водой, табачным дымом, где при участии нитратредуктазы бактерий нитраты превращаются в нитриты, которые в свою очередь могут вступить в реакцию со вторичными аминами (аминокислоты, нуклеотиды, лекарственные препараты) с образованием канцерогенных нитрозосоединений. Эта реакция протекает в кислой среде, а ускоряют ее тиоцианаты. Показано, что при лейкоплакии слизистой полости рта у курильщиков и лиц, занятых в табачном, производстве в слюне растет количество нитритов и активность нитратредуктазы. Кроме того, содержание роданидов в слюне у курильщиков в 2-10 раз превышает таковое у некурящих людей (в норме – 0,5-1,2 ммоль/л), их уровень также может увеличиваться при воспалении пародонта.
В слюне определяется подавляющее большинство стероидных гормонов – эстрогены, андрогены, прогестерон, глюко- и минералокортикоиды. Уровень половых гормонов у женщин меняется в зависимости от фазы менструального цикла. Исследование стероидных гормонов в слюне используется для оценки влияния контрацептивов на эндокринную систему женщины. По гормональному профилю слюны можно судить о приеме стероидных анаболиков.
Одним из защитных механизмов полости рта, обеспеченных компонентами ротовой жидкости, наряду с указанными выше (иммуноглобулины, пероксидазы, протеазы, нуклеазы, факторы гемостаза и фибринолиза и другие), служит образование приобретенной пелликулы зуба, которая лежит под слоем зубного налета. Это очень тонкая органическая пленка, являющаяся структурным элементом поверхностного слоя эмали. Она не исчезает в процессе жевания и может быть удалена лишь при воздействии сильных абразивных агентов. Пелликула появляется после прорезывания зубов и в ее образовании участвуют главным образом белки ротовой жидкости. Муцины, имея кислый характер и высокое сродство к гидроксиапатиту эмали, притягиваются к поверхности зуба, также как и кислые белки, богатые пролином, - эти протеины составляют основную структурную часть пелликулы. Она, выступая в роли ионообменника, регулирующего поступление ионов кальция и фосфата, препятствует избыточному их осаждению из перенасыщенной солями слюны. Жевание и наличие микроорганизмов в полости рта создают основу для прикрепления бактерий к белкам пелликулы и инициирует рост зубного налета. Ограничение роста последнего и повреждающего действия микроорганизмов на твердые ткани зуба связано с присутствием белков слюны, таких как гистатины и цистатины, которые обладают антибактериальным и антивирусным действием, что определяется их способностью ингибировать активность многих протеаз ряда вирусов и бактерий. Разрушение пелликулы под действием микрофлоры приводит к обнажению эмали, нарушению минерализации и может закончиться кариозным процессом.
Буферная емкость слюны – это способность нейтрализовать кислоты и основания (щелочи), обычно расценивается как защитный механизм полости рта, функционирующий по принципу саморегуляции. Буферные свойства слюны определяются ее клиренсом и буферными системами, а также зависят от характера ее секреции (стимулированная или нестимулированная). Клиренс слюны характеризует скорость растворения и удаления из полости рта углеводов и кислот. Скорость секреции слюны – важнейший фактор, определяющий скорость самоочищения полости рта. При высокой скорости клиренса слюны кривая Стефана (изменения рН зубной бляшки, развивающиеся после поступления в полость рта углеводов) имеет пологую форму, т.е. снижение рН зубной бляшки незначительное. При низком клиренсе кривая Стефана глубокая из-за сильного снижения рН зубной бляшки.
Во фронтальном участке в области шеечной поверхности верхних зубов скорость клиренса наименьшая, на язычной поверхности нижних зубов – наибольшая. В боковых отделах зубного ряда этот параметр имеет промежуточные значения. В соответствии с показателями клиренса самые низкие значения рН зубов бляшки определяются на апроксимальных поверхностях верхних фронтальных зубов.
Буферные системы слюны: бикарбонатная – основная система стимулированной слюны. Концентрация бикарбонатов в нестимулированной смешанной в нестимулированной смешанной слюне находится в пределах 1 ммоль/л, а в стимулированной смешанной слюне повышается до 15 ммоль/л. Доказано, что стимулированная слюна приводит к достоверному росту рН зубной ббляшки, нейтрализуя кислые продукты в ее составе. Фосфатная – основная буферная система нестимулированной слюны. Защитная роль фосфатов определяется не только буферными свойствами, но и способностью повышать минерализующий потенциал слюны. Третьей по значению считается белковая буферная система.
Кроме этих систем существуют другие факторы, повышающие значения рН (мочевина слюны – многие микроорганизмы превращают ее в аммиак; сиалин – основной пептид, содержащий аргинин; амины – продукты декарбоксилирования аминокислот. Амины имеют щелочную реакцию и способны взаимодействовать с протонами.
Установлено, что прием в течение длительного времени углеводистой пищи снижает, а прием высокобелковой – повышает буферную емкость слюны. Высокая буферная емкость слюны относится к ряду факторов, повышающих резистентность зубов к кариесу.
ДЕСНЕВАЯ ЖИДКОСТЬ
Десневая жидкость – это физиологическая среда организма, которая в норме заполняет десневую бороздку. Десневую жидкость впервые получили в эксперименте при погружении фильтровальной бумажной полоски в зубодесневую бороздку. Появление этой жидкости в десневой щели исследователи связывают в основном с морфологическими особенностями сосудов и эпителия этой зоны. Микрососуды расположены ближе к внутренней поверхности эпителия и не образуют капиллярные петли, а лежат параллельно эпителию как посткапиллярные венулы. Обновление поверхностного слоя эпителия происходит гораздо быстрее, чем на других участках эпителия полости рта.
В десневой жидкости содержатся лейкоциты, микроорганизмы, ферменты, белковые фракции, десквамированные клетки эпителия. В норме в течение суток в полость рта поступает 0,5-2,4 мл десневой жидкости. Механизм образования и выделения последней окончательно не установлен. Считают, что при интактном пародонте причиной ее образования является осмотический градиент, а при воспалении слизистой оболочки десневого края жидкость поступает в десневую бороздку вследствие нарушения микроциркуляции, сопровождающейся увеличением проницаемости сосудов. Есть основания считать десневую жидкость главным источником поступления лейкоцитов в ротовую жидкость. Подтверждается это тем, что до прорезывания зубов, а следовательно до образования десневого желобка, в ротовой жидкости лейкоциты отсутствуют. Наблюдается уменьшение последних и по мере удаления зубов. Лейкоциты десневой жидкости, также как и смешанной слюны, находятся в активном состоянии, а их фагоцитарная способность увеличивается по мере роста очага воспаления в полости рта. Большое значение придают этим клеткам как источнику лизосомальных ферментов (лизоцим, кислая и щелочная фосфатаза), которым отводят значительную роль в патогенезе заболеваний пародонта. Некоторые вещества поступают не только в десневую бороздку, но и в обратном направлении. Проникновение их осуществляется по межклеточным пространствам. Под влиянием гиалуронидазы уровень проницаемости эпителия десневой борозды повышается.
Десневая жидкость обладает фибринолитической активностью, которая обусловлена наличием в ней фибринолизина и его профермента – плазминогена с активатором. Блокировать действие фибринолизина можно e-аминокапроновой и e-аминовалериановой кислотами, являющимися ингибиторами активаторов плазминогена.
Среди белковых фракций десневой жидкости определяются также и компоненты системы комплемента, которые имеют важное значение в течении реакций, развивающихся при воспалении. В десневой жидкости имеются некоторые аминокислоты и кинины, которые влияют на микроциркуляцию, повышая проницаемость стенки сосудов, усиливают миграцию лейкоцитов.
Многообразна также микрофлора десневого желобка. В большом количестве образуется кокковая флора, причем имеется определенное сходство между микрофлорой десневой жидкости и зубного налета. Помимо лейкоцитов и бактерий в данном биологическом объекте содержатся слущенные клетки эпителия, количество которых может увеличиваться при воспалении.
Минеральный состав десневой жидкости несколько отличен от плазмы крови: количество Na+ и К+ в ней выше, чем в тканях десны, но значительно ниже, чем в плазме. Содержание небелкового железа в десневой жидкости при гингивите и пародонтите на порядок выше чем в слюне. При пародонтите оно достоверно выше, чем при гингивите. Кроме того, в десневой жидкости содержатся кальций, фосфор, магний, цинк, сера, хлор, фтор.
Белки десневой жидкости. Белковый состав вод десны и плазмы крови одинаков. Количество протеинов составляет 60-70 г/л, показатель не меняется при развитии пародонтита и не зависит от степени тяжести воспаления и гигиены полости рта. Глобулиновая фракция десневой жидкости представлена белками-ферментами, иммуноглобулином G, компонентами системы комплемента, фибринолиза, лактоферрином.
Белки десневой жидкости, помимо участия в иммунном ответе (Ig), могут способствовать соединению эпителия десневого желобка с поверхностью зуба, образуя клейкую пленку. В норме активность ферментов в десневой жидкости невелика, но она меняется при развитии воспаления в пародонте. Протеиназам отводится особая роль в деструкции клеточных элементов пародонта и развитии воспаления. Последние связывают с повышением активности коллагеназы, которая в физиологическом состоянии близка к нулю. Кроме того в десневой жидкости имеются эластаза, поступающая из азурофильных гранул лейкоцитов; катепсин D, активность которого много выше в норме, чем в плазме крови. В десневой жидкости определяется также активность щелочной и кислой фосфатаз, гиалуронидазы, b-глюкуронидазы, лизоцима, имеются ферменты гликолиза, цикла трикарбоновых кислот (сукцинатдегидрогеназа), аминотрансферазы, лактатдегидрогеназа.
В десневой жидкости обнаружены глюкоза, гексозамины, уроновые кислоты, молочная кислота, глицерофосфолипиды, триацилглицеролы. Присутствие мочевины и аммиака в содержимом десневого желобка поддерживает рН на уровне 6,3- 7,9.
Изучение состава десневой жидкости открывает перед исследователями большие возможности, поскольку позволяет определить выраженность воспаления при заболеваниях полости рта. Жидкость собирают из десневых карманов верхних фронтальных зубов с помощью фильтровальных бумажек, стандартных по размеру и массе, полосок, ниточек или капиллярных трубочек.
Итак, десневая жидкость – это сложная биологическая среда организма, которая играет важную роль в поддержании нормального состояния тканей пародонта. Ее исследование получает широкое распространение при диагностике и лечении гингивитов и пародонтитов, а также в оценке состояния пародонта при протезировании, лечении аномальных состояний зубочелюстной системы.
К сожалению, мы практически не обнаружили работ, в которых изучались бы показатели липопероксидации десневой жидкости при различных физиологических и патологических состояниях.
Дата добавления: 2018-02-28; просмотров: 1705; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
