Властивості, добування і застосування алкенів
Властивості. Етен, пропен і бутени- безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 - рідини, а починаючи з С19Н38 - тверді речовини.
Алкени мало розчинні у воді, густина їх менша від 1г/см3.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено наявністю в їхніх молекулах подвійного зв¢язку. Алкени здатні вступати в реакції приєднання за рахунок розриву p-зв¢язку. Крім того, p-зв¢язок під дією окислювачів руйнується легше, ніж s - зв¢язок, тому для алкенів характерна участь у ролі відновників в окислювального відновних реакціях.
1. Гідрування. Приєднуючи водень, алкени переходять у алкани:

Реакції гідрування алкенів відбуваються при наявності каталізаторів(платини, паладію, нікелю).
2. Галогенування. Алкени легко приєднують галогени, особливо хлор і бром:

На цієї реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється.
3. Гідрогалогенування. Галогеноводні також легко приєднуються до алкенів, наприклад:

Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв’язку. Подвійний зв’язок має підвищену електронну густину, тому він легко приєднує електрофільні частинки.
Молекула НВr може відщеплювати іон водню Н+, який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами:
|
|
|
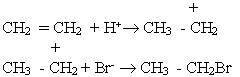
Приєднання галогеноводнів до гомологів етилену може відбуватися двома шляхами, наприклад:

Підчас цієї реакції утворюється переважно 2-бромпропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Марковникову сформулювати таке правило: атом водню галогеноводнів та інших несиметричних водневих сполук приєднується до найбільш гідрогенізованого атома карбону біля подвійного зв’язку (тобто до атома карбону, який сполучений з великою кількістю атомів водню).
4. Гідратація. Підчас гідратації алкенів при наявності каталізаторів (сірчаної кислоти або інших) утворюються спирти; приєднання води до гомологів етилену відбувається згідно з правилом Марковникова, наприклад:

5. Алкілування. Алкени можуть приєднувати насичені вуглеводні з утворенням вищих алканів. Реакції алкілування відбуваються при наявності каталізаторів (АlCІ3, AlBr3, HF, H2SO4). Наприклад, підчас взаємодії етилену з пропаном утворюються два нових алкани:

6. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекул з розімкненням p-зв¢язку.
|
|
|
7. Окислення. Алкени легко окислюються, причому залежно від сили окислювачів реакції можуть відбуватися з розривом тільки p-зв¢язку або з повним розривом подвійного зв¢язку .
Перманганат калію в нейтральному і слабко лужному середовищах окислює алкени з розімкненням p-зв¢язку. Цю реакцію можна зобразити схемою:

Якщо алкени пропускати крізь водний розчин перманганату калію, то відбуватиметься знебарвлення розчину. Цю реакцію, як і реакцію бромування, використовують для якісного визначення алкенів.
Сильні окислювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв¢язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:

Підчас високотемпературного окислення алкенів у кисні або на повітрі вони згоряють:

В результаті завжди утворюються оксид карбону (ІV) і вода.
Добування. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбирних агентів. Так, етилен можна добути з етиленового спирту при нагріванні його з сірчаною кислотою:
|
|
|

Алкени можна добути з галагенопохідних алканів дією на них спиртового розчину лугу, наприклад:

У промисловості алкени добувають з насичених вуглеводнів під час термічного розкладання (крекінгу) нафти, наприклад:

Інший промисловий спосіб добування алкенів базується на дегідруванні (відщеплення водню) алканів при наявності каталізаторів, наприклад нікелю:

Застосування. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену і пропілену виробляють пластмаси - поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин.
Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо.
Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасному скиданню плодів рослинами в теплицях.
Дата добавления: 2018-02-28; просмотров: 10718; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
