Соединения алюминия, их свойства и применение
Алюминий и его соединения
План.
1) Особенности строения атомов.
2) Особенности физических свойств
3) Особенности химических свойств
4) Нахождение в природе
5) Получение
6) Применение алюминия
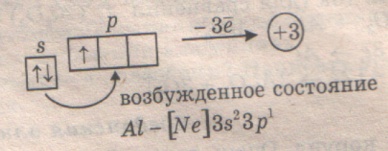 7) Соединения алюминия, их свойства и применение.
7) Соединения алюминия, их свойства и применение.
Особенности строения атома алюминия
Особенностью строения всех элементов третьей главной подгруппы является одинаковая электронная конфигурация внешнего электронного слоя ns2p1. Поэтому высшая степень окисления для них будет +3. В этой подгруппе, как и в других, свойства первого элемента (бора) сильно отличаются от свойств других элементов. Остальные элементы относятся к металлам, имеют невысокую энергию ионизации и невысокую ЭО. Металлические свойства в подгруппе усиливаются. Мы будем рассматривать свойства только алюминия, как типичного представителя р-металлов.
Особенности физических свойств алюминия
Алюминий в свободном виде – серебристо-белый металл, очень легкий (2,7 г/см3), легкоплавкий (660 С0). Он обладает высокой тепло- и электропроводностью (уступает только меди, золоту и серебру). Алюминий хорошо поддается механической обработке, он ковкий и пластичный, его можно прокатывать в тонкую фольгу и проволоку. Это немагнитный материал.
Особенности химических свойств алюминия
Алюминий активный металл, а значит, он должен активно окисляться на воздухе и в воде. Но поверхность алюминия обычно покрыта очень тонкой и очень прочной пленкой оксида алюминия, которая и предохраняет его от взаимодействия с окружающей средой. Если эту пленку удалить (например, покрыть алюминий слоем ртути), алюминий будет активно взаимодействовать с водой:
|
|
|
Аl + H2O → Al(OH)3 + H2
Окисление алюминиякислородом в виде мелких стружек, фольги или порошка проходит с выделением большого количества энергии (ослепительнобелоепламя)
2Аl + 3/2O2 → Al2O3 + 1676 кДж
Алюминий при н.у. может взаимодействовать с галогенами, а при нагревании с серой, фосфором, азотом, углеродом...
Алюминий легко растворяется в соляной кислоте любой концентрации, и в разбавленной серной. Концентрированная серная и азотная кислоты на холоду не действуют на алюминий. Происходитпассивацияметалла – образованиетонкойзащитнойпленкиизоксида. При нагревании алюминий в концентрированных кислотах- окислителях растворяется, но образуются не водород, а другие продукты восстановления.
Al + HCl → AlCl3 + H2
Al + H2SO4(конц) → Al2(SO4)3 + SO2 + H2O
Алюминий амфотерный металл, он растворяется не только в кислотах, но и в щелочах.
Al + NaOH + H2O → Na[Al(OH)4] + H2
Итак, алюминий активный восстановитель, амфотерный металл. Но от воздействия окружающей среды его предохраняет прочная оксидная пленка.
|
|
|
Нахождение в природе алюминия
Алюминий – самый распространенный металл на Земле(8% по массе) Из-за высокого сродства к кислороду в свободном виде не встречается, он входит в состав глинозема (Al2O3), бокситов(Al2O3 ∙H2O), нефелина (смесь силикатов и алюминатов щелочных металлов и аммония), криолита (Na3[AlF6]). Монокристаллы Al2O3 называют корундом, по твердости эти прозрачные кристаллы сравнимы с алмазом, примеси оксида хрома (III) превращают его в рубин, а примесь оксида железа (III) – в сапфир. Кроме того, алюминий входит в состав глин и полевых шпатов.
Роль алюминия в организме и применение в медицине.
Содержание алюминия в организме- 10-5%, следовательно, это микроэлемент. Алюминий, в основном, содержится в сыворотке крови, лёгких, печени, почках; входит в структуру оболочек нервных клеток головного мозга. Он участвует в построении эпителиальной и соединительной тканей, в процессе регенерации костей, в обмене фосфора. Алюминий используется в медицине в виде сульфата алюминия и квасцовKAl(SO4)2 ·12H2O, которые обладает вяжущим, противовоспалительным, кровоостанавливающим и противомикробным действием; при малых концентрациях он повышает активность амилазы, при высоких – дезактивирует её. Порошок Al2O3 или гель используют как адсорбент.
|
|
|
Получение
Алюминий получают электролизомAl2O3 (бокситов, глинозема), растворенного в расплаве криолита. Криолит понижает температуру плавления смеси приблизительно до 1000  . Катодом является графитовое дно ванны электролизера, там собирается восстановленный расплавленный алюминий. Анод тоже из графита, на нем образуется кислород, поэтому возможно окисление им графита, т.е. образование СО2.
. Катодом является графитовое дно ванны электролизера, там собирается восстановленный расплавленный алюминий. Анод тоже из графита, на нем образуется кислород, поэтому возможно окисление им графита, т.е. образование СО2.
Применение алюминия


 Металлический алюминий применяют в виде сплавов с медью (дюраль, алюминиевая бронза) и кремнием (силумин). Эти сплавы широко используют в электротехнике, машиностроении, приборостроении, пищевой промышленности (упаковочный материал, посуда). Используют также алюминиевые покрытия на металлах и неметаллах, при этом на алюминии создают тонкую пленку оксида. Используют для пиротехнических смесей (термитная сварка). Используют как наполнитель для краски (серебрин). Как активный металл алюминий используют в качестве восстановителя в металлургии (алюминотермия) для получения хрома, марганца.
Металлический алюминий применяют в виде сплавов с медью (дюраль, алюминиевая бронза) и кремнием (силумин). Эти сплавы широко используют в электротехнике, машиностроении, приборостроении, пищевой промышленности (упаковочный материал, посуда). Используют также алюминиевые покрытия на металлах и неметаллах, при этом на алюминии создают тонкую пленку оксида. Используют для пиротехнических смесей (термитная сварка). Используют как наполнитель для краски (серебрин). Как активный металл алюминий используют в качестве восстановителя в металлургии (алюминотермия) для получения хрома, марганца.
Соединения алюминия, их свойства и применение
|
|
|
Al2O3- белый порошок илибесцветныекристаллы, очень тугоплавкий (2072  ), по твердости сравним с алмазом. Применяют термоустойчивую керамику (тигли, кирпичи…), искуственно полученные кристаллы корунда используют для производства шлифовальной бумаги (наждак), для изготовления деталей точных приборов (весы, часы). По химическимсвойствамэтоамфотерный оксид.
), по твердости сравним с алмазом. Применяют термоустойчивую керамику (тигли, кирпичи…), искуственно полученные кристаллы корунда используют для производства шлифовальной бумаги (наждак), для изготовления деталей точных приборов (весы, часы). По химическимсвойствамэтоамфотерный оксид.
Al2O3+ HCl → AlCl3 + H2O
Al2O3+ NaOH + H2O → Na[Al(OH)4] – в растворах
Al2O3+ NaOH → NaAlO2 + H2O – при сплавлении
Al(OH)3- белое твердое вещество, нерастворимое в воде. Свежеполученный он выглядит как студень белого цвета. Получают его из солей:
AlCl3+ NaOH →Al(OH)3↓+ NaCl
Гидроксид алюминия имеет амфотерные свойства:
Al(OH)3+ HCl → AlCl3 + H2O
Al(OH)3+ NaOH + H2O → Na[Al(OH)4]
Эту последнюю реакцию используют как качественную, т.е. при действии щелочи на раствор, содержащий ионы алюминия выпадает белый студенистый осадок, который растворяется в избытке щелочи.
Соли алюминия в растворах подвергаются гидролизу, т.е. разлагаются водой. Особенно если это соли слабых кислот. Используют: хлорид алюминия – как катализатор в органическом синтезе; сульфат алюминия – для очистки воды при производстве бумаги; алюминиевые квасцы (КAl(SO4)2∙ 12H2O) – в медицине и косметологии (см. выше), для дубления кожи, как протрава при крашении х/б тканей; для производства красителей (ультрамарин).
Дата добавления: 2018-02-28; просмотров: 459; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
