Кванто-механические представления о строении атома. Квантовые числа.
Теория строения атома основана на законах, описывающих движение микрочастиц (электронов, атомов, молекул) и их систем (например, кристаллов). Примерно в начале XX в. исследования явлений (фотоэффект, атомные спектры) привели к выводу, что энергия распространяется и передаётся, поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами. Предположение о квантовании энергии впервые было высказано М. Планком в 1900 г. и было обосновано Эйнштейном в 1905 г.: энергия кванта 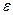 зависит от частоты излучения
зависит от частоты излучения 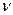 :
: 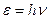 , где (1)
, где (1) 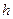 – постоянная Планка (
– постоянная Планка (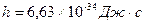 )
)
Частота колебаний 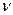 и длина волны
и длина волны 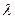 связаны соотношением:
связаны соотношением: 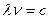 , где
, где 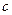 – скорость света.
– скорость света.
Для описания электромагнитного излучения привлекают как волновые, так и корпускулярные представления: с одной стороны монохроматическое излучение распространяется как волна и характеризуется длиной волны, с другой стороны оно состоит из микрочастиц – фотонов, переносящих кванты энергии. В 1924 г. Луи де Бройль предложил распространить корпускулярно-волновые представления на все микрочастицы. Математически это выражается соотношением де Бройля, согласно которому частице массой 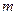 , движущейся со скоростью
, движущейся со скоростью 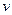 , соответствует волна длиной
, соответствует волна длиной 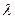 :
: 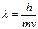 . Гипотеза де Бройля была экспериментально подтверждена обнаружением дифракционного и интерферентного эффектов потока электронов.
. Гипотеза де Бройля была экспериментально подтверждена обнаружением дифракционного и интерферентного эффектов потока электронов.
Микрочастица, так же как и волна не имеет одновременно точных значений координат и импульса. Это проявляется в том, что чем точнее определяется координаты частицы, тем неопределеннее её импульс, и наоборот. Поэтому мы говорим о максимально вероятном нахождении электрона в данном месте в определённый момент времени. Та область пространства, где >90% находится электрон называется атомной орбиталью.
В центре атома находится ядро (протоны – положительно звряженные, и нейтроны), вокруг него вращаются электроны, заряженные отрицательно. В 3-х мерном пространстве 4-мя квантовыми числами описывается состояние электрона:
Главное квантовое число 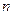 характеризует удалённость электрона от ядра и определяет его энергию (чем больше
характеризует удалённость электрона от ядра и определяет его энергию (чем больше 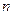 , тем больше энергия электрона и тем меньше энергия связи с ядром).
, тем больше энергия электрона и тем меньше энергия связи с ядром). 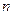 принимает целочисленные значения от 1 до ¥.
принимает целочисленные значения от 1 до ¥.
Состояние электрона характеризующееся различными значениями главного квантового числа 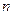 , называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или буквами K, L, M, N, O ….
, называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или буквами K, L, M, N, O ….
Квантовое состояние атома с наименьшей энергией – основное состояние, а с более высокой – возбуждённое состояние. Побочное квантовое (орбитальное, азимутальное) число 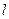 (принимает все целочисленные значения от 0 до (n-1)).
(принимает все целочисленные значения от 0 до (n-1)).
Состояние электрона характеризующееся различными значениями побочного квантового числа 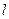 называется энергетическим подуровнем. В пределах каждого уровня с увеличением
называется энергетическим подуровнем. В пределах каждого уровня с увеличением 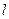 , растёт энергия орбитали.
, растёт энергия орбитали.
Каждому значению 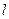 соответствует определённая форма орбитали
соответствует определённая форма орбитали

Магнитное квантовое число 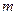 характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от -
характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от - 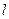 до +
до + 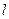 ).
).
Например, для 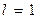
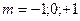 . В пределах каждого подуровня орбиталь имеет одинаковую энергию.
. В пределах каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое квантовое число 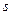 характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:
характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:  – вращение по часовой стрелке,
– вращение по часовой стрелке, 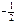 – вращение против часовой стрелки).
– вращение против часовой стрелки).
Дата добавления: 2015-12-21; просмотров: 26; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
