Уравнение состояния
Если термодинамическую систему предоставить самой себе, то через некоторое время она приходит в равновесное состояние, когда в каждой точке ее объема физические параметры: ее – давление, температура, плотность и другие будут одинаковыми. В таком положении значения, характеризующие ее физическую сущность параметров, связаны между собой уравнением состояния

 Рис. 6.2. Круговой процесс
или цикл
Рис. 6.2. Круговой процесс
или цикл
|
 Рис. 6.1. К определению понятия
термодинамического процесса
Рис. 6.1. К определению понятия
термодинамического процесса
|
Переход системы из одного состояния в другое всегда связан с нарушением равновесия и называется процессом (рисунок 6.1). Если система, пройдя через ряд промежуточных состояний, возвращается в исходное, то такой процесс называют круговым или циклом (рисунок 6.2).
Круговой процесс или цикл позволяет сделать предположение о возможности создания тепловой установки. Для того чтобы процесс был термодинамически обратим необходимо, чтобы он прошел через ряд равновесных состояний, но природа такого не допускает. Ибо в этом случае процессы должны протекать бесконечно медленно, что для техники не имеет практического значения. Анализ многочисленных опытов позволил для идеального газа на основе молекулярно-кинетической теории записать уравнение состояния, известное как уравнение Клапейрона – Менделеева

где р – давление, Па;  – молярная масса, кг/моль; V – объем системы, м3; Т – абсолютная температура, К; R =8,314 Дж/моль·К – универсальная газовая постоянная.
– молярная масса, кг/моль; V – объем системы, м3; Т – абсолютная температура, К; R =8,314 Дж/моль·К – универсальная газовая постоянная.
|
|
|
6.4 Основы молекулярно – кинетической теории
Это уравнение справедливо для идеального газа. Реальные газы, поведение которых при сравнительно низком давлении u, относительно высокой температуры (Т >273 К) Менделеева принято называть совершенным газом. Температура газа, отражающая величину внутренней энергии идеализированной термодинамической газовой системы, может также связана со среднеквадратичной скоростью перемещения молекул в их хаотическом тепловом движении.
Воспользуемся основным уравнением молекулярно-кинетической теории

Учитывая, что концентрация  есть отношение числа молекул к объему, перепишем последнее выражение
есть отношение числа молекул к объему, перепишем последнее выражение

или 
Для одного моля  числу Авогадро, а объем
числу Авогадро, а объем  равен объему одного моля
равен объему одного моля

Воспользуемся уравнением состояния, записанным для одного моля

После подстановки и деления обеих частей уравнения на их универсальную газовую постоянную получим выражение

которое можно привести к виду

Последнее выражение связывает температуру со средне кинетической энергией теплового движения молекулы.
Величина  – константа Больцмана равна отношению
– константа Больцмана равна отношению
 .
.
Модель идеального газа предполагает, что молекула состоит из одного атома, а у такой молекулы имеются лишь три степени свободы поступательного движения.
|
|
|
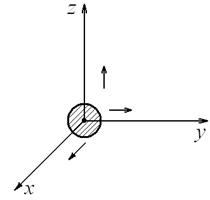 Рис. 6.3 Степени свободы молекулы идеального газа. i =3 поступательные.
Рис. 6.3 Степени свободы молекулы идеального газа. i =3 поступательные.
|
Следовательно, для модели идеального газа можно записать, что
 ,
,
так как  где i – число степеней свободы.
где i – число степеней свободы.
В представленном анализе молекулярно-кинетических представлений ограничимся лишь поступательными и вращательными степенями свободы, пренебрегая колебательными, учет которых целесообразен при достаточно высокой температуре. Геометрически модель двухатомного газа может быть представлена в виде гантели (рисунок 11.4). Такая молекула имеет уже 5 степеней свободы, и ее энергия будет определяться величиной
 Рис. 6.4 Степени свободы двухатомной молекулы: i =5 – 2- вращательных и 3 - поступательных степени свободы.
Рис. 6.4 Степени свободы двухатомной молекулы: i =5 – 2- вращательных и 3 - поступательных степени свободы.
|

Для трех и многоатомных молекул добавляется еще одна вращательная степень свободы и ее энергия в этом случае равна

Энергия одного поля может быть найдена как произведения

или вводя обратную замену  , получим
, получим  .
.
Теплоемкость
При реализации термодинамических процессов для их анализа вводится понятие теплоемкости  это количество тепла, которое необходимо подвести к системе по какому-либо процессу для того, чтобы изменить ее температуру на 1 К.
это количество тепла, которое необходимо подвести к системе по какому-либо процессу для того, чтобы изменить ее температуру на 1 К.
|
|
|
Тогда средняя теплоемкость процесса, если к системе подведена теплота в количестве  , а ее температура изменилась на
, а ее температура изменилась на 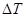 будет равна
будет равна
 ,
,
где индекс x указывает на характер реализуемого процесса.
Для расчета истинной теплоемкости необходимо перейти к предельному соотношению

Чаще используют удельную теплоемкость

Особую роль в термодинамике играют теплоемкости изохорного  и изобарного
и изобарного  процессов, связь между которыми устанавливается уравнением Майера
процессов, связь между которыми устанавливается уравнением Майера

где  – молярная масса газа.
– молярная масса газа.
Их отношение, как известно, определяет показатель степени в адиабатном процессе изменения состояния газа, протекающем без теплообмена с окружающей средой

а само уравнение имеет вид

где р – давление, Па;  – удельный объем, м3/кг.
– удельный объем, м3/кг.
Мольная изохорная теплоемкость может быть найдена из элементарных соображений в процессе анализа уравнения первого начала.
Запишем его
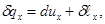
где  работа в процессе,
работа в процессе,  .
.
Для изохорного процесса  тогда
тогда 
 или
или 
Откуда после подстановки в уравнение первого начала получим
 ,
, 
 а следовательно
а следовательно

Для систем из реальных веществ необходимо учитывать силу взаимодействия молекул – частиц, из которых они состоят и наличие у молекул собственного объема. Уравнений, описывающих состояние реальных веществ много, но все они описывают поведение систем приближенно. Лучше всего качественно описывает поведение реальных веществ уравнение Ван – дер – Вальса
|
|
|

где а, b – константы Ван – дер – Вальса;  – объем моля. Константы а, b для реальных веществ определяются опытным путем.
– объем моля. Константы а, b для реальных веществ определяются опытным путем.
Поправка  учитывающая наличие сил межмолекулярного взаимодействия может быть ассоциирована с наличием внутреннего давления в газовых системах.
учитывающая наличие сил межмолекулярного взаимодействия может быть ассоциирована с наличием внутреннего давления в газовых системах.
Константа b – поправка, учитывающая наличие конечного объема у молекул газа. Поправку b можно вычислить. Допуская, что молекулы сферы, она будет равна
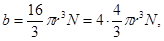
где  радиус молекулы,
радиус молекулы,  число молекул.
число молекул.
Поправка равна примерно утвержденному собственному объему всех молекул

Дата добавления: 2015-12-16; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
