Взаимодействие металла с атмосферой печи
Модуль 4. Нагрев металла.
Взаимодействие металла с атмосферой печи
Тема: Окисление и обезуглероживание металла
При термической обработке отливок поверхность металла взаимодействует с атмосферой печи. В зависимости от химического состава металла и атмосферы печи протекают различные процессы. Основные из них – окисление, восстановление, науглероживание (цементация) и обезуглероживание. В зависимости от того, какой из этих процессов преобладает, атмосфера в печи называется окислительной, восстановительной, обезуглероживающей и науглероживающей. Если металл с атмосферой печи не взаимодействует, то атмосфера называется нейтральной.
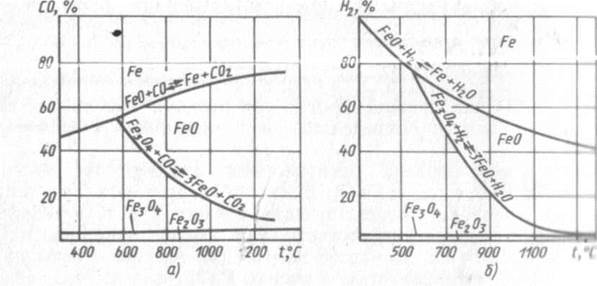
Окисление и восстановление стали. В печах газами окислителями являются О2, СО2, Н2О, а газами восстановителями – Н2, и СО. При взаимодействии с железом кислорода, углекислого газа и водяного пара происходят реакции, протекание которых зависит от состава атмосферы печи и температуры. Например, в атмосфере печи, состоящей только из двух газов СО и СО2, в зависимости от концентрации в ней СО направление протекания реакций при различной температуре можно определить по диаграмме равновесия.
|
Диаграмма разделена равновесными линиями на четыре области: FeO, Fe, Fe3O4, Fe2O3. Если при нагреве металла в печи создаются условия, соответствующие области Fe, т.е. состав атмосферы и температура соответствуют любой точке, расположенной в области Fe, то чистое железо при нагреве в печи при этих условиях не окисляется, а оксиды FeO, Fe3O4, Fe2O3 восстанавливаются. Поэтому атмосфера для чистого железа считается нейтральной, а для оксида железа – восстановительной.
|
|
|
Науглероживание и обезуглероживание стали. В печах в качестве науглероживающих газов используют СН4 и СО. Обезуглероживание вызывают газы СО2, Н2 и Н2О.
Науглероживание железа происходит по реакции: 3 Fe + С = Fe3С
Обезуглероживание стали – по реакциям: Fe3С + 2Н2 = 3Fe + СН4; Fe3С + СО2 = 3Fe + 2СO;
Fe3С + Н2О = 3Fe + СO + Н2
Изменяя состав атмосферы печи, можно урегулировать содержание углерода в поверхностном слое стальной или чугунной отливки. Каждая атмосфера при определенной температуре обладает соответствующим углеродным потенциалом, от которого напрямую зависят науглераживающие и обезуглераживающие свойства атмосферы печи. Содержание углерода в отливке, нагретой в данной атмосфере, при достаточной выдержке будет соответствовать значению ее углеродного потенциала, например, если в атмосфере с углеродным потенциалом 0,8% нагревают несколько отливок, содержащих 0,2, 0,4, 0,8, 1,2 и 1,5% С, то по окончанию нагрева, при достаточной выдержке в печи, во всех отливках будет содержаться 0,8% С, следовательно отливки содержащие до 0,8% С будут науглероживаться, а содержащие более 0,8% С – обезуглероживаться. Для отливки, состоящей из 0,8% С атмосфера печи является нейтральной.
|
|
|
Углеродный потенциал атмосферы печи регулируют изменением концентрации в ней СО2 или Н2О. Для получения стабильных результатов термообработки отливок состав атмосферы печи должен быть постоянным. Контролируют и регулируют состав атмосферы печи с помощью специальной установки, изменяя точку росы атмосферы или содержание в атмосфере углекислого газа. Количество Н2О в атмосфере обычно определяют не в процентах, а по так называемой точке росы – температуре, при которой водяные пары данной атмосферы конденсируются.
Если известны химические составы стали и чугуна и температура термообработки, то, подбирая соответствующую атмосферу печи, можно обеспечить протекание необходимых реакций и получить отливку с заданными технологическими и механическими свойствами.
4,2 МЕТОДЫ БОРЬБЫ С ОКИСЛЕНИЕМ И ОБЕЗУГЛЕРОЖИВАНИЕМ МЕТАЛЛА
При окислении металла на его поверхности образуется окалина (слой оксидов). Количество окалины зависит от времени нагрева. Чем медленнее нагревают металл, тем больше время нагрева и тем толще слой окалины. Количество окалины можно определить по формуле 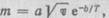 где т — количество образующейся окалины, кг/м2,
где т — количество образующейся окалины, кг/м2,  — время нагрева, с; Т — температура нагрева, Kj а и б — опытные коэффициенты. Для стали в интервале температур 600—1100°С а = 8,1,б = 9000.
— время нагрева, с; Т — температура нагрева, Kj а и б — опытные коэффициенты. Для стали в интервале температур 600—1100°С а = 8,1,б = 9000.
|
|
|
Для уменьшения количества окалины нагрев металла производят быстро. В пламенных печах скоростной нагрев достигается при сжигании максимально допустимого количества топлива, в электрических печах — выделением возможно большей энергии.
Полностью исключить образование окалины можно при нагреве металла в защитной атмосфере — газе специального состава. В печах с пламенным нагревом, чтобы исключить попадание в рабочее пространство печи продуктов горения топлива, применяют муфелирование пламени в радиационных трубах или муфелирование нагреваемого металла (см. гл. 3).
При обезуглероживании на поверхности металла появляется слой с пониженным содержанием углерода. Глубина слоя зависит от времени, температуры, начальной концентрации углерода в металле и величины углеродного потенциала атмосферы печи. Наиболее эффективный метод борьбы с обезуглероживанием — это нагрев в защитных атмосферах (см. приложение 10).
|
|
|
Защитные атмосферы находят широкое применение в литейном производстве при отжиге белого чугуна и нормализации стальных отливок, закалке и плавке. Для нагрева в среде защитного газа используют печи, отличающиеся герметичностью стального каркаса и уплотнением загрузочных и разгрузочных окон. Подача в печь защитной атмосферы осуществляется через один или несколько вводов, как правило, расположенных в высокотемпературной зоне печи.
В качестве сырья для получения защитных атмосфер служат различные газы, древесный уголь, жидкое топливо.
Наиболее широкое распространение в машиностроении нашел метод получения защитных атмосфер из природного газа. Природный газ состоит в основном из метана. При горении метана с недостатком воздуха образуются продукты неполного его горения, в состав которых входят водород и оксид углерода. Чем больше недостаток воздуха, т. е. чем меньше коэффициент расхода воздуха, тем больше в продуктах неполного горения метана будет водорода и оксида углерода. Минимальное количество воздуха для неполного горения метана определяется по реакции
СН4 + 1/20а = СО + 2Н2,
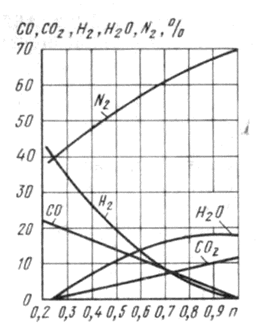 Рие. 1. Состав продуктов неполного горения метана
Рие. 1. Состав продуктов неполного горения метана
т. е. для горения 1 м3 СН4 подается 0,5 м3 02 и при этом образуется 1 м3 СО и 2 м3 Н2. Горение метана с еще меньшим количеством воздуха (п < 0,25) недопустимо из-за появления свободного углерода в продуктах горения. Углерод,
Дата добавления: 2015-12-20; просмотров: 121; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
