Глицин _ Гидроксипролин
Рис. 4.3. Ультраструктура коллагена. Рисунок Б.Тагавы (Ргоскор, Gurman, 1977)
Наука о гибкости
Удлиняющее Удлиняющее
растягивание растягивание
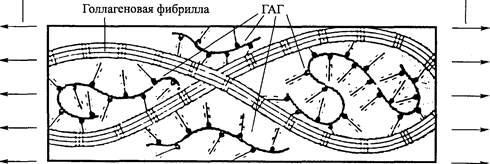
Рис. 4.4. Действие ГАГ. Растягивание прикладывается к коллагеновым фибриллам, однако ГАГ удерживают фибриллы разделенными (Meyers, Armstrong and Mow, 1984)
рой обусловлены как ее биохимическим составом, так и физическим расположением ее индивидуальных молекул. Коллаген состоит из множества сложных молекул — аминокислот, однако из них выделяют три основные. Это аминокислоты: глицин, составляющий 1/3 общего числа, а также пролин и гидроксипролин, каждая из которых составляет примерно 1/4 общего числа (см. рис. 4.3, д). Наличие пролина и гидроксипролина обеспечивает стабильность коллагена и его резистентность к растягиванию. Следовательно, чем выше концентрация этих аминокислот, тем больше сопротивление молекул растяжению. Присутствие азота в составе пролина предотвращает легкую ротацию участков, в которых он содержится (Grant, Prockop и Darwin, 1972).
Влияние на коллаген основных веществ. Главным фактором, влияющим на механические свойства или поведение коллагена, является присутствие основных веществ. Эти вещества широко распространены в соединительной ткани. Во многих участках их называют цементирующими веществами. Они образуют нефиброзный элемент матрикса,в который заключены клетки и другие компоненты. Этот вискозный, гелеподобный элемент состоит из гликозаминогликанов, белков плазмы и множества небольших белков, а также воды.
|
|
|
В соединительной ткани содержится 60-70 % воды. Гликозамино-гликаны обладают большой способностью связывать воду, поэтому их считают частично ответственными за столь высокую концентрацию воды.
Гиалуроновая кислота и «захваченная» ею вода — основной смазывающий материал фиброзной соединительной ткани. В частности, считают, что вместе с водой она выполняет роль смазывающего вещества между коллагеновыми волокнами и фибриллами. Это смазывающее вещество обеспечивает сохранение критического расстояния между волокнами и фибриллами, тем самым способствуя свободному скольжению волокон и фибрилл друг за другом и, возможно, предотвращая чрезмерное образование поперечных соединений (рис. 4.4).
 | |||||||
 | |||||||
 | |||||||
 |

|
| Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость |
Электромеханические и физиологические свойства
Прочные кристаллические материалы при деформации демонстрируют электромеханическое явление, которое называется пьезоэлектрическим эффектом (Athenstaedt, 1970). Подобный эффект наблюдается в биологических тканях. Одним из примеров может быть молекулярная структура естественной коллагеновой фибриллы. Тропоколлагеновые молекулы, образующие фибриллу, представляют собой электрически биполярные стержни, имеющие постоянный электрический потенциал в направлении продольной тропоколлагеновой оси (Athenstaedt, 1970). При сжатии соединительной ткани, такой, как хрящ, происходит механичес-ко-электрическая транедукция, приводящая к возникновению существенных электрических потенциалов (Grodzinsky, 1983). В последние годы к пьезоэлектрическому механизму было приковано большое внимание специалистов, особенно с точки зрения его возможной функции в росте и ремоделировании соединительных тканей, а также в лечении переломов костей.
|
|
|
Пьезоэлектрический эффект в биологических тканях называют электрокинетикой или потенциалами движения. Кроме потенциалов течения и токов, деформация биологических тканей может вызвать градиенты гидростатического давления, поток жидкости и деформацию клеток в матрик-
Наука о гибкости
се. В настоящее время механизм (или механизмы), обусловливающий эти реакции, не установлен. В то же время известно, что основным источником реакции трансдукции является электрокинетический механизм, или механизм течения потенциалов (Grodzinsky, 1987).
|
|
|
Механические свойства
Можно допустить, что потенциалы течения представляют собой механизм, посредством которого механические силы растягивания трансдукци-руются в различные виды генной экспрессии и, следовательно, в белковый синтез (например, создание особых изоформ титина и других тканей). В этой связи исследование Сатклиффа и Девидсона (1990) показало, что трансдукция механической силы в генную экспрессию эластина клетками гладкой мышцы во время растягивания может способствовать их специальной адаптации.
До настоящего времени в большинстве исследований рассматривали суставной хрящ под действием сил сжатия. Возможность получения весьма важной информации на этой основе объясняется следующим. Во-первых, суставной хрящ относится к категории соединительной ткани. Во-вторых, удлинение происходит одновременно вследствие сжатия. Известно, что электростатические силы можно рассматривать как межмолекулярные взаимодействия, которые существенно влияют на реологическое поведение биологических тканей (Grodzinsky, Lipshitz, Glimcher, 1978). В частности, внеклеточный матрикс выполняет важную функцию сопротивления силам растяжения, сжатия и сдвига. Как уже
|
|
|
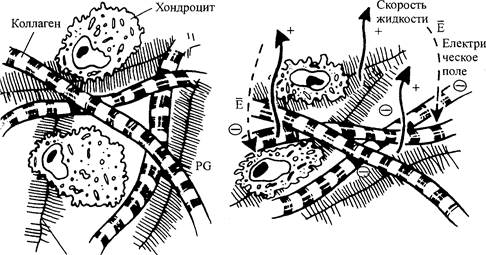
Протеогликан
а б
Рис. 4.5. Схематическое изображение соединительной ткани с коллагеновыми фибриллами, протеогаикановыми кластерами и клетками (а). Динамическое сжатие ткани приводит к деформации, градиентам давления, потоку жидкости и потенциалам течения (и потокам) во внеклеточном матриксе в клеточной среде (б)

 Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
отмечалось, электростатические силы отталкивания между ГАГ заряженными группами, как правило, делают матрикс более жестким, что повышает его способность противостоять деформации и выдерживать нагрузку (Grodzinsky, 1983, 1987; Muir, 1983; рис. 4.5). Внеклеточный матрикс содержит отрицательный фиксированный заряд, а интерстици-альная жидкость, таким образом, содержит достаточное количество дополнительных (+) контроионов для обеспечения электронейтральности; обусловленные сжатием изменения плотности фиксированного заряда вызывают изменение концентрации всех подвижных видов ионов во внеклеточном матриксе, согласно Доннану и законам электронейтральности. Таким образом, протеогликаны действуют как «молекулярные пружины» (Muir, 1983).
Сравнение влияния статических и динамических
нагрузок
Исследования суставного хряща in vivo показывают, что статическая иммобилизация, пониженная нагрузка или статическое сжатие сустава приводят к появлению участков повышенной фиксированной плотности заряда, повышению концентрации положительных контрионов и осмотического давления. Это ингибирует синтез и обработку протеогликанов (Gray и др., 1988; J.RG.Urban, Bayliss, 1989), а также нарушает питание хряща. С другой стороны, динамическое сжатие приводит к увеличению гидростатического давления, потока жидкости, потенциалов течения и изменению формы клетки, что может стимулировать биосинтез (A.Hall, Urban, Gehl, 1991; Y.-J.Kim и др., 1994). Таким образом, цикличная нагрузка и разгрузка способствуют сохранению здоровья хряща. Вместе с тем, при чрезмерной нагрузке повышается поток жидкости, напряжение и его интенсивность. Высокие уровни напряжения или его интенсивность могут привести к повреждению матрикса, отечности тканей и усилению диффузии в хряще (Sah и др., 1991), что ведет к хроническому повреждению хряща.
Влияние процесса старения на коллаген. Коллаген по мере своего старения претерпевает определенные физические и биохимические изменения. В конечном итоге они отражают снижение минимальной степени растяжимости, которая имела место, и увеличение ригидности. Так, например, процесс старения приводит к увеличению диаметра коллагеновых волокон в различных тканях. Кроме того, с течением времени усиливается процесс кристаллизации фибрилл. Увеличение степени кристаллизации или ориентации еще больше укрепляет межмолекулярные связи и повышает резистентность к дальнейшей деформации. Более того, предполагают, что процесс старения связан с увеличением числа внутри- и межмолекулярных поперечных соединений. Эти дополнительные поперечные соединения явно ограничивают способность скольжения коллагеновых молекул относительно друг друга. Важная роль в процессе старения принадлежит дегидратации. Так, с возрастом снижается количество воды, связанной с соединительными тканями, такими, как сухожилие. По некоторым
|

|

|

|
|
| Рис. 4.6. Возрастные изменения в соединительной ткани, вызывающие нарушение мышечной функции (Mohan, Radha, 1981) |

 Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
Глава 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
оценкам, если в сухожилиях маленьких детей содержание воды составляет приблизительно 80-85 %, то у взрослых этот показатель снижается до 70 % (Elliot, 1965; рис. 4.6).
Ультраструктурная основа и физиологический предел удлинения коллагена. В отличие от саркомера, волокно коллагена является сравнительно нерастяжимым. Волокно коллагена настолько неэластично, что оно даже не растягивается при воздействии на него массы, в 10 000 раз превышающей его собственную (Vevzar, 1963). Исследования показывают, что микроскопические волокна можно растянуть примерно на 10 % их исходной длины, прежде чем они порвутся. На молекулярном уровне степень растяжения коллагеновых фибрилл составляет около 3 % (Ramachandran, 1967). Электронно-микроскопическое исследование показывает, что при удлинении коллагена в нем происходит постепенное изменение внутрифибриллярной периодичности и латеральных измерений. В одном из ранних исследований (Cowan, McGavin, North, 1955) было установлено, что растяжение приводит к повторяющемуся увеличению осевого интервала с 0,286 до 0,310 нм и больше.
Считают, что подобное растяжение первоначально осуществляется в результате распрямления волокон и последующего постепенного скольжения их относительно друг друга. В результате увеличивается степень кристаллизации или ориентации, что, в свою очередь, усиливает межмолекулярную связь и повышает резистентность к дальнейшему удлинению. Кроме того, возрастает взаимопереплетение соседних молекул. Это приводит к увеличению силы интерцепочек, что обеспечивает повышенное сопротивление силам деформации. Дальнейшее растягивание приводит к превышению межмолекулярных связей и разрыву ткани (Laban, 1962; L.Weiss, Greep, 1983).
ЭЛАСТИЧНАЯ ТКАНЬ
Эластичная ткань — основной структурный компонент живой ткани. На микрофотографиях, полученных при помощи электронного микроскопа, видно, что большое количество эластичной ткани находится в сарколемме мышечного волокна (соединительная ткань, окружающая сарко-мер). Таким образом, эластичная ткань играет ведущую роль в определении возможной степени растяжимости мышечных клеток. Отдельные мышечные клетки содержат достаточно большое количество почти «чистых» эластичных волокон. Следовательно, эластичная ткань в значительной мере определяет возможный диапазон движения.
Эластичные волокна выполняют множество функций, включая распространение нагрузки, возникающей в изолированных участках, координацию ритмичных движений частей тела, сохранение энергии путем поддержания тонуса во время расслабления мышечных элементов и т. д. (Jenkins, Little, 1974).
Состав эластичных волокон. Эластичные волокна, в отличие от коллагеновых, менее изучены. В основном это следствие технических трудностей, с которыми сталкиваются ученые при попытке солюбилизи-
Наука о гибкости
ровать их (Modis, 1991). Другой причиной является весьма тесная анатомическая, морфологическая, биохимическая и физиологическая взаимосвязь эластичных и коллагеновых волокон. Эластичные волокна могут включать коллагеновые волокна, переплетенные с их основными компонентами.
Оптически эластичные волокна являются однородными. Поэтому они характеризуются высокой рефрактерностью и являются практически изотропными. Если взглянуть на них в электронный микроскоп, мы увидим, что каждое волокно состоит из массы фибрилл, сплетенных в виде каната. Для эластичных волокон, в отличие от коллагеновых, характерно полное отсутствие периодической структуры (т. е. полосатости).
Поперечные соединения эластичной ткани. Предполагают, что эластичные волокна состоят из сети произвольно закрученных цепочек, имеющих ковалентные поперечные соединения. Нековалентные межцепочные силы считаются небольшими при достаточно большом расстоянии между поперечными соединениями (L.Weiss, Greep, 1983). Поэтому эластичные поперечные соединения не превращают молекулы в прочное кана-тообразное соединение типа коллагена. Значение этого различия будет рассмотрено ниже.
Эластин. Термин «эластичная ткань», или «эластичное волокно», имеет структурное значение. В то же время эластин определяет биохимический характер эластичных волокон. Это сложная структура, имеющая механическое свойство эластичности благодаря его биохимическому составу, а также физической конфигурации его отдельных молекул. Как и коллаген, эластин состоит из аминокислот. Однако в отличие от коллагена, он содержит главным образом неполярные гидрофобные аминокислоты, небольшое количество гидроксипролина и совсем не содержит гидроксили-зина. Особенностью эластина является также то, что в его состав входят десмозин и изодесмозин, которые выполняют роль ковалентных поперечных соединений в полипептидных цепочках и между ними. Подобно коллагену, примерно 1/3 остатка эластина представлена глицином, пролин составляет около 11%.
Влияние процесса старения на эластичные волокна. Вследствие процесса старения в эластичных волокнах происходят определенные физические и биохимические изменения. Они утрачивают свою эластичность, подвергаются фрагментации, кальцификации; количество поперечных соединений в них увеличивается. С точки зрения биохимических аспектов, происходит увеличение числа аминокислот, содержащих полярные группы, например, увеличивается содержание десмозина, изодесмо-зина и лизинонорлейцина. Другие изменения включают увеличение процента хондроитинсульфата В и кератосульфата. Вместе же эти изменения обусловливают возрастное снижение эластичности и увеличение ригидности (Bick, 1961; Gosline, 1976).
Ультраструктурная основа и физиологический предел удлинения эластина. Эластичные волокна легко поддаются растягиванию. Однако при устранении силы растягивания они возвращаются практически к исходной длине. Только при растягивании эластичных волокон более чем на
Г л а в а 4 ■ Соединительная ткань: фактор, ограничивающий гибкость
 150 % исходной длины они достигают точки разрыва; это происходит при воздействии силы всего лишь 20-30 кг-см~2 (Bloom, Fawcett, 1986).
150 % исходной длины они достигают точки разрыва; это происходит при воздействии силы всего лишь 20-30 кг-см~2 (Bloom, Fawcett, 1986).
Для объяснения эластичной силы, связанной с эластином, было предложено несколько моделей. Двухфазную модель эластина предложил Партридж (1966), а впоследствии ее использовали Вейс-Фог и Андерсон (1970а, 19706). В соответствии с этой моделью, эластин существует в виде отдельных частиц, прикрепленных друг к другу при помощи поперечных соединений с водой, которая находится в пространстве между частицами. Первоначальная форма частиц сферическая; при растягивании они приобретают овальные очертания. Этому изменению формы противодействует поверхностное напряжение. При устранении растягивания поверхностное напряжение снова возвращает частицам их сферическую форму. Хоев и Флори (1974) подвергли критике эту модель, основываясь на принципах термодинамики.
|
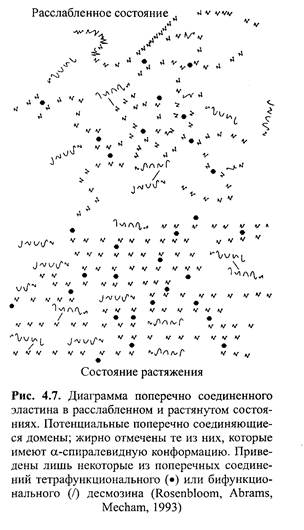
Согласно другой модели, эластин состоит из сети произвольно закрученных цепочек, имеющих ковалентные поперечные соединения. Эти соединения оказывают ограничивающее воздействие на относительное движение эластичных волокон, вследствие чего при растягивании ткани отдельные цепочки оказываются «скованными» и не могут скользить относительно друг друга. (Franz-blau, Faru, 1981). Однако ковалентные силы между цепочками слабые, а расстояние между поперечными соединениями достаточно большое. Вследствие этого минимальная, действующая в одном направлении сила вызывает значительное удлинение цепочек, прежде чем поперечные соединения начинают ограничивать движение. Гидрофобные домены в расслабленном состоянии имеют произвольные кольца (витки), в то же время в р-спиральной конфор-мации может существовать лишь ограниченная часть. В состоянии растяжения воздействующие силы обусловливают относительное размещение цепочек и ограничивают их конфор-мационную свободу (рис. 4.7).
Третья модель была предложена Урри (1984). В ее осно-
Наука о гибкости
 ве также лежит энтропический механизм, обеспечивающий эластомерную силу. Однако он основан на иной молекулярной конформации, изложенной вкратце Розенблумом, Эбремсом и Мечем (1993).
ве также лежит энтропический механизм, обеспечивающий эластомерную силу. Однако он основан на иной молекулярной конформации, изложенной вкратце Розенблумом, Эбремсом и Мечем (1993).

|
Энтропическая эластичность обусловлена /3-спиральной структурой с соответственно зафиксированной длиной от одного конца цепочки к другому. Пептидные сегменты между ^/-поворотами свободно подвергаются большой амплитуде и низкочастотным вращательным движениям, которые называются либрация-ми. После растягивания происходит снижение амплитуды либрации, вызывающее значительное сокращение энтропии сегмента, что обеспечивает движущую эластомерную силу для возвращения в расслабленное состояние.
Требуется проведение дополнительных исследований, чтобы определить, является ли верной какая-либо из этих моделей.
Дата добавления: 2015-12-20; просмотров: 1; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
