Ограничивающие гибкость
I
I
I '1
Скелетная мышца — одна из наиболее упорядоченных, структурно специализированных видов клеток. В последние годы было выявлено, что поперечнополосатая мышца имеет цитоскелет. Коок (1985) определяет цитоскелет поперечнополосатой мышцы как «систему регуляторных компонентов... [которые] обеспечивают физическую основу для сокращения».
ОБЩИЙ АНАЛИЗ МЫШЦ
Мышцы отличаются одна от другой формой и размером. Центральная часть мышцы называется брюшком. Брюшко состоит из более мелких ком-партментов, которые называются пучками. Пучки, в свою очередь, состоят приблизительно из 100-150 отдельных мышечных волокон, длина которых колеблется от 1 до 40 мм, а диаметр — от 10 до 100 мкм. Каждое мышечное волокно представляет собой отдельную мышечную клетку. Если рассматривать волокно под микроскопом, то можно увидеть, что оно имеет поперечнополосатую, или исчерченную, структуру. Такая структура мышечного волокна отражает ультраструктурную организацию каждой мио-фибриллы. Таким образом, чтобы понять, как мышцы сокращаются, расслабляются и удлиняются, нам необходимо рассмотреть структуру мио-
фибриллы.
СОСТАВ МИОФИБРИЛЛ И ИХ СОСТАВЛЯЮЩИЕ
Каждое мышечное волокно состоит из множества более мелких
единиц — миофибрилл (рис. 3.1; 3.2). На рис. 3.1 показан участок волок-
на, содержащий несколько очевидных миофибрилл. Диаметр каждой мио-
фибриллы составляет 1-2 мкм. Они располагаются скоплениями и по всей
|
|
|
длине мышечного волокна. Значительные колебания в ширине миофиб-
рилл обусловлены ультратонким методом рассечения. Очевидно, ширина
наибольшая, когда разрез совпадает с диаметром миофибриллы, наимень-
шая — когда он вдали от центра (Pollack, 1990). Каждая миофибрилла, в
свою очередь, состоит из длинной тонкой нити серийно взаимосвязанных
Наука о гибкости

Рис. 3.1. Электронная микрография волокна скелетной мышцы
саркомеров. Саркомеры представляют собой функциональную единицу мышцы. Их длина достигает 2-3 мкм. В конце каждого саркомера находится плотная граница — так называемая Z-линия (Z-полоска или Z-диск). Название происходит от немецкого слова zwischen — между. Таким образом, сегмент между двумя последовательными Z-линиями представляет собой функциональную единицу миофибриллы. Миофибриллы состоят из еще меньших структур, которые называются миофиламентами, или сокращенно — филаментами. Первоначально считали, что существует два вида филаментов: тонкий и толстый. В ранних исследованиях установлено, что типичная миофибрилла содержит приблизительно 450 толстых филаментов, расположенных в центре саркомера, и около 900 тонких филаментов, находящихся на его концах. На основании этих результатов подсчитали, что отдельное мышечное волокно, диаметр которого 10 нм, а длина 1 см, содержит около 8000 миофибрилл и что каждая миофибрилла состоит из 4500 саркомеров. Таким образом, отдельное волокно содержит в целом 16 миллиардов толстых и 64 миллиарда тонких филаментов (Vander, Sherman, Luciano, 1975). Согласно теории скольжения филаментов, которая будет изложена ниже, считалось, что эти филаменты являются единственными белковыми элементами, заставляющими мышцу сокращаться, расслабляться и удлиняться. Однако в 1970-80 гг. был обнаружен третий филамент.
|
|
|
 |
| Г л а в а 3 ■ Сократительные компоненты мышцы |
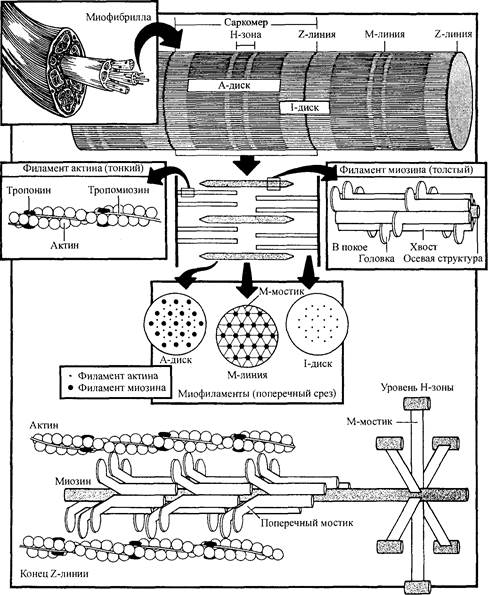
Рис. 3.2. Классическая организация скелетной мышцы
Химический состав этих трех филаментов можно определить на молекулярном уровне анализа. Филаменты состоят из белка, который сформирован последовательностью аминокислот и производится в мышечной клетке. Синтез аминокислот контролируют хромосомы в ядре мышечной клетки. Эти хромосомы представляют собой спиралевидную форму дезок-сирибонуклеиновой кислоты (ДНК), содержащей последовательность генов, которые подсказывают мышце, как правильно управлять аминокислотами.
|
|
|
Наука о гибкости
УЧАСТКИ САРКОМЕРА
Как отмечалось выше, миофибриллы характеризуются чередованием светлых и темных участков (см. рис. 3.1). Всего в саркомере существует пять зон. Мы уже говорили, что Z-линия образует плотную линию на обоих концах саркомера (т.е. на терминальных его точках). При сильном увеличении можно увидеть, что Z-линия имеет зигзагообразную форму. Частично это объясняется тем, что тонкие филаменты на обоих концах Z-линии не являются коллинеарными. Рис. 3.3 иллюстрирует модель Z-линии. Подобная конфигурация позволяет приспосабливаться к значительным колебаниям диаметра миофибрилл, увеличивая либо уменьшая латеральное разделение между филаментами. Такая структурная гибкость, вполне возможно, способствует пластичности мышц.
| Рис. 3.3. Схематическая модель Z-диска, включающая "истоки" тонкого филамента. Во взаимопересекающейся плоскости показана квадратная решетка тонких филаментов (Pollack, 1990) |
По соседству с Z-линией находится I-диск, оптически менее плотная полоска. I-диск включает филаменты актина, титина и I-мостики. Длина I-диска равна примерно 1,5 мкм. Темные участки саркомера называются А-дисками. Такое название они получили потому, что световая волна, проходящая через них, является анизотропической (ее скорость во всех направлениях неодинакова). Длина А-дисков около 1,0 мкм, что соответствует длине толстых филаментов. В центре каждого А-диска находится относительно менее плотный и более светлый участок — Н-зона; она расположена между кончиками тонких филаментов. Таким образом, размер Н-зоны зависит от длины мышцы или от степени взаимного перекрытия филаментов. И наконец, есть еще М-линия. Эта плотная структура находится в центре саркомера и соответствует нескольким параллельным М-мостикам.
|
|
|
Г л а в а 3 ■
Сократительные компоненты мышцы
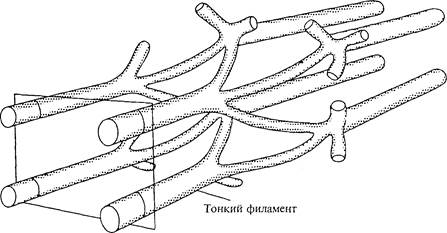
 УЛЬТРАСТРУКТУРА ТОНКОГО ФИЛАМЕНТА: АКТИН
УЛЬТРАСТРУКТУРА ТОНКОГО ФИЛАМЕНТА: АКТИН
Тонкий филамент называется актином. Его диаметр около 5-6 нм, а длина — примерно 1 мкм. При низкой разрешающей способности этот филамент напоминает жемчужное ожерелье, в котором две нити накручены одна на другую (см. рис. 3.2). Эта структура накручивания двух нитей не является правильной, как считалось раньше; она полупроизвольная (Egelman, Francis, Derosier, 1982). Актин не единственный компонент тонкого филамента. Внутри или вдоль последнего находится несколько других белков, включая небулин, тропонин и тропомиозин. Они служат для ругуляции связывания филаментов.
Дата добавления: 2015-12-20; просмотров: 21; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
