обработка результатов
1. заполнить таблицу 2:
Таблица2
| [Fe]общ, моль/л | V(KSCN), мл | D |  , моль/л , моль/л
| [KSCN], моль/л | [KSCN]-2, моль/л |
| 0,00465 | 0,895 | 0,005196 | 0,04 | ||
| 0,902 | 0,005155 | 0,06 | 277,78 | ||
| 0,99 | 0,004697 | 0,08 | 156,25 | ||
| 1,083 | 0,004294 | 0,1 | |||
| 1,096 | 0,004243 | 0,12 | 69,45 | ||
| 1,102 | 0,004220 | 0,14 | 51,02 | ||
| 1,118 | 0,004159 | 0,16 | 39,06 |
Примеры расчета:
1.  моль/л,
моль/л,
где С (KSCN) = 1 моль/л;
50 – объем мерной колбы, мл;
V (KSCN) – берется из условий эксперимента, мл.
2.  моль/л,
моль/л,
где С(Fe)cт – концентрация стандартного раствора соли железа, моль/л, в пересчете на железо
V(Fe)ст – обьем стандартного раствора соли железа взятый для приготовления рабочих растворов, мл
50 – обьем мерной колбы, мл.
3. Построить график

4. Выявляют линейный участок графической зависимости и экстраполируют его до пересечения с осью ординат. Находят tga и а, по значениям которых вычисляют Kn и e по формулам  и
и 
а=0.005
a=1,98
tga=0.034
K= 
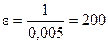
4. Вычисляют  по формуле:
по формуле:  =
=
=-10,53+89,96+8,31*298*1,94=4826,45кДж
Вывод: в ходе данной работы с помощью фотометрического исследования мы получили экспериментальные данные зависимости оптической плотности раствора соли железа от концентрации роданида калия. После обработки полученных данных построили графическую зависимость в координатах  /[KCNS]-2. По полученному графику нашли tga и а, по значениям которых вычислили Kn и e, затем получили значение энергии Гиббса реакции.
/[KCNS]-2. По полученному графику нашли tga и а, по значениям которых вычислили Kn и e, затем получили значение энергии Гиббса реакции.
Дата добавления: 2015-12-16; просмотров: 14; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
