Двойной электрический слой. Электрокинетические явления
Электрокинетические явления - это явления, в которых обнаруживается взаимосвязь между относительным перемещением фаз и электрическим полем. Они обусловлены наличием двойного электрического слоя (ДЭС) на поверхности раздела фаз. ДЭС возникает в результате взаимодействия соприкасающихся фаз благодаря наличию избыточной поверхностной энергии. Система стремится уменьшить поверхностную энергию, что приводит к определённой ориентации полярных молекул, ионов и электронов в поверхностном слое. При этом соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины.
Теория строения ДЭС развивалась в трудах Гельмгольца, Гуи, Чепмена, Штерна, Фрумкина и др. Общие положения о строении ДЭС сформулированы Штерном. Теория Штерна базируется на следующих предпосылках:
1. ДЭС состоит из ионов одного знака, прочно связанных с дисперсной твердой фазой, и эквивалентного количества противоионов, присутствующих в дисперсионной среде.
2. Определяющими факторами строения ДЭС являются:
- межмолекулярные (ван-дер-ваальсовы) силы, т.е. специфическое адсорбционное взаимодействие ионов с поверхностью раздела фаз;
- электростатическое взаимодействие ионов с заряженной поверхностью и друг с другом;
- тепловое движение ионов.
3. Так как радиус действия адсорбционных сил мал, то выделяют до некоторой степени условно две основные части ДЭС:
- «плотную» часть - слой Штерна-Гельмгольца или адсорбционный слой. В ней адсорбционные силы существенны. Она локализована на плоскости поверхности;
|
|
|
- «диффузную» часть - слой Гуи-Чепмана, где этими силами можно пренебречь. Она распространяется в глубь раствора.
Толщина адсорбционного слоя 8 принимается равной диаметру гидратированного противоиона. Эта часть ДЭС состоит из двух частей:
- «внутренней» - потенциалопределяющих ионов (ПИ), которые определяют величину и знак заряда поверхности. Они должны обладать химической определённостью, т.е. быть составляющими твёрдой фазы. Их адсорбция носит специфический характер, являясь типичной хемосорбцией;
- «внешней» - ионов, которые подтягиваются к ПИ вследствие электростатического взаимодействия и действия адсорбционных сил со стороны твёрдой поверхности. В адсорбционном слое с увеличением расстояния от поверхности потенциал снижается линейно.
Диффузную часть ДЭС образуют оставшиеся противоионы. Они обладают значительной подвижностью. За толщину диффузной части ДЭС принято расстояние l, на котором потенциал диффузной части слоя jd уменьшается в е раз
Толщина адсорбционного слоя постоянна и не меняется при изменении внешних условий. Диффузный слой противоионов имеет переменную толщину, которая уменьшается с ростом концентрации электролита, заряда ионов и с понижением температуры. Чем больше концентрация ионов в дисперсионной среде, тем сильнее смещается равновесие в сторону перехода ионов из объема раствора в поверхностный слой, из диффузного слоя в адсорбционный. При больших концентрациях электролита в дисперсионной среде ДЭС предельно уплотняется и по толщине становиться равным адсорбционному. Такое состояние системы называется изоэлектрическим. Заряд поверхности полностью компенсируется зарядом противоионов адсорбционного слоя.
|
|
|

Двойной электрический сдой и изменение в нем потенциала как функции расстояния х от поверхности:
1 -плоскость максимального приближения, разделяющая неподвижный монослой адсорбированных ионов и диффузный слой;
2 - плоскость скольжения, отделяющая гидродинамически неподвижную (а) и подвижную части жидкости (б)
j0 -электрический потенциал поверхности;
y - потенциал адсорбционного слоя;
jd - потенциал диффузионного слоя;
z (дзета) - электрокинетический потенциал
Электрокинетический потенциал - разность потенциалов на плоскости скольжения, возникающая между неподвижной и подвижной частями слоя в объёме жидкости при отрыве части диффузного слоя; этот потенциал отражает свойства ДЭС, характеризует природу фаз и межфазное взаимодействие. Величина дзета-потенциала определяется числом противоионов в диффузном слое, т.е. его толщиной, и всегда меньше полного скачка потенциала j0 на границе твердая фаза - дисперсионная среда. Величина дзета-потенциала зависит также от концентрации электролита в дисперсионной среде, ее рН и температуры. Активное воздействие на величину дзета-потенциала оказывает тот ион добавляемого электролита, который к ПИ является противоионом. Степень такого воздействия определяют валентность и величина радиуса противоиона. Чем выше валентность и чем больше радиус противоиона, тем сильнее его влияние на величину дзета-потенциала. Это связано с его большей адсорбируемостью и большей способностью проникать за плоскость скольжения в адсорбционный слой и как бы нейтрализовать (связывать) ПИ, и таким образом уменьшать толщину диффузного слоя.
|
|
|
Лиофобные дисперсные системы обладают большим запасом поверхностной энергии. Поэтому они склонны к сокращению площади поверхности раздела фаз, что приводит к самопроизвольному слипанию частиц дисперсной фазы и разделению фаз - расслаиванию системы.
|
|
|
Для того чтобы исключить этот процесс, дисперсная система должна быть стабилизирована. Достигается это адсорбцией на поверхности образующихся частиц дисперсной фазы ПАВ или соответствующих ионов электролита - стабилизатора.
Стабилизирующее действие электролитов рассмотрим на примере образования лиофобного гидрозоля сульфата бария по реакции, протекающей в водном растворе:

Если взять BaClв недостатке, на поверхности образующихся в результате реакции кристаллов BaS04 в момент их зарождения будут адсорбироваться те ионы электролита-стабилизатора, которые могут достраивать кристаллическую решетку дисперсной фазы, т.е. её составляющие (правило Панета-Фаянса). Такими ионами в рассматриваемом примере являются ионы SO42-. В результате образуются ядра коллоидных частиц, которые несут в среднем по 2n отрицательных электрических зарядов, поступивших с ионами SO42- (потенциалопределяющие ионы)
[mBaS04 × nSO42-]2n-.
Под действием сил электростатического взаимодействия из раствора к ядрам притягиваются в среднем по (п - х) присутствующих в системе противоионов Са2+ (знак зарядов этих ионов противоположен знаку зарядов ядер). В результате образуются отрицательно заряженные коллоидныечастицы
[mBaS04 × nSO42- × (n-x)Ca2+]-2x.
Электрический заряд коллоидных частиц равен алгебраической сумме электрических зарядов потенциалопределяющих ионов (-2n) и противоионов, входящих в состав этих частиц [+2(п-х)] (с учетом их знаков):
- 2n + [+2(n-x)] = -2х.
Оставшаяся часть х противоионов Са2+ остается в растворе и обладает свободой движения под действием диффузионных сил, совместно с коллоидной частицей образуют мицеллы, состав которых можно описать формулой:
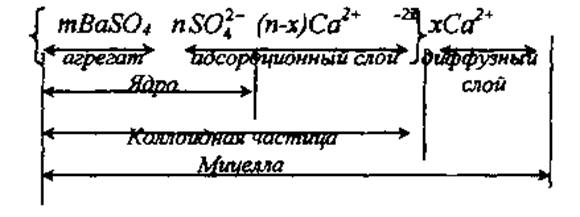
Мицеллы – это частицы дисперсной фазы с ДЭС в дисперсной системе.
Если изменить электролит-стабилизатор (например, взять ВаСl2 в избытке), то это повлечет за собой изменение знака потенциалопределяющих ионов и приведёт к изменению знака электрических зарядов самих коллоидных частиц:

Но в любом случае мицеллы электронейтральны. Они представляют собой структурные единицы дисперсных систем.
Дата добавления: 2015-12-18; просмотров: 51; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
