Влияние неиндифферентных электролитов
При введении в золь неиндифферентных электролитов возможны 2 случая.
1. В золь вводится электролит, содержащий потенциалопределяющий ион (неиндифферентный ион), второй ион в электролите является индифферентным. При этом одновременно будет возрастать концентрация и потенциалопределяющих ионов и противоионов. Это обусловливает появление двух противоположных тенденций: с одной стороны, увеличение концентрации потенциалопределяющих ионов приводит к росту потенциала ядра  , а, следовательно, и
, а, следовательно, и  потенциала, с другой – возрастающая концентрация противоионов вызывает сжатие ДЭС и снижение
потенциала, с другой – возрастающая концентрация противоионов вызывает сжатие ДЭС и снижение  потенциала.
потенциала.
При малых концентрациях электролита преобладает первая тенденция. Адсорбция потенциалопределяющих ионов продолжается до достижения предельной адсорбции и  потенциал по абсолютному значению возрастает. После достижения предельной адсорбции потенциал ядра остается неизменным, но за счет влияния индифферентных противоионов ДЭС сжимается,
потенциал по абсолютному значению возрастает. После достижения предельной адсорбции потенциал ядра остается неизменным, но за счет влияния индифферентных противоионов ДЭС сжимается,  потенциал уменьшается. Например, для положительного золя
потенциал уменьшается. Например, для положительного золя  (44) неиндифферентным электролитом первого типа является
(44) неиндифферентным электролитом первого типа является  , влияние которого на строение ДЭС и
, влияние которого на строение ДЭС и  потенциал показано на рис. 36, 37.
потенциал показано на рис. 36, 37.

Для отрицательного золя  (43) неиндиффернтными электролитами являются
(43) неиндиффернтными электролитами являются  ,
,  (
(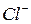 и
и  – изоморфные ионы).
– изоморфные ионы).
2. В систему вводится электролит, содержащий ион, способный образовывать с потенциалопределяющим ионом малорастворимое соединение. В этом случае возможна перезарядка золя.
|
|
|
Например, в положительный золь  (44) вводится иодид калия (
(44) вводится иодид калия ( ).
).
 . (44)
. (44)
Ион  , вводимый с
, вводимый с  , будет образовывать с потенциалопределяющими ионами
, будет образовывать с потенциалопределяющими ионами  малорастворимое соединение
малорастворимое соединение  . Молекулы
. Молекулы  будут встраиваться в кристаллическую решетку. В результате по мере увеличения концентрации
будут встраиваться в кристаллическую решетку. В результате по мере увеличения концентрации  количество потенциалопределяющих ионов будет уменьшаться, следовательно, будет уменьшаться и потенциал ядра
количество потенциалопределяющих ионов будет уменьшаться, следовательно, будет уменьшаться и потенциал ядра  , что приведет к сжатию ДЭС и снижению
, что приведет к сжатию ДЭС и снижению  потенциала. Этот процесс будет продолжаться до тех пор, пока все ионы
потенциала. Этот процесс будет продолжаться до тех пор, пока все ионы  не свяжутся с ионами
не свяжутся с ионами  ,
,  и
и  потенциалы при этом достигнут нулевого значения.
потенциалы при этом достигнут нулевого значения.
После введения в систему избытка  потенциалопределяющим ионом станет ион
потенциалопределяющим ионом станет ион  , а противоионом – ион
, а противоионом – ион  . Частицы золя приобретут отрицательный заряд. Кроме того, нитрат серебра, содержащийся в дисперсионной среде, вступит в реакцию с введенным йодидом калия, в результате в системе образуется дополнительное количество отрицательно заряженной дисперсной фазы.
. Частицы золя приобретут отрицательный заряд. Кроме того, нитрат серебра, содержащийся в дисперсионной среде, вступит в реакцию с введенным йодидом калия, в результате в системе образуется дополнительное количество отрицательно заряженной дисперсной фазы.
Формула мицеллы золя  после перезарядки
после перезарядки
 .
.
При дальнейшем введении  имеет место первый случай: адсорбция ионов йода будет продолжаться до достижения предельной адсорбции, вызывая повышение по абсолютному значению
имеет место первый случай: адсорбция ионов йода будет продолжаться до достижения предельной адсорбции, вызывая повышение по абсолютному значению  и
и  потенциалов, после чего превалирующее влияние начнет оказывать индифферентный противоион
потенциалов, после чего превалирующее влияние начнет оказывать индифферентный противоион  , рост концентрации которого в золе приведет к снижению
, рост концентрации которого в золе приведет к снижению  потенциала при неизменном потенциале ядра (рис. 38, 39).
потенциала при неизменном потенциале ядра (рис. 38, 39).
|
|
|

3.4.3. Влияние рН среды
Введение в золь ионов  и
и 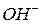 может сильно сказываться на величине
может сильно сказываться на величине  потенциала, т.к. эти ионы обладают высокой адсорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
потенциала, т.к. эти ионы обладают высокой адсорбционной способностью: первые – благодаря малому радиусу, что позволяет им близко подходить к поверхности твердой фазы, вторые – из-за большого дипольного момента (большой поляризуемости).
3.4.4. Влияние природы дисперсионной среды
Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью 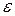 и вязкостью
и вязкостью  .
.
Электрокинетический потенциал частиц золя тем больше, чем меньше 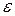 (полярность растворителя).
(полярность растворителя).
Чем больше вязкость, тем толще слой дисперсионной среды, который прилипает к частице при разрыве мицеллы и, следовательно, тем больше численное значение  потенциала.
потенциала.
Лекция 11
Дата добавления: 2015-12-18; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
