Методы фотометрического анализа
Фотометрический анализ можно производить спектрофотометрическим или фотоэлектроколориметрическим методами.
Фотоэлектроколориметрия - анализ на основе измерения поглощения окрашенными растворами не монохроматического излучения видимой области спектра. Измерения производят с помощью фотоэлектроколориметров, снабженных узкополосными светофильтрами с шириной полосы пропускания 20-40 нм, если исследуемое вещество не окрашено, его можно перевести в окрашенное соединение, проведя химическую реакцию с определенными реагентами (фотометрическую аналитическую реакцию).
Спектрофотометрия - анализ на основе измерения поглощения монохроматического излучения (ширина полосы пропускания 1-З нм) ультрафиолетовой, видимой и инфракрасной областей спектра. Такие измерения проводят с помощью спектрофотометров, где в качестве монохроматизаторов используются диспергирующие призмы и дифракционные решетки.
Фотометрический метод имеет низкий предел обнаружения (10-5 – 10-6 М), достаточно высокую точность. Относительная ошибка определения этими методами составляет примерно 1-2%.
1.2. Основной закон светопоглощения (закон Бугера-Ламберта-Бера)
Между количеством поглощенной световой энергии, толщиной слоя поглощающего вещества и его количеством существует определенная зависимость, выраженная основным законом светопоглощения - законом Бугера-Ламберта-Бера. Основной закон светопоглощения выведен для монохроматического излучения (рис. 1.1).
|
|
|

|
 | |||||
 | |||||
 |
l
Рис. 1.1. Прохождение света через окрашенный раствор
Уменьшение интенсивности света, прошедшего через раствор, характеризуется величиной пропускания и обозначается Т:
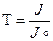
где J - интенсивность светового потока, прошедшего через раствор;
Jo - интенсивность падающего на раствор светового потока.
Пропускание Т изменяется ог 0 до 100%.
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера:
J = Jo · 10 -εlC
или в логарифмической формуле:

где: с - концентрация вещества, поглощающего свет;
l - толщина слоя раствора, поглощающего свет;
ε - коэффициент поглощения;
Jo - интенсивность падающего на раствор светового потока;
J - интенсивность црошедшего через раствор светового потока.
Величина  является важной характеристикой раствора, поглощающего свет, и называется оптической плотностью (иногда погашением или экстинцией), обозначается А. Оптическая плотность изменяется от О до ∞;
является важной характеристикой раствора, поглощающего свет, и называется оптической плотностью (иногда погашением или экстинцией), обозначается А. Оптическая плотность изменяется от О до ∞;
А = ε l C;  ; А = - lg T.
; А = - lg T.
Общий закон светопоглощения - оптическая плотность раствора пропорциональна произведению концентрадии поглощающего свет вещества на толщину слоя раствора.
|
|
|
Физический смысл закона - растворы одного и того же вещества при одинаковой концентрации и толщине слоя поглощаот равные количества световой энергии.
Если С = 1 моль/л, 1 = 1 см, то А = ε. Следовательно, коэффициент светопоглощения, называемый при этих значениях С и 1 молярным коэффициентов поглощения, равен оптической плотности одномолярного раствора при толщине слоя 1 см. Если раствор вещества поглощает в видимой области, величина ε характеризует интенсивность окраски данного вещества в растворе. Значение ε для различных веществ колеблется от единицы до сотен тысяч.
Молярный коэффициент светопоглощения зависит от природы вещества, поглощающего свет, от длины волны проходящего света, от температуры ине зависит от концентрации и толщины слоя раствора, т.е. при определенной длине волны и температуре, молярный коэффициент поглощения представляет собой постоянную для данного соединения величину и является индивилуальной характеристикой вещества, по которой можно судить о природе исследуемого вещества.
Чем больше ε, тем меньшие количества вещества могут быть определены, исходя из того, что А можно измерить достаточно надежно если А > 0,5, С = A/ελ. Таким образом, для повышения чувствительности определения необходимо выбирать такие реакции, в результате которых образуются соединения, обладающие большим значением ε.
|
|
|
В реальных условиях определяют кажущееся значение молярного коэффициента поглощения ε. Определение истинного значения ε требует выполнения ряда условий и специальных методов расчета.
1.3. Спектр светопоглощения
(спектральная характеристика вещества)
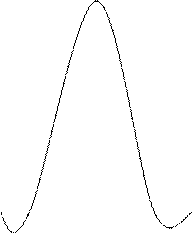
Спектром поглощения называют зависимость оптической плотности раствора от длины волны. Спектр поглощения является индивидуальной характеристикой вещества, т.к. зависит от молекулярного строения данного вещества. Его обычно представляют в виде графика (рис. 1.2), на котором по оси абсцисс откладываются длины волн или частоты. Ординатами спектра поглощения могут быть оптические плотности (А), логарифмы оптических плотностей, молекулярные козффициенты светопоглощения (ε) или логарифмы молекулярных коэффициентов светопоглощения (рис. 1.3).
Основной характеристикой спектральной линии или участка спектра является их поглощение в спектре. Оно определяется длиной волны или частотой. Полоса поглощения характеризуется тремя основными параметрами: максимальным значением коэффициента светопоглощения ε, длиной волны λ макс, соответствующей ε макс и полушириной спектра (ав  ) (рис. 1.3). Чем больше значение ав, тем труднее проводить анализ смеси из-за наложения полос поглощения, соответствующих отдельным компонентам смеси.
) (рис. 1.3). Чем больше значение ав, тем труднее проводить анализ смеси из-за наложения полос поглощения, соответствующих отдельным компонентам смеси.
|
|
|
Спектры поглощения одного и того же вещества в координатах А - λ. имеют одинаковую форму независимо от толщины слоя раствора или концентрации вещества в растворе (рис. 1.4) и характеризуются максимумом при одной и той же длине волны.
 |


 T, A ε
T, A ε
 |
a b
 εmax
εmax
 | |||
 | |||
λmax λ, нм λmax λ, нм
| Рис. 1.2. Спектр светопоглощения вещества (спектральная характеристика) | Рис. 1.3. Параметры, характеризующие полосу поглощения в спектре. |
Принимая во внимание, что ε не зависит от концентрации раствора и толщины поглощающего слоя, спектры поглощения более оправданно представлять в координатах ε - λ. Однако, обычный спектр поглощения представляют в виде графика А = f (λ). Это простейший способ, т.к. значения А и λ снимают непосредственно со шкалы прибора, в автоматических спектрофотометрах зависимость А = f (λ) записывается автоматически.
Количественный анализ по светопоглощению следует проводить при длине волны λмакс, отвечающей ε макс, т.к. ошибка определения концентрации в этом случае наименьшая.
Если длина волны максимума поглоiцения по каким-либо причинам не доступна для использования, то измерения проводят при длине волны возможно более близкой к максимуму. Обычно цветсветофильтра соответствует тому участку спектра, который этим светофильтром пропускается. Чувствительность определения повышается с увеличением степени монохроматизатхии потока световой энергии.
 А
А
 |
λ max λ, нм
Рис. 1.4. Зависимость оптической плотности от длины волны при различных концентрациях вещества в растворе (С4>С3>С2>С1).
В зависимости от ширины полосы выделяемого спектра (или другими словами - монохроматизации применяемого света), в методах анализа по светопоглощению различают фотоколориметрию и спектрофотометрию.
Приборы, применяемые в фотоколориметрии - фотометры, фотоэлектроколориметры; в спектрофотометрии - различные типы спектрофотометров.
Спектрофотометры позволяют выделить монохроматизатором существенно более узкий диапазон длин волн, что позволяет подробно исследовать изменение олтической плотности (спектр) в узком диапазоне частот. Это обеспечивает большую чувствительность определения по сравнению с фотоколориметрией (рис. 1.5).

 A
A
 | ||
 |
λ, нм
Рис. 1.5. Спектры светопоглощения раствора КМnО4
________ - измеренный на cпектрофотометре;
------------ - полученный с помощью фотоколориметра
1.4. Отклонения от основного закона светопоглощения
Закон Бугера-Ламберта-Бера справедлив для монохроматического излучения. Поэтому одной из причин отклонения от линейной зависимости оптической плотности растворов от толщины поглощающего слоя и концентрации является недостаточная монохроматичность светового потока.
Другой причиной отклонения от закона Бугера-Ламберта-Бера является изменение состояния поглощающего вещества в растворе. Это возможно в следующих случаях:
1.В раствореприсутствуют посторонние электролиты, вызывающие деформацию молекул и ионов окрашенных веществ(особенно комплексных), вследствие чего изменяется их светопоглщение.
2. При изменении концентрации раствора изменяется степень гидратации (сольватации), что вызывает при разбавлении непропорциональное изменение светопоглощения раствора.
З. Полнота образования окрашенного соединения зависит от рН среды. Например, под влиянием ионов Н+ нарушается равновесие
Me2+ + RH2 ↔ RMe + 2H+.
В кислой среде комплексное соединение становится менее устойчивым.
4. Изменяется степень диссоциацик поглощающего вещества при разбавлении. Если имеем малоустойчивое комплексное соединение, то при изменении концентрации раствора линейная зависимость между А и С нарушается.
1.5. Закон аддитивности светопоглощения
В соответствии с этим законом при наличии в растворе нескольких поглощающих веществ, каждое из них будет давать свой аддитивный вклад в экспериментально измеряемую оптическую плотность смеси Асмеси:
Аλсмеси = Аλ1 + Аλ2 + Аλ3 + … + Аλn
где Аλ1, Аλ2 и т.д. - оптическая плотность вещества 1, 2 и т.д. при длине волны λ.
Так как А = εlC, то
Аλсмеси = l (ελ1C1 + ελ2C2 + ελ3C3 + …. + ελnCn) = Σ ελi l Ci
где С1, C2 и т.д. - концентраiдия вещества 1, вещества 2 и т.д.;
ελ1, ελ2 и т.д. - молярный коэффициент поглощения вещества 1, вещества 2 и т.д. при длине волны λ.
Закон аддитивности позволяет определить вещество в присутствии друтих веществ без предварительного его выделения.
1.6. Качественный спектрофотометрический анализ
Поскольку спектрофотометр позволяет детально исследовать спектр поглощения, отражающий молекулярное строение вещества, его используют для идентификации и исследования строения молекул. Идентификация веществ может быть проведена на основе определения истинного значения (по соответствующим таблицам). Кроме того, можно идентифицировать исследуемое вещество, записывая его спектр поглощения в различных растворителях и сравнивая с соответствующими спектрами известных веществ. Существуют специальные атласы, в которых приведены спектры поглощения различных веществ.
Особый интерес представляют спектры поглощения в инфракрасной области. Главная область применения ИК-спектров - это установление строения молекул, характера связи между отдельными атомами. Это возможно благодаря тому, что группам атомов и различным функциональным группам (карбонильным, карбоксильным, гидроксильным и т.д.) соответствуют определенные полосы поглощения в ИК-спектрах (так называемые характеристические полосы). Эти характеристические полосы наблюдаются в определенной области ИК-спектра всех веществ, содержащих соответствующие функциональные группы.
Качественный анализ в инфракрасной области спектра в основном сводится к двум способам:
- снимают спектр неизвестного вещества и сравнивают со спектрами известных веществ, которые имеются в специальных каталогах и таблицах;
- в спектре неизвестного вещества отыскивают характеристические полосы, по которым можно судить о составе вещества.
Дата добавления: 2016-01-05; просмотров: 85; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
